BS.CKII. Thượng Thanh Phương
BV Nhân Dân 115
I. ĐẶT VẤN ĐỀ
Lp(a) là một yếu tố nguy cơ quan trọng cho bệnh tim mạch, được quyết định chủ yếu bởi yếu tố di truyền và ít bị ảnh hưởng bởi các yếu tố không di truyền. Việc đo lường Lp(a) nên được xem xét trong đánh giá nguy cơ tim mạch, đặc biệt đối với những người có tiền sử gia đình về bệnh tim mạch. Nghiên cứu và phát triển các liệu pháp điều trị mới để giảm nồng độ Lp(a) là cần thiết để cải thiện sức khỏe tim mạch. Hiện tại chúng ta đã có khá nhiều Hiệp hội uy tín khác nhau khuyến cáo về vấn đề này. Hướng dẫn của Hội tim mạch /trường môn tim mạch Hoa Kỳ (AHA/ACC) về quản lý cholesterol trong máu, đưa ra các chỉ định tương đối để đo Lp(a); Hướng dẫn của Hội tim Châu Âu/Hội xơ vữa động mạch Châu Âu (ESC/EAS) về quản lý rối loạn lipid máu, khuyến nghị sàng lọc phổ quát đối với Lp(a) trong đó mỗi cá nhân nên đo Lp(a) ít nhất một lần trong đời. Đồng thuận của Hội Lipid Quốc gia (NLA) về việc sử dụng Lp(a) trong thực hành lâm sàng đã cung cấp những hướng dẫn về thời điểm hợp lý để đo Lp(a); và Đồng thuận của HEART UK về Lp(a) cũng phác thảo các điều kiện theo đó Lp(a) cần được đo. Gần đây hướng dẫn của Hiệp hội Tim mạch Canada về quản lý rối loạn lipid máu ở người trưởng thành nhằm giảm nguy cơ tim mạch, cũng khuyến cáo nên đo Lp(a) ít nhất một lần ở người trưởng thành như một phần của việc sàng lọc lipid ban đầu và thông tin này được sử dụng để xác định bệnh nhân nào cần được quản lý tích cực các yếu tố nguy cơ tim mạch có thể thay đổi được. Bài viết dưới đây chúng ta sẽ cùng nhìn lại y văn hiện hành trên 5 vấn đề:
- Cấu trúc, hình thành và chuyển hóa của Lp(a)
- Cơ chế gây bệnh và bằng chứng nguy cơ
- Đo lường Lp(a) trong thực hành và các yếu tố ảnh hưởng
- Điều trị làm giảm Lp(a)
- Các hướng dẫn hiện hành về Lp(a)
II. GIẢI QUYẾT VẤN ĐỀ
1. Cấu trúc, hình thành và chuyển hóa của Lp(a)
– Lp(a) bao gồm một hạt lipoprotein chứa apoB có lõi là lipid trung tính (cholesteryl ester [CE] và triglycerid [TG]) được bao quanh bởi một phân tử apoB-100 và lớp vỏ lưỡng tính của phospholipid (PL) và cholesterol tự do (FC). ApoB-100 được liên kết cộng hóa trị với apo(a) bằng một liên kết disulfide đơn, giúp phân biệt Lp(a) với tất cả các lipoprotein chứa apoB khác. Apo(a) bao gồm các miền cấu trúc lặp lại được gọi là vòng Kring; có 10 loại vòng Kringle IV (KIV) khác nhau (IV1–IV10 ) dựa trên trình tự axit amin, với KIV2 hiện diện với số lần lặp lại khác nhau ở các dạng đồng phân apo(a) khác nhau, bản sao của vòng kringle V (V) –trình tự giống protease (P) không hoạt động (Hình 1).
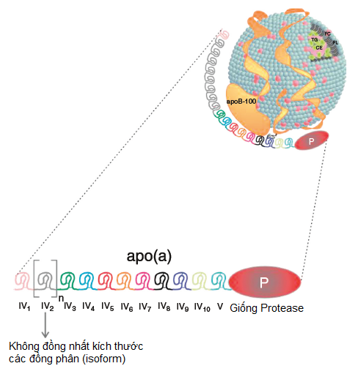
Hình 1: Cấu trúc Lp(a)
– Quá trình lắp ghép hình thành Lp(a) sẽ tuân theo mô hình 2 bước, ban đầu các tương tác không cộng hóa trị giữa các vị trí gắn kết lysine trong KIV7 và KIV8 với các lysine chuyên biệt ở đầu amino của apoB-100, sau đó hình thành liên kết disulfide mà phản ứng này được xúc tác bởi một enzyme giống oxidase. Vị trí của các bước tương ứng được xác định rõ trong Hình 2.
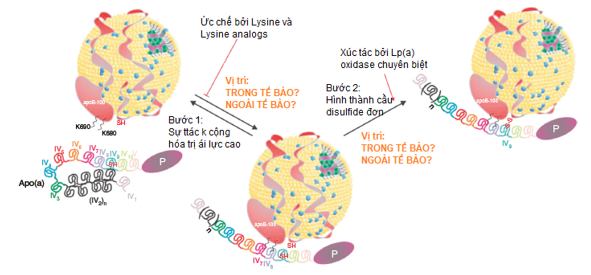
Hình 2: Sự lắp ghép hình thành Lp(a)
– Sinh tổng hợp và dị hóa Lp(a) được diễn ra ở gan. Sự biểu hiện Apo(a) ở gan là yếu tố chính để quyết định nồng độ Lp(a) trong huyết tương và được chi phối bởi quá trình phiên mã (bao gồm thông qua cả yếu tố IL-6), quá trình gấp và bài tiết, phần lớn được kiểm soát bởi kích thước đồng dạng của apo(a) . Sau đó, apo(a) liên kết với lipoprotein chứa apoB-100– thông qua tương tác gắn kết lysine và hình thành liên kết disulfide. LPA là gen mã hóa apo(a), tính đa hình đã được chứng minh là có liên quan đến việc xác định nồng độ Lp(a) huyết tương và nguy cơ mắc bệnh tim mạch. Phần lớn Lp(a) huyết tương được dị hóa ở gan. Nhiều thụ thể có liên quan đến quá trình dị hóa Lp(a), bao gồm các thụ thể LDLR, LRP1, SR-B1 và plasminogen (Hình 3).
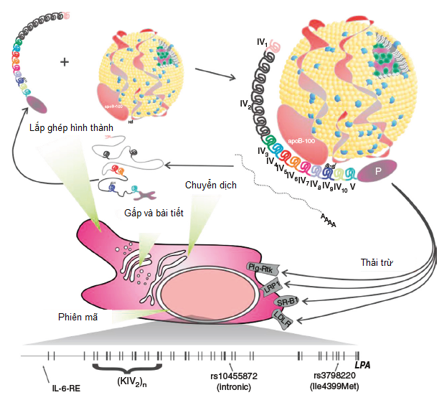
Hình 3: Sinh tổng hợp và dị hóa Lp(a)
2. Cơ chế gây bệnh và bằng chứng nguy cơ
– Lp(a) có phổ rộng các đặc tính bao gồm tính sinh xơ vữa, sinh huyết khối và các đặc tính tiền viêm; vì thế, nó có thể có tác động bệnh lý đến nhiều hệ thống trên toàn cơ thể. Chức năng sinh lý của nó đã là một chủ đề còn nhiều tranh luận và người ta cho rằng nó có vai trò trong tiến trình chữa lành vết thương. Ước tính có khoảng 20-25% dân số được cho là có mức Lp(a) tăng cao. Cùng với thành tố LDL, Apo(a) trong Lp(a) là một protein giống plasminogen với các cơ chế mang nhiều đặc tính gây bệnh đã được ghi nhận:
- Viêm: Lp(a) có thể kích hoạt các phản ứng viêm trong thành mạch máu, dẫn đến tổn thương và xơ vữa động mạch.
- Đông máu: Apolipoprotein (a) cạnh tranh với plasminogen, giảm khả năng phân hủy cục máu đông, dẫn đến tăng nguy cơ hình thành huyết khối.
- Xơ vữa động mạch: Lp(a) dễ dàng thâm nhập vào thành mạch máu, tích tụ và tạo thành mảng xơ vữa, gây hẹp động mạch và giảm lưu thông mạch máu.
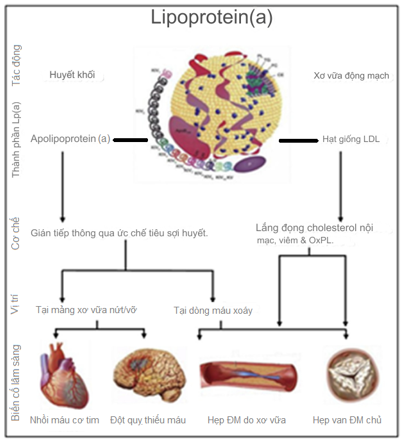
Hình 4: Cơ chế sinh bệnh Lp(a) gây biến cố tim mạch do xơ vữa và hẹp van ĐM chủ
– Hiện tại các dữ liệu sẵn có, chất lượng cao từ các phân tích tổng hợp, nghiên cứu quan sát lớn, nghiên cứu ngẫu nhiên Mendelian và nghiên cứu liên kết toàn bộ hệ gen lớn (Large genome-wide association studies) đã cho thấy có mối quan hệ giữa tăng nồng độ Lp(a) và các kết cục bất lợi quan trọng về (1) Bệnh tim mạch do xơ vữa, (2) Hẹp van động mạch chủ và (3) Tử vong do mọi nguyên nhân
Bảng 1: Lp(a) tăng gây kết cục bất lợi từ các bằng chứng hiện tại
| Nguồn dữ liệu chất lượng cao | Nhồi máu cơ tim | Đột quỵ do thiếu máu cục bộ | Hẹp động mạch xơ vữa* | Hẹp van động mạch chủ | Tử vong do tim mạch | Tử vong do mọi nguyên nhân |
| Phân tích tổng hợp các nghiên cứu quan sát | Có | Có | Không | Không | Có | Có |
| Các nghiên cứu quan sát lớn† | Có | Có | Có | Có | Có | Có |
| Các nghiên cứu ngẫu nhiên Mendelian lớn | Có | Có | Có | Có | Có | Có |
| Các nghiên cứu liên kết toàn bộ hệ gen lớn | Có | Không | Có | Có | Không | Không |
* Triệu chứng lâm sàng dưới dạng đau thắt ngực ổn định hoặc khập khiễng cách hồi hoặc hẹp động mạch xơ vữa được ghi nhận ở động mạch vành, động mạch đùi, hoặc động mạch cảnh.
† Sử dụng các phép đo Lp(a) không nhạy cảm với kích thước isoform.
3. Đo lường Lp(a) trong thực hành và các yếu tố ảnh hưởng
– Nồng độ Lp(a) trong máu phần lớn được quyết định bởi gen, chiếm tới 80-90% các trường hợp. Các yếu tố không di truyền như chế độ ăn uống và tập luyện có rất ít hoặc không ảnh hưởng đến nồng độ Lp(a). Mức Lp(a) ở người lớn đã đạt được từ thời thơ ấu, thường là vào khoảng 5 tuổi. Các nghiên cứu chỉ ra rằng các tình trạng viêm, mang thai, suy giáp, điều trị hormone tăng trưởng và bệnh thận có thể làm tăng mức Lp(a). Mức Lp(a) có thể giảm trong các tình trạng bệnh cấp nghiêm trọng, điêu trị hormone thay thế sau mãn kinh, cường giáp, và bệnh gan. Do đó, đo lường mức Lp(a) chỉ được khuyến cáo trong các trường hợp lâm sàng ổn định. Do tính đa hình Kringle IV type-2 của gene lipoprotein(a) (LPA) mã hóa cho Apo(a), nên có sự biến đổi lớn về kích thước Lp(a) trong dân số. Kích thước Apo(a) lớn sẽ làm cho định lượng nồng độ Lp(a) thấp hơn trong huyết tương và ngược lại. Mối tương quan này đã gây khó khăn trong việc phát triển các xét nghiệm chuẩn để định lượng Lp(a). Mức Lp(a) có sự thay đổi lớn theo chủng tộc, với người có nguồn gốc Châu Phi cao hơn đáng kể so với người châu Á hoặc người da trắng. Mức Lp(a) ở người gốc Tây Ban Nha tương đương với người da trắng; và trong số những người gốc Tây Ban Nha, những người có gốc là người Mỹ sẽ thấp hơn so với những người có gốc là Tây Phi.
♦ Hướng dẫn đo lường Lipoprotein(a) trong các nghiên cứu và thực hành lâm sàng, những điểm cần lưu ý:
– Cho đến khi có các phương pháp mới không nhạy và phụ thuộc vào kích thước apo(a), các xét nghiệm đo Lp(a) trong các nghiên cứu lâm sàng và dịch tễ học cần được chọn và xác thực kỹ lưỡng để giảm thiểu tối đa tác động do đa hình kích thước của apo(a).
– Xem xét vai trò quan trọng của các chất hiệu chuẩn xét nghiệm, các phòng thí nghiệm nên yêu cầu nhà sản xuất cung cấp tài liệu về khả năng truy xuất nguồn gốc của chất hiệu chuẩn cũng như bằng chứng các lô chất hiệu chuẩn mới cung cấp kết quả nhất quán với các lô trước đó trên một bộ mẫu đại diện cho phạm vi rộng của mức Lp(a).
– Việc hiệu chuẩn các phương pháp phân tích Lp(a) theo mg/dL nên bỏ qua vì không hợp lý về mặt đo lường. Không có tham chiếu quốc tế với giá trị Lp(a) được biểu thị bằng mg/dL, do đó thiếu khả năng truy xuất nguồn gốc của các chất hiệu chuẩn đến tham chiếu chung và càng làm giảm khả năng so sánh kết quả. Các phương pháp phân tích nên được hiệu chuẩn theo nmol/L theo các hướng dẫn và khuyến cáo đã được công bố. Không nên sử dụng các hệ số chuyển đổi giữa 2 đơn vị này.
– Theo Tổ chức Y tế Thế giới (WHO)/Liên đoàn Hóa sinh Lâm sàng Quốc tế (IFCC), tham chiếu thứ cấp SRM-2B với giá trị được chỉ định là 107 nmol/L là giá trị mục tiêu cho các chất hiệu chuẩn xét nghiệm cho đến khi tham chiếu quốc tế mới được sản xuất và xác thực.
– Nếu các phương pháp nhạy với kích thước isoform được sử dụng, các mẫu có mức Lp(a) > 50 nmol/L nên được đo lại tại các phòng thí nghiệm tham khảo sử dụng các phương pháp đã được xác chuẩn. Điều này sẽ giúp giảm thiểu khả năng phân loại sai do tính không chính xác của phương pháp.
Bảng 2: Khuyến cáo chỉ định đo lường Lp(a) của các hiệp hội chuyên ngành
| AHA/ACC – 2018 | NLA – 2022 | ESC/EAS – 2019 | HEART UK – 2019 | CCS – 2021 |
| Chỉ định tương đối để đo Lp(a):
1. Tiền sử gia đình bị ASCVD sớm không thể giải thích bởi các yếu tố nguy cơ chính. 2. Tiền sử cá nhân về ASCVD không được giải thích bởi các yếu tố nguy cơ chính. Xem xét ở phụ nữ chỉ khi có tăng cholesterol máu và hiểu rằng sự cải thiện trong dự đoán nguy cơ ở phụ nữ trong một thử nghiệm lâm sàng lớn là không đáng kể. |
Đo Lp(a) là hợp lý trên các đối tượng:
1. Tiền sử gia đình trực hệ bậc 1 bị ASCVD sớm (nam <55 tuổi và nữ <65 tuổi). 2. ASCVD sớm (nam <55 tuổi và nữ <65 tuổi), đặc biệt là khi không có các yếu tố nguy cơ kinh điển. 3. Tăng cholesterol máu nặng nguyên phát (LDL-C ≥190 mg/dL) hoặc nghi ngờ FH. 4. Nguy cơ rất cao của ASCVD để xác định rõ hơn những người có khả năng hưởng lợi từ liệu pháp ức chế PCSK9.
|
Đo Lp(a) nên được xem xét ít nhất một lần trong đời ở người trưởng thành để xác định những người có mức Lp(a) di truyền rất cao >180 mg/dL (>430 nmol/L) có thể sẽ có nguy cơ ASCVD lâu dài cao tương đương với nguy cơ liên quan đến FH dị hợp tử. | Đo Lp(a) nên được thực hiện ở những người có:
1. Tiền sử cá nhân hoặc gia đình bị ASCVD sớm (<60 tuổi). 2. Thành viên gia đình trực hệ bậc 1 có mức Lp(a) >200 nmol/L. 3. FH hoặc các rối loạn lipid di truyền khác. 4. Hẹp van động mạch chủ vôi hóa. 5. Nguy cơ biến cố tim mạch 10 năm ở mức cận biên (<15%). 6. Mức Lp(a) chỉ cần đo một lần, trừ khi có nghi ngờ nguyên nhân thứ cấp, hoặc có những điều trị chuyên biệt được áp dụng để giảm mức này.
|
Nên đo Lp(a) ít nhất một lần trong đời ở mỗi người như một phần của việc sàng lọc ban đầu đối với CVD để đánh giá và phân tầng và xử lý nguy cơ.
|
| Đo Lp(a) có thể hợp lý cho các đối tượng:
1. Để cải thiện phân tầng nguy cơ trong phòng ngừa tiên phát khi quyết định sử dụng statin do không chắc chắn khi nguy cơ ASCVD 10 năm là: – Trung bình (7.5%-19.9%). – Cận biên (5%-7.4%). 2. Giảm LDL-C ít hơn mong đợi, mặc dù đã tuân trị tốt. 3. Tiền sử gia đình có mức Lp(a) cao. 4. Hẹp van động mạch chủ vôi hóa. 5. ASCVD tái phát hoặc tiến triển, mặc dù đã điều trị lipid tối ưu.
|
Xem xét ở những bệnh nhân được lựa chọn:
1. Có tiền sử gia đình mắc bệnh CVD sớm. 2. Để phân loại lại những người ở ranh giới giữa nguy cơ trung bình và cao.
|
♦ Ngưỡng nguy cơ của Lp(a): Hiện tại chưa có sự đồng thuận chung về ngưỡng nguy cơ Lp(a), các ngưỡng được đề nghị từ các hiệp hội chuyên ngành:
- ≥50 mg/dL (hoặc ≥125 nmol/L) là ngưỡng chấp nhận trong hướng dẫn của Trường môn tim mạch/Hội tim mạch Mỹ (ACC/AHA).
- ≥50 mg/dL (hoặc ≥100 nmol/L) là ngưỡng chấp nhận trong hướng dẫn của Hội Tim mạch Canada (CCS).
- <30 mg/dL (hoặc <75 nmol/L) được coi là bình thường, 30-50 mg/dL (hoặc 50-125 nmol/L) là trung gian, và >50 mg/dL (hoặc >125 nmol/L) là bất thường trong đồng thuận của Hội Xơ vữa Châu Âu (EAS).
- >50 mg/dL (hoặc >100 nmol/L) được chấp nhận là ngưỡng tăng nguy cơ trong thông cáo khoa học của Hiệp hội Lipid Quốc gia (National Lipid Association – NLA).
4. Điều trị làm giảm Lp(a)
Các thuốc hạ lipid kinh điển hiện tại chưa chứng minh giảm được mức Lp(a) hiệu quả ngoại trừ các chất ức chế proprotein convertase subtilisin/kexin 9 (PCSK9). Kết quả đầy hứa hẹn từ thử nghiệm ODYSSEY OUTCOMES cho thấy Alirocumab giảm khoảng 23% mức Lp(a) và từ thử nghiệm FOURIER cho thấy Evolocumab giảm khoảng 27%. Statins làm tăng nhẹ mức Lp(a) hoặc không thay đổi. Ezetimibe làm giảm mức Lp(a) khoảng 7.6% theo một phân tích tổng hợp, tuy nhiên, các nghiên cứu khác lại không thấy thay đổi. Các chất kết hợp axit mật và fibrates không có tương quan đáng kể với mức Lp(a); một số nghiên cứu cho thấy tăng và một số nghiên cứu khác không thấy ảnh hưởng. Niacin giảm mức Lp(a) khoảng 23%; tuy nhiên không được khuyến cáo sử dụng vì không có lợi ích trên tỷ lệ tử vong và bệnh tật ở bệnh nhân có nguy cơ CVD. Ngoài ra do có tác dụng phụ, nó cũng hạn chế sử dụng trên lâm sàng. Bempedoic acid là một loại thuốc hạ LDL-C tương đối mới dành cho bệnh nhân không dung nạp statins. Bempedoic acid dường như làm tăng nhẹ mức Lp(a) khoảng 2.4% và một số nghiên cứu cho thấy nó không có tác động đến mức Lp(a).
♦ Các liệu pháp mới: Nhiều liệu pháp mới nhắm đích trên tần suất phiên mã gene LPA sử dụng small interfering RNA (siRNA) và dịch mã gene bằng oligonucleotides antisense (ASOs) đang trong các thử nghiệm giai đoạn 2 và 3. Thử nghiệm Lp(a) HORIZON dự kiến sẽ có kết quả trong 2 năm tới. Đây là thử nghiệm kết cục tim mạch lớn đầu tiên đối với liệu pháp giảm Lp(a).
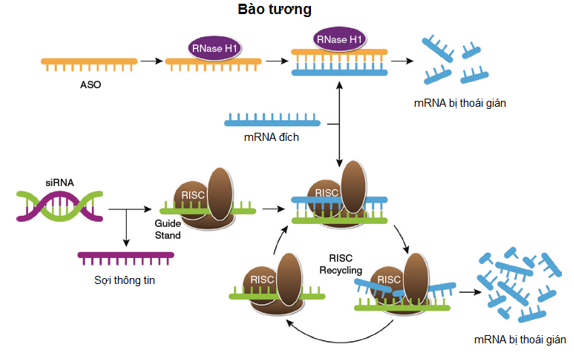
Hình 5: Cơ chế của các thuốc ASO và siRNA.
(ASO-Antisense oligonucleotide; RISC-RNA-induced silencing complex; siRNA-small interfering RNA)
Bảng 3: Các thử nghiệm pha 2 và 3 của các điều trị mới nhắm đích trên tần suất phiên mã Gene LPA (siRNA) và Dịch mã gene (ASOs)
| Tên Nghiên cứu, Giai đoạn (Điều trị) | Cơ chế Điều trị | Hình thức Điều trị | Đối tượng | Kết quả |
| OCEAN(a) DOSE, a phase 2 (olpasiran [AMG 890]) | siRNA giảm tổng hợp Lp(a) ở gan | Tiêm dưới da 10, 75, hoặc 225 mg mỗi 12 tuần, hoặc 225 mg mỗi 24 tuần | 281 người tham gia, 18-80 tuổi, Lp(a) >150 nmol/L, Có bằng chứng ASCVD | Thay đổi phần trăm mức Lp(a) sau 36 tuần, Kết quả sơ bộ: giảm từ 70.5% đến 110.5% |
| SLN360, b phase 2 (SLN360) | siRNA kép nhắm vào mRNA LPA | Tiêm dưới da 30, 100, 300, hoặc 600 mg so với giả dược | BMI 18-32 kg/m², Mức Lp(a) >125 nmol/L, Nguy cơ cao ASCVD | Thay đổi mức Lp(a) từ cơ bản |
| ORION-11, c phase 3 (inclisiran) | siRNA ức chế tổng hợp PCSK9 | Tiêm dưới da 300 mg vào ngày 1 và ngày 90, sau đó mỗi 6 tháng so với giả dược | ≥18 tuổi, LDL-C ≥70 mg/dL, Lịch sử ASCVD | Kết quả phụ đánh giá ảnh hưởng của inclisiran lên mức Lp(a), Kết quả sơ bộ: giảm 28.5% mức Lp(a) |
| Lp(a)HORIZON, d phase 3 (pelacarsen [TQJ230]) | ASO chống Apo(a) | Tiêm dưới da 80 mg hàng tháng so với giả dược | 8,323 người tham gia, 18-90 tuổi, Mức Lp(a) ≥70 mg/dL, Có CVD xác định | Thời gian xảy ra MACE trong 4 năm |
| AKCEA-APO(a)-LRx, e phase 2 (pelacarsen [ISIS 681257]) | ASO chống Apo(a) | Tiêm dưới da 20, 40, hoặc 60 mg mỗi 4 tuần; 20 mg mỗi 2 tuần; hoặc 20 mg mỗi tuần so với giả dược trong 6-12 tháng | 286 người tham gia, 18-10 tuổi, Mức Lp(a) ≥60 mg/dL, Được chẩn đoán CVD, Phải đang sử dụng liệu pháp phòng ngừa tiêu chuẩn cho các yếu tố nguy cơ CVD khác ngoài mức Lp(a) cao | Thay đổi phần trăm từ mức cơ bản Lp(a), Kết quả sơ bộ: giảm theo liều lượng từ 35-80% |
| TQJ230, f phase 3 (pelacarsen [TQJ230]) | ASO chống Apo(a) | Tiêm dưới da 80 mg hàng tháng so với giả dược | 60 người tham gia, ASCVD xác định, Đang tiến hành liệu pháp apheresis lipoprotein cho Lp(a) cô lập | Ưu thế của pelacarsen so với giả dược trong việc giảm tỷ lệ các phiên apheresis lipoprotein |
| KRAKEN, g phase 2 (LY3473329) | Tiếp cận siRNA nhắm vào Apo(a) | Liều uống hàng ngày so với giả dược | 233 người tham gia, Mức Lp(a) ≥175 nmol/L, Nguy cơ cao ASCVD | Thay đổi phần trăm từ mức cơ bản Lp(a) đến tuần 12 |
| LY3819469, h phase 2 (LY3819469) | Tiếp cận siRNA nhắm vào Apo(a) | Tiêm dưới da ở 4 liều khác nhau so với giả dược | 254 người tham gia, >40 tuổi, Mức Lp(a) ≥175 nmol/L trong sàng lọc | Thay đổi phần trăm từ mức cơ bản trong mức Lp(a) trung bình theo thời gian |
5. Các hướng dẫn hiện hành về Lp(a)
- Tuyên bố đồng thuận của Hội Xơ vữa Châu Âu (EAS) năm 2022: Đo mức Lp(a) ít nhất một lần ở người trưởng thành và thanh thiếu niên có tiền sử đột quỵ thiếu máu cục bộ hoặc tiền sử gia đình có ASCVD sớm hoặc mức Lp(a) cao mà không có các yếu tố nguy cơ nào khác.
- Hướng dẫn rối loạn lipid của Hội Tim mạch Canada (CCS) năm 2021: Đo một lần trong đời như một phần của việc sàng lọc lipid ban đầu.
- Thông cáo khoa học của Hiệp hội Lipid Quốc gia (NLA) năm 2019 về Lp(a): Đo mức Lp(a) ở các cá nhân có ASCVD sớm, mức LDL-C ≥190 mg/dL, nam giới dưới 55 tuổi, và phụ nữ dưới 65 tuổi; đáp ứng hạ LDL-C thấp hơn mong đợi, mặc dù tuân thủ tốt; ASCVD tái phát hoặc tiến triển mặc dù liệu pháp hạ lipid tối ưu; hẹp van động mạch chủ vôi hóa; và tiền sử gia đình có mức Lp(a) cao.
- Hướng dẫn về rối loạn lipid của Hội Tim Châu Âu (ESC) năm 2019: Một chỉ định tương đối cho việc đo mức Lp(a) là tiền sử gia đình có ASCVD sớm; để chỉ dẫn khuyến khích điều trị statin trong phòng ngừa tiên phát ở bệnh nhân có nguy cơ ASCVD là trung bình hoặc giáp biên.
- Hướng dẫn về cholesterol đa quốc gia năm 2018: Khuyến cáo đo mức Lp(a) ở các cá nhân có tiền sử gia đình có ASCVD sớm.
Bảng 4: Tóm tắt khuyến cáo NLA-2022 về sử dụng Lp(a) trên lâm sàng
| Phân loại | Mức Khuyến cáo | Mức bằng chứng |
| I. Đo lường lipoprotein(a) | ||
| 1. Sử dụng phương pháp miễn dịch được hiệu chuẩn theo tiêu chuẩn tham chiếu thứ cấp của WHO/IFCCLM và báo cáo dưới dạng nmol/L. | I | B-NR |
| 2. Không khuyến nghị sử dụng hệ số để chuyển đổi giá trị Lp(a) từ mg/dL sang nmol/L. | III | C-EO |
| 3. Sử dụng các giá trị đo được ≥50 mg/dL hoặc ≥100 nmol/L cho bệnh nhân người da trắng để đánh giá nguy cơ ASCVD. | IIa | B-R |
| II. Kiểm tra Lp(a) trong thực hành lâm sàng | ||
| 1. Đo lường Lp(a) để xác định nguy cơ ASCVD: | ||
| – Người có thành viên gia đình trực hệ mắc ASCVD sớm (nam <55 tuổi và nữ <65 tuổi). | IIa | C-LD |
| – Người có ASCVD lâm sàng (nam <55 tuổi và nữ <65 tuổi), đặc biệt là người có các yếu tố nguy cơ truyền thống. | IIa | B-NR |
| – Người có tăng cholesterol máu gia đình nguyên phát (LDL-C ≥190 mg/dL) hoặc nghi ngờ FH. | IIa | B-NR |
| 2.Cá nhân có nguy cơ rất cao của ASCVD để xác định liệu pháp ức chế PCSK9. | IIa | B-NR |
| 3. Nhóm nguy cơ trung bình (7.5%-19.9%) và nguy cơ cận biên (5%-7.4%) để quyết định sử dụng statin. | IIb | B-NR |
| 4.Người không giảm LDL-C như mong đợi, mặc dù đã tuân trị tốt | IIb | C-LD |
| 5.Người có hẹp van động mạch chủ vôi hóa. | IIb | C-LD |
| 6.Để xác định phương pháp điều trị lipid tối ưu. | IIb | C-LD |
| III. Điều trị | ||
| 1. Ở người lớn từ 40-75 tuổi có nguy cơ ASCVD 10 năm từ 7.5%-19.9%, việc phát hiện Lp(a) ≥50 mg/dL hoặc ≥100 nmol/L là hợp lý để sử dụng như yếu tố nâng cao nguy cơ để khởi đầu statin liều vừa phải hoặc mạnh. | IIa | B-NR |
| 2. Ở bệnh nhân có nguy cơ rất cao đang dùng statin tối ưu, với Lp(a) ≥50 mg/dL hoặc ≥100 nmol/L, hợp lý để tăng cường giảm LDL-C để đạt mục tiêu điều trị. | IIa | A |
| 3. Ở bệnh nhân nguy cơ cao đang dùng statin tối ưu, với Lp(a) ≥50 mg/dL hoặc ≥100 nmol/L, hợp lý để tăng cường giảm LDL-C để đạt mục tiêu điều trị. | IIb | B-R |
| 4. Ở bệnh nhân nguy cơ cao đang dùng statin tối ưu với LDL-C ≥70 mg/dL hoặc ≥100 nmol/L, việc thêm thuốc ức chế PCSK9 là hợp lý để đạt mục tiêu điều trị. | IIa | B-R |
| 5. Ở bệnh nhân nguy cơ rất cao đang dùng statin tối ưu và ezetimibe, với LDL-C ≥70 mg/dL hoặc ≥100 nmol/L, việc thêm thuốc ức chế PCSK9 là hợp lý để đạt mục tiêu điều trị. | IIa | B-R |
| 6. Niacin không được khuyến nghị để giảm nguy cơ ASCVD ở bệnh nhân đang dùng liệu pháp statin cường độ cao với hoặc không có ezetimibe và LDL-C điều trị <80 mg/dL. | III | B-R |
| 7. Liệu pháp thay thế hormone không được khuyến nghị ở phụ nữ mãn kinh/hậu mãn kinh để giảm nguy cơ ASCVD. | III | B-R |
– Cuối cùng theo các chuyên gia từ ACC/AHA, thực hành hiện tại chúng ta còn khá nhiều câu hỏi cần trả lời, đặt gánh nặng cho các nhà lâm sàng cần nghiên cứu thêm trong tương lai. Trong cuộc đua tìm các liệu pháp hạ mức Lp(a), liệu việc giảm mức Lp(a) có chuyển thành giảm được nguy cơ tim mạch trong các thử nghiệm đối chứng ngẫu nhiên với giả dược hay không? Cần sử dụng xét nghiệm chuẩn nào để đo mức Lp(a) trên toàn cầu? Liệu có nên có ngưỡng cho tiên lượng nguy cơ và điều trị? Các điều trị tương lai có nên nhắm đích là tất cả các cá nhân có mức Lp(a) cao bất kể chủng tộc không? Liệu nhóm người có nguy cơ tăng thêm (có thể là do những bệnh nhân viêm nhiễm kéo dài) có nên bắt đầu điều trị bất kể nguy cơ ASCVD không? Trong mối quan hệ hai chiều với CRP, liệu có vai trò của các tác nhân chống viêm trong điều trị không?
III. KẾT LUẬN
– Lipoprotein(a) là một yếu tố nguy cơ độc lập đối với bệnh tim mạch xơ vữa và hẹp van động mạch chủ do vôi hóa. Mức Lp(a) có sự khác biệt đáng kể về chủng tộc, với mức cao nhất ở những người có nguồn gốc châu Phi. Mức Lp(a) thường không thay đổi sau 5 tuổi ngoại trừ trong những đợt viêm nhiễm đáng kể, bệnh gan hoặc bệnh thận; do đó, mức Lp(a) nên được diễn giải cẩn thận trong những thời điểm này. Các hướng dẫn hiện tại ủng hộ việc đo Lp(a) một lần trong đời ở hầu hết những người có tăng nguy cơ bệnh tim mạch xơ vữa. Dữ liệu mới nổi cho thấy có mối tương quan mạnh mẽ với mức hsCRP cao (high-sensitivity C-reactive protein) trong việc dự đoán nguy cơ bệnh tim mạch xơ vữa. Các liệu pháp mới nhắm đích vào dịch mã gene lipoprotein(a) (LPA) đang được phát triển và chúng ta sẽ đón chờ những bằng chứng mới quan trọng trong tương lai.
Tài liệu tham khảo chính
- Michael b, Boffa mlk, and Santica m. marcovina. Lipoprotein(a) in Cardiovascular Risk Assessment. Clinical Lipidology: A Companion to Braunwald’s Heart Disease.
- Don P. Wilson M, Terry A. Jacobson M, Peter H. Jones M. Use of Lipoprotein(a) in clinical practice: A biomarker whose time has come. A scientific statement from the National Lipid Association. Journal of Clinical Lipidology. 2022; 16: e77–e95.
- Tsimikas S, Marcovina SM. Ancestry, lipoprotein(a), and cardiovascular risk thresholds: JACC review topic of the week. J Am Coll Cardiol 2022;80:934-46.
- Simantiris S, Antonopoulos AS, Papastamos C, et al. Lipoprotein(a) and inflammation- pathophysiological links and clinical implications for cardiovascular disease. J Clin Lipidol 2023;17:55-63.
- Fanshawe AE, Ibrahim M. The current status of lipoprotein(a) in pregnancy: a literature review. J Cardiol 2013;61:99-106.
- Kotwal A, Cortes T, Genere N, et al. Treatment of thyroid dysfunction and serum lipids: a systematic review and meta-analysis. J Clin Endocrinol Metab 2020;Dec 1:[ePub ahead of print].
- Laron Z. Increase of serum lipoprotein(a), an adverse effect of growth hormone treatment. Growth Horm IGF Res 2022;Sep 9:[ePub ahead of print].
- Kronenberg F. Causes and consequences of lipoprotein(a) abnormalities in kidney disease. Clin Exp Nephrol 2014;18:234-7.
- Dzobo KE, Kraaijenhof JM, Stroes ESG, Nurmohamed NS, Kroon J. Lipoprotein(a): an underestimated inflammatory mastermind. Atherosclerosis 2022;349:101-9.
- Jung I, Kwon H, Park SE, et al. Serum lipoprotein(a) levels and insulin resistance have opposite effects on fatty liver disease. Atherosclerosis 2020;308:1-5.
- Joshi PH, Marcovina S, Orroth K, et al. Heterogeneity of lipoprotein(a) levels among Hispanic or Latino individuals residing in the US. JAMA Cardiol 2023;8:691-6.
- Bittner VA, Szarek M, Aylward PE, et al.; ODYSSEY OUTCOMES Committees and Investigators. Effect of alirocumab on lipoprotein(a) and cardiovascular risk after acute coronary syndrome. J Am Coll Cardiol 2020;75:133-44.
- O’Donoghue ML, Fazio S, Giugliano RP, et al. Lipoprotein(a), PCSK9 inhibition, and cardiovascular risk. Circulation 2019;139:1483-92.
- Awad K, Mikhailidis DP, Katsiki N, Muntner P, Banach M; Lipid and Blood Pressure Meta-Analysis Collaboration (LBPMC) Group. Effect of ezetimibe monotherapy on plasma lipoprotein(a) concentrations in patients with primary hypercholesterolemia: a systematic review and meta-analysis of randomized controlled trials. Drugs 2018;78:453-62.
- Rubino J, MacDougall DE, Sterling LR, Kelly SE, McKenney JM, Lalwani ND. Lipid lowering with bempedoic acid added to a proprotein convertase subtilisin/kexin type 9 inhibitor therapy: a randomized, controlled trial. J Clin Lipidol 2021;15:593-601.







