TRẦN HÒA
TRƯƠNG QUANG BÌNH
Trường Đại học Y Dược Thành phố Hồ Chí Minh
Tóm tắt
Mục tiêu: Một số nghiên cứu (NC) cho thấy người mang kiểu gen giảm chức năng CYP2C19 tăng biến cố tim mạch do thiếu máu cục bộ liên quan đến sự tạo lập huyết khối sau can thiệp động mạch vành (ĐMV). Nghiên cứu nhằm xác định mối liên quan giữa kiểu gen giảm chức năng CYP2C19 allele 2 và allele 3 (CYP2C19 *2, *3) với biến cố tim mạch ở bệnh nhân (BN) được can thiệp đặt stent ĐMV tại Bệnh viện Đại học Y Dược Thành phố Hồ Chí Minh.
Đối tượng và phương pháp nghiên cứu: Nghiên cứu đoàn hệ trên 650 BN đã được can thiệp đặt stent ĐMV tại Bệnh viện Đại học Y Dược Thành phố Hồ Chí Minh. Tất cả BN được giải mã gen CYP2C19 và theo dõi tỉ lệ biến cố tim mạch chính (MACE) trong 1 năm sau can thiệp ĐMV bao gồm: tử vong do mọi nguyên nhân, nhồi máu cơ tim (NMCT) không tử vong, tái thông mạch vành đích, đột quỵ não.
Kết quả: Tỉ lệ đột biến gen giảm chức năng CYP2C19 trong nghiên cứu là 60,1% (48,3% kiểu hình chuyển hóa trung gian và 11,9% kiểu hình chuyển hoá kém). Sau 1 năm theo dõi, tỉ lệ MACE là 9,7%. Trong đó, tỉ lệ MACE ở nhóm chuyển hóa kém là 15,6%, nhóm chuyển hóa trung gian là 12,7% và nhóm chuyển hóa bình thường là 4,2%, sự khác biệt có ý nghĩa với p = 0,0002. Phân tích đa biến cho thấy kiểu hình giảm chức năng CYP2C19 allele 2 và 3 là yếu tố dự đoán độc lập MACE trong 1 năm với OR=3,435, p < 0,001.
Kết luận: BN mang kiểu gen giảm chức năng CYP2C19 sẽ làm tăng tỉ lệ biến cố tim mạch chính trong 1 năm theo dõi ở các bệnh nhân được can thiệp đặt stent ĐMV có điều trị Clopidogrel.
Từ khóa: Kiểu gen CYP2C19, chuyển hóa bình thường, chuyển hóa trung gian, chuyển hóa kém, clopidogrel, biến cố tim mạch chính, MACE.
I. ĐẶT VẤN ĐỀ
Clopidogrel (thuốc ức chế thụ thể P2Y12) kết hợp với aspirin vẫn là một trong những công thức có thể chọn lựa ở những BN sau can thiệp đặt stent ĐMV. Clopidogrel là tiền chất đòi hỏi phải được chuyển hóa tại gan thành dạng có hoạt tính nhờ hệ thống enzym cytochrome P-450, đặc biệt là CYP2C19. Vì vậy, các allele giảm chức năng của gen CYP2C19 (CYP2C19 *2, *3) làm giảm mức độ chuyển hóa của clopidogrel thành dạng có hoạt tính, từ đó giảm hiệu quả chống kết tập tiểu cầu dẫn đến gia tăng các biến cố tim mạch như huyết khối stent, nhồi máu cơ tim hay tử vong [1] . Đặc biệt, các allele mất chức năng này thường gặp ở dân số châu Á (khoảng 55 – 70%) [2] và đã có nhiều nghiên cứu trên thế giới cho thấy mối liên quan chặt chẽ đến các biến cố tim mạch nặng [3]. Xuất phát từ thực tiễn đó, chúng tôi tiến hành nghiên cứu nhằm: Xác định đặc điểm và mối liên quan của giảm chức năng CYP2C19 allele 2 và allele 3 với biến cố tim mạch ở BN được can thiệp đặt stent ĐMV tại Bệnh viện Đại học Y Dược Thành phố Hồ Chí Minh.
II. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
1. Đối tượng nghiên cứu
* Tiêu chuẩn lựa chọn: BN > 18 tuổi, đồng ý tham gia nghiên cứu, đã được can thiệp đặt stent ĐMV thành công, và không có chống chỉ định với clopidogrel và các loại kháng tiểu cầu khác.
* Tiêu chuẩn loại trừ: BN có tiền sử bị tai biến mạch máu não (xuất huyết não, nhồi máu não), đã từng can thiệp ĐMV hay mổ bắc cầu ĐMV, đang điều trị kháng đông đường uống, đang điều trị với các thuốc kháng tiểu cầu khác (prasugrel, ticagrelor), suy thận nặng (độ lọc cầu thận < 30 ml/phút), suy gan nặng (xơ gan Child B, C), phụ nữ có thai hoặc đang cho con bú.
2. Phương pháp nghiên cứu
* Thiết kế nghiên cứu: đoàn hệ, theo dõi dọc.
* Các bước nghiên cứu:
Chọn vào NC: BN bệnh ĐMV cấp hoặc mạn được can thiệp đặt stent thành công và có đang dùng Clopidogrel.
Thu thập thông tin: dịch tễ, lâm sàng, cận lâm sàng, thông tin về bệnh ĐMV và can thiệp ĐMV.
Xét nghiệm giải mã gen CYP2C19
Điều trị nội khoa theo qui định chung cho BN sau can thiệp đặt stent ĐMV.
Theo dõi biến cố tim mạch trong vòng 1 năm
MACE trong NC bao gồm: tử vong do mọi nguyên nhân, NMCT không tử vong, cần tái thông mạch vành đích, đột quỵ não.
Phân tích số liệu và cho kết quả NC
* Quy trình xét nghiệm gen CYP2C19: Kiểu gen được thực hiện tại phòng sinh hóa miễn dịch – Khoa Xét nghiệm Bệnh viện Hòa Hảo. Phương tiện xác định alen đột biến CYP2C19*2, CYP2C19*3 trên ADN người gồm: Máy LightMix® (hãng TIB MOBIOL(Đức) số phân loại 40-0304-16), thiết bị LightCycler® 1.x / 2.0 / 480. Chất chỉ thị màu: LightMix® – Color Compensation 530/640. Hãng sản xuất TIB MOLBIOL, số phân loại 40-0318-9. Đoạn dò: LightCycler® FastStart DNA Master HybProbe. Hãng sản xuất Roche Diagnostic. Bộ chuẩn bị mẫu thử: HighPure PCR Template Preparation Kit. Hãng sản xuất Roche Diagnostics. Kết quả PCR được hoàn tất trong 01 giờ. Độ nhạy: Ngưỡng phát hiện 1 ng ADN. Biên độ: 01- 100 ng ADN.
* Quy ước kiểu hình chuyển hóa CYP2C19 theo kiểu gen: Chuyển hóa bình thường: EM (Extensive Metabolizers) cá thể không mang allele đột biến, kiểu gen *1/*1; chuyển hóa trung gian: IM (Intermediate Metabolizers) cá thể chỉ mang một allele đột biến, kiểu gen *1/*2 hoặc *1/*3. Chuyển hóa kém: PM (Poor Metabolizers) cá thể mang hai allele đột biến dị hợp tử hoặc có mang một allele đột biến đồng hợp tử (*3), kiểu gen *2/*2, *2/*3, *3/*3 hoặc *3/*1.
* Quản lý và phân tích dữ liệu: Phân tích số liệu bằng phần mềm R phiên bản 3.4.4. Biến số biến cố tim mạch chính sử dụng biểu đồ Kaplan Meier. Sử dụng mô hình hồi quy logistic đơn biến và đa biến để xác định các yếu tố liên quan đến biến cố tim mạch chính và loại trừ các yếu tố gây nhiễu.
III. KẾT QUẢ NGHIÊN CỨU
1. Đặc điểm của dân số nghiên cứu
Chúng tôi đã NC trên 650 BN: nam giới chiếm 62,3%, tuổi trung bình là 65, tuổi thấp nhất là 28 và tuổi cao nhất là 92. Một số yếu tố nguy cơ tim mạch chính được trình bày trong bảng 1. Dân số gồm những BN được can thiệp ĐMV qua da có điều trị clopidogrel, 81,7% BN được chẩn đoán HCMVC.
Bảng 1. Đặc điểm các yếu tố nguy cơ tim mạch chính
| Nhóm NC (N=650) | Tỷ lệ (%) | |
| Hút thuốc lá | 236 | 36,3 |
| Tăng huyết áp | 447 | 68,8 |
| Đái tháo đường | 223 | 34,3 |
| Rối loạn chuyển hóa lipid/máu | 253 | 38,9 |
| Tiền sử gia đình mắc bệnh ĐMV | 201 | 30,9 |
2. Tần suất kiểu gen CYP2C19 allele 2 và 3 trong NC
Tần suất kiểu gen CYP2C19 allele 2 và allele 3 trong NC như sau: 39,8% có kiểu hình chuyển hóa bình thường; 60,1% có mang ít nhất một allele giảm chức năng (48,3% kiểu hình chuyển hóa trung gian và 11,9% kiểu hình chuyển hoá kém). Khảo sát liên quan giữa phân bố các kiểu hình chuyển hóa và một số đặc điểm dịch tể học, các yếu tố nguy cơ tim mạch và các đặc điểm lâm sàng, chúng tôi nhận thấy sự khác biệt không có ý nghĩa thống kê với p > 0,05 (bảng 2)
Bảng 2. Mối liên quan giữa các kiểu hình và đặc điểm lâm sàng
| Đặc điểm | Dân số chung | Phân bố kiểu hình | Giá trị p | ||
| Bình thường (n=259) | Trung gian (n=314) | Kém (n=77) | |||
| Tuổi | 65,2 ± 12,1 | 65,1 ± 12 | 65,1 ± 12 | 66,0 ± 13 | 0,688 |
| Giới tính | 405 (62,3%) | 148 (57,1%) | 207 (65,9%) | 50 (64,9%) | 0,089 |
| Hút thuốc lá | 236 (36,3%) | 84 (32,4%) | 117 (37,3%) | 35 (45,5%) | 0,100 |
| Tăng huyết áp | 447 (68,8%) | 180 (69,5%) | 212 (67,5%) | 55 (71,4%) | 0,774 |
| Đái tháo đường | 223 (34,3%) | 80 (30,9%) | 120 (38,2%) | 23 (29,9%) | 0,129 |
| Rối loạn chuyển hóa lipid/máu | 253 (38,9%) | 88 (34,0%) | 135 (43,0%) | 30 (39,0%) | 0,089 |
| Tiền sử gia đình mắc bệnh ĐMV | 201 (30,9%) | 81 (31,3%) | 92 (29,3%) | 28 (36,4%) | 0,476 |
| Lâm sàng | |||||
| Hội chứng mạch vành cấp | 531(81,7%) | 212 (81,9%) | 255 (81,2%) | 64 (83,1%) | 0,958 |
| Bệnh ĐMV mạn | 119 (18,3%) | 47 (18,1%) | 59 (18,8%) | 13 (16,9%) | |
3. Biến cố tim mạch chính
Tỷ lệ MACE trong vòng 1 năm là 9,7%. Trong đó, nhóm kiểu hình chuyển hóa kém có tỷ lệ MACE là cao nhất (15,6%). Sự khác biệt có ý nghĩa thống kê về tỉ lệ MACE của các nhóm kiểu hình được thể hiện bảng 3.
Bảng 3. Phân bố MACE theo 3 nhóm kiểu hình
| Đặc điểm | Bình thường (EM) | Trung gian (IM) | Kém (PM) | Giá trị p* |
| MACE trong 1 năm | 11 (4,2%) | 40 (12,7%) | 12 (15,6%) | 0,0002 |
*Phép kiểm chính xác Fisher
4. So sánh tỉ lệ MACE theo 3 nhóm kiểu hình (trong 1 năm theo dõi) theo biểu đồ Kaplan-Meier, nhận thấy: ở nhóm chuyển hóa kém (PM) và ở nhóm chuyển hóa trung gian (IM) cao hơn nhóm chuyển hóa bình thường (EM), sự khác biệt có ý nghĩa; trong khi đó, MACE ở nhóm chuyển hóa kém (PM) và trung gian (IM), sự khác biệt không có ý nghĩa, với p = 0,5.
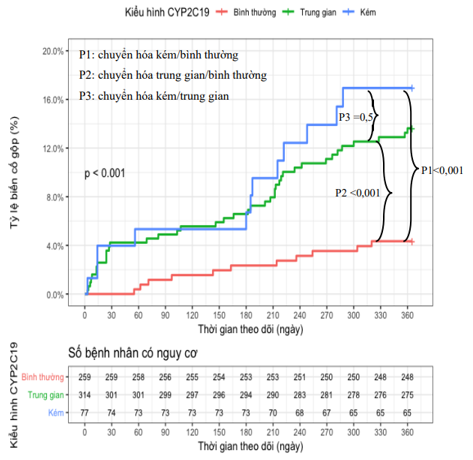
Biểu đồ 1. Biểu đồ Kaplan-Meier so sánh tỉ lệ MACE theo 3 nhóm kiểu hình
5. So sánh tỷ lệ MACE theo 2 nhóm kiểu hình:
Chúng tôi phân tích MACE so sánh nhóm mang ít nhất 1 allele giảm chức năng và nhóm bệnh nhân không mang các allele này, theo 2 nhóm:
– Nhóm 1 gồm những BN mang ít nhất 1 allele giảm chức năng (nhóm chuyển hóa trung gian và chuyển hóa kém, IM/PM).
– Nhóm 2 gồm những BN chuyển hóa bình thường (EM).
Nhận thấy: so với nhóm bệnh nhân có chuyển hóa bình thường, nhóm mang ít nhất một allele giảm chức năng có nguy cơ MACE cao hơn, sự khác biệt có ý nghĩa thống kê, thể hiện trong bảng 4.
Bảng 4. Phân bố kiểu hình theo hai nhóm (chuyển hóa trung gian và kém so với chuyển hóa bình thường)
| Biến cố tim mạch chính | IM/PM so với EM | ||
| EM (n=259) | IM/PM (n=391) | Giá trị p* | |
| MACE 1 năm | 11 (4,2%) | 52 (13,3%) | 0,0001 |
*Phép kiểm chính xác Fisher
6. So sánh tỉ lệ MACE theo 2 nhóm kiểu hình (IM/PM so với EM) trong 1 năm theo dõi theo biểu đồ Kaplan-Meier:
Nhóm BN mang ít nhất 1 allele giảm chức năng (nhóm IM/PM), tăng nguy cơ MACE so với nhóm BN không mang các gene đột biến này (nhóm EM), có ý nghĩa thống kê với p < 0,001.
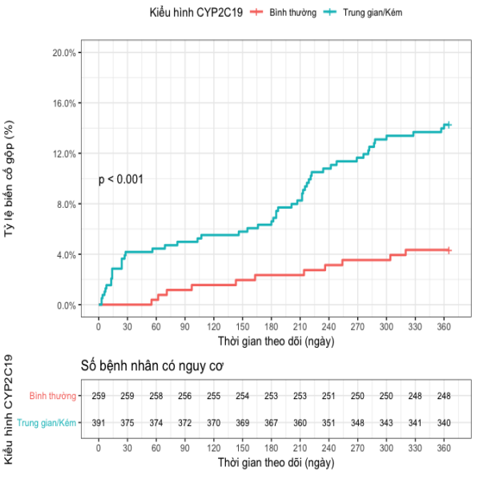
Biểu đồ 2. Biểu đồ Kaplan-Meier so sánh tỉ lệ MACE theo 2 nhóm kiểu hình
7. Các yếu tố nguy cơ độc lập của biến cố tim mạch chính:
+ Phân tích logistic đơn biến, đa biến cho thấy: Có 2 yếu tố liên quan biến cố tim mạch chính có ý nghĩa thống kê, bao gồm: Tuổi, kiểu hình chuyển hóa trung gian và kém (Bảng 5)
Bảng 5. Phân tích đơn biến và đa biến với biến cố tim mạch chính
| Yếu tố | Phân tích đơn biến | Phân tích đa biến | ||
| OR (95%CI) | Giá trị p | OR (95%CI) | Giá trị p | |
| Tuổi (năm) | 1,036 (1,013 – 1,061) | 0,003 | 1,042 (1,018 – 1,069) | < 0,001 |
| Giới tính (nam/nữ) | 1,450 (0,838 – 2,599) | 0,196 | 1,943 (0,973 – 3,929) | 0,061 |
| Hút thuốc lá | 1,262 (0,737 – 2,133) | 0,390 | 0,933 (0,488 – 1,792) | 0,833 |
| Đái tháo đường | 1,608 (0,945 – 2,716) | 0,077 | 1,546 (0,880 – 2,702) | 0,126 |
| Tăng huyết áp | 0,831 (0,485 – 1,457) | 0,507 | 0,695 (0,392 – 1,255) | 0,218 |
| Phân suất tống máu thất trái (%) | 0,981 (0,951 – 1,015) | 0,255 | 0,981 (0,949 – 1,016) | 0,278 |
| Creatinin | 3,048 (0,864 – 10,405) | 0,078 | 2,977 (0,818 – 10,579) | 0,094 |
| Hội chứng vành cấp | 0,827 (0,386 – 1,611) | 0,599 | 0,816 (0,370 – 1,642) | 0,589 |
| Kiểu hình IM/PM | 3,45 (1,83 – 7,11) | <0,001 | 3,43 (1,79 – 7,17) | <0,001 |
IV. BÀN LUẬN
1. Tỷ lệ MACE trong NC của chúng tôi là 9,7% (n = 63), trong đó các tỉ lệ này: chuyển hóa bình thường 4,2% (n =11), chuyển hóa trung gian 12,7% (n = 40), chuyển hóa kém 15,6% (n=12), sự khác biệt giữa các nhóm có ý nghĩa thống kê. BN mang ít nhất một allele giảm chức năng của clopidogrel, tăng nguy cơ MACE so với nhóm BN chuyển hóa bình thường.
Collet và cộng sự (cs) thực hiện NC tại Pháp, đánh giá ảnh hưởng kiểu hình của CYP2C19 *2 trên BN NMCT cấp, tuổi < 45, được điều trị bằng clopidogrel, và theo dõi trung bình 1 năm. Kết quả cho thấy, nhóm BN có mang allele giảm chức năng có MACE cao hơn so với những BN không mang allele này (HR = 3,69; p = 0,0005) [4]. Điều này có sự tương đồng với kết quả NC của chúng tôi. Nhóm tác giả kết luận các biến thể CYP2C19 là một yếu tố quyết định quan trọng đối với tiên lượng của BN trẻ dưới 45 tuổi được điều trị bằng clopidogrel sau NMCT cấp trong dân số Châu Âu.
Cũng trên quần thể với đa số là người da trắng, Mega và cs đã thực hiện NC gộp đánh giá nguy cơ biến cố trên những BN có mang allele giảm chuyển hóa CYP2C19. Trên cỡ mẫu 9685 BN, tác giả cho thấy MACE tăng lên có ý nghĩa thống kê ở nhóm BN có mang allele giảm chức năng clopidogrel. Cụ thể, nhóm mang 1 hoặc 2 allele giảm chức năng CYP2C19 có nguy cơ tăng MACE gấp 1,57 lần so với nhóm có chuyển hóa bình thường (HR = 1,57; 95% CI: 1,13 – 2,16 với p = 0,006). Nhóm chỉ mang 1 allele giảm chức năng có nguy cơ tăng MACE gấp 1,55 lần so với nhóm có chuyển hóa bình thường (HR = 1,55; 95% CI: 1,11 – 2,17 với p = 0,01). Nhóm mang cả 2 allele giảm chức năng CYP2C19 có nguy cơ tăng MACE gấp 1,76 lần so với nhóm có chuyển hóa bình thường (HR = 1,76; 95% CI: 1,24 – 2,5; p = 0,002) [1].
Những số liệu từ NC của Collet, Mega cho thấy, mặc dù dân số người da trắng tỉ lệ mang kiểu gene đột biến CYP2C19 *2, *3 không nhiều như trong dân số Châu Á, nhưng những người mang các kiểu gene này vẫn có nguy cơ cao xảy ra các biến cố tim mạch sau can thiệp ĐMV có sử dụng clopidogrel. Vậy tiên lượng trong dân số người Châu Á, trong đó có Việt Nam thì sự khác biệt như thế nào?.
NC của Xie Xang tại Trung Quốc trên 1068 BN cũng cho kết quả tương đồng với NC của chúng tôi. Sau 1 năm theo dõi, MACE (gồm tử vong do mọi nguyên nhân, huyết khối stent và NMCT cấp) của nhóm chuyển hóa kém (PM) và chuyển hóa trung gian (IM) cao hơn so với nhóm chuyển hóa bình thường (EM) (16% và 9,7% so với 3,5%) có ý nghĩa thống kê (p < 0,001) [5].
Tại Việt Nam, Hoàng Quốc Hòa và cs báo cáo kết quả sau 1 năm theo dõi với 26 biến cố tim mạch chính, chiếm 19%, trong đó, nhóm đột biến gene có tỷ lệ MACE cao hơn, tuy nhiên không sự khác biệt có nghĩa thống kê về tỉ lệ MACE giữa các nhóm BN có mức độ chuyển hóa khác nhau [6]. Điều này có thể do thời gian theo dõi 1 năm tương đối ngắn nên số biến cố được ghi nhận chưa nhiều.
Ziwei Xi và cs đã thực hiện NC gộp với hơn 15.000 BN từ 20 NC của các quốc gia Châu Á. Nhóm tác giả cho thấy, nhóm BN mang ít nhất một allele giảm chức năng CYP2C19 (*2 và/hoặc *3) có nguy cơ MACE tăng gấp 2 lần, có ý nghĩa (10,58% so với 6,07%, OR: 1,99, p < 0,001). Đồng thời, nhóm BN mang cả 2 allele giảm chức năng (đồng hợp tử) có nguy cơ MACE cao hơn nhóm chỉ mang một allele (dị hợp tử) [3].
Từ kết quả NC của chúng tôi , NC gộp của Ziwei Xi trên đối tượng BN Châu Á, và một số NC trong và ngoài nước, đã góp phần khẳng định nguy cơ MACE cao hơn những người mang allele giảm chức năng clopidogrel so với những BN có kiểu hình chuyển hóa bình thường.
2. Các yếu tố dự đoán biến cố tim mạch chính
Trong NC của chúng tôi, phân tích đa biến cho kết quả: tuổi và kiểu gene đột biến của CYP2C19 *2, *3 là hai yếu tố nguy cơ độc lập của MACE.
Một số NC trên thế giới đã cho kết quả tương tự với NC của chúng tôi. NC của Collet tại Pháp trên BN NMCT cấp người trẻ, sau khi phân tích hồi quy đa biến Cox, đột biến gene CYP2C19 *2 là yếu tố độc lập quan trọng duy nhất có liên quan với sự xuất hiện MACE trong quá trình theo dõi (HR: 4,04 [95% CI 1,81 – 9,02] với p = 0,0006) [4]. NC của IL-Young Oh tại Hàn Quốc, biến cố gộp tim mạch nghiêm trọng (composite hard outcome) ở nhóm mang gene đột biến CYP2C19 *2 cao hơn ở nhóm không mang gene này, có ý nghĩa (2,3% so với 0,9%, HR = 2,62 với p = 0,01) [7]. Đồng thời, trong phân tích đa biến, người có mang kiểu allele đột biến này là yếu tố dự đoán độc lập của biến cố gộp tim mạch nghiêm trọng trong 1 năm (HR = 2,53 với p = 0,01). N. Tahara thực hiện NC tại Nhật Bản cũng cho thấy, phân tích đa biến, người có kiểu hình chuyển hóa kém (PM) là yếu tố dự đoán độc lập của MACE [OR = 3,773 (1,382-10,303); p = 0,01] [8].
V. KẾT LUẬN
Ở BN được can thiệp đặt stent mạch vành thành công có dùng clopidogrel và theo dõi 1 năm, nhóm BN mang ít nhất một allele giảm chức năng CYP2C19 làm tăng nguy cơ MACE lên gấp 3,4 lần so với nhóm không đột biến gene (có chuyển hóa bình thường).
TÀI LIỆU THAM KHẢO
- Mega J. L., Simon T., et al. (2010), “Reduced-function CYP2C19 genotype and risk of adverse clinical outcomes among patients treated with clopidogrel predominantly for PCI: a meta-analysis”, Jama, 304(16), pp. 1821-30.
- Desta Z., Zhao X., et al. (2002), “Clinical significance of the cytochrome P450 2C19 genetic polymorphism”, Clin Pharmacokinet, 41(12), pp. 913-58.
- Xi Z., Fang F., et al. (2019), “CYP2C19 genotype and adverse cardiovascular outcomes after stent implantation in clopidogrel-treated Asian populations: A systematic review and meta-analysis”, Platelets, 30(2), pp. 229-240.
- Collet J. P., Hulot J. S., et al. (2009), “Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction: a cohort study”, Lancet, 373(9660), pp. 309-17.
- Xie X., Ma Y. T., et al. (2013), “CYP2C19 phenotype, stent thrombosis, myocardial infarction, and mortality in patients with coronary stent placement in a Chinese population”, PLoS One, 8(3), pp. e59344.
- Hòa Hoàng Quốc, Anh Nguyễn Đỗ (2016), “Khảo sát vai trò của CYP2C19 trên tổn thương mạch vành đích ở bệnh nhân nhồi máu cơ tim sau đặt stent có sử dụng clopidogrel”, Y Học Thành phố Hồ Chí Minh, 6(20), pp. 308-316.
- Oh I. Y., Park K. W., et al. (2012), “Association of cytochrome P450 2C19*2 polymorphism with clopidogrel response variability and cardiovascular events in Koreans treated with drug-eluting stents”, Heart, 98(2), pp. 139-44.
- Tahara N., Shinke T., et al. (2018), “Impact of Cytochrome P450 2C19 Reduced-Function Polymorphism on Lesions and Clinical Outcome in Japanese Patients After Drug-eluting Stent Implantation”, Kobe J Med Sci, 64(2), pp. E56-e63.







