Rovere G, Meduri A, Savino G, và cộng sự
Lược dịch: ThS.BS. Nguyễn Minh Kha
Giảng viên Bộ môn Nội Tổng quát, Đại học Y Dược TP Hồ Chí Minh
Lược dịch từ bài đăng trên La Radiologia Medica – tạp chí chính thức của Hội Chẩn đoán hình ảnh Y khoa và Can thiệp Ý (SIRM): Giuseppe Rovere, Agostino Meduri, Giancarlo Savino, Francesco Ciriaco Flammia, Francesca Lo Piccolo, Maria Rachele Pia Carafa, Anna Rita Larici, Luigi Natale, Biagio Merlino, Riccardo Marano. Practical instructions for using drugs in CT and MR cardiac imaging. La radiologia medica (2021)126:356–364. doi: 10.1007/s11547-020-01261-4
Tóm tắt
Trong bối cảnh chụp cắt lớp vi tính động mạch vành (CTCA) và chụp cộng hưởng từ tim (CMR) ngày càng được ứng dụng rộng rãi, bài tổng quan này cung cấp hướng dẫn thực hành súc tích về các thuốc hỗ trợ thường dùng—nitrate, chẹn beta, ivabradine, adenosine, dobutamine, atropine, dipyridamole, regadenoson—nhằm tối ưu chất lượng hình ảnh và bảo đảm an toàn. Nội dung bao quát chỉ định, chống chỉ định, liều dùng, dược động–tương tác, tác dụng phụ và yêu cầu theo dõi/thiết bị, giúp bác sĩ chẩn đoán hình ảnh lựa chọn và sử dụng thuốc một cách chuẩn hoá, hiệu quả và an toàn.
Giới thiệu
Trong hai thập kỷ qua, nhu cầu CTCA/CMR tăng mạnh nhờ tiến bộ công nghệ và ca bệnh ngày càng phức tạp. Để tối ưu chất lượng ảnh, bác sĩ chẩn đoán hình ảnh cần thành thạo dùng thuốc hỗ trợ. Bài tổng quan này cung cấp hướng dẫn thực hành về các thuốc thường dùng – chỉ định/chống chỉ định, liều, chuyển hóa/tương tác, tác dụng phụ – kèm khuyến cáo theo dõi trong–sau dùng; nhìn chung các thuốc an toàn khi triển khai tại cơ sở có nhân lực và phương tiện hồi sức đầy đủ.
THUỐC TRONG CTCA
CTCA có giá trị tiên đoán âm cao đối với bệnh động mạch vành [1–5] và được ESC 2024 khuyến cáo chỉ định mức I cho đau thắt ngực ổn định/hội chứng vành mạn, với nhóm nguy cơ thấp – trung bình [6]. Chất lượng ảnh và liều bức xạ phụ thuộc chặt vào khâu chuẩn bị bệnh nhân và chế độ chụp. Để tối ưu hoá quan sát động mạch vành, khuyến cáo nitrat đường uống giúp giãn mạch nhanh mà ít ảnh hưởng huyết động; chẹn beta và nitrat vẫn hữu ích ngay cả với máy thế hệ mới. Dù có nhiều tiến bộ trong kỹ thuật chụp [7], việc quan trọng cần phải lưu ý để tối ưu hoá chất lượng hình ảnh và giảm liều bức xạ đó là kiểm soát tần số tim thấp và nhịp tim đều [8]. Việc kiểm soát tần số tim bằng thuốc chẹn beta, chẹn kênh canxi, hoặc ức chế kênh If có thể do bác sĩ chỉ định hoặc tim mạch phụ trách; bác sĩ chẩn đoán hình ảnh có thể bổ sung liều trước chụp khi cần.
Thuốc giãn mạch: nitroglycerin
Nitroglycerin thường được dùng ngay trước lúc chụp CCTA, sau khi đã gắn điện cực đo ECG để loại trừ nhịp nhanh/rối loạn nhịp chống chỉ định CTCA. Mục đích chính yếu của việc dùng nitroglycerin là để cải thiện khả năng quan sát động mạch vành thông qua cơ chế giãn mạch qua trung gian nitric oxide không phụ thuộc nội mô tạo NO [9], [10]. Trên lâm sàng, có 2 dạng chính yếu được sử dụng là xịt dưới lưỡi (natispray 0,3 mg/liều) và viên ngậm 2,5 – 5 mg (ưu tiên 5 mg); viên tan 20–30 giây, tác dụng 8–20 phút (đỉnh khoảng 6 phút; T½ khoảng 50 phút). Chống chỉ định: xem thêm Bảng 1.
Tác dụng phụ: nhẹ, thường gặp đau đầu, chóng mặt, tự giới hạn [11]. Tương tác quan trọng với các thuốc ức chế PDE-5 làm tăng nguy cơ tụt huyết áp nặng do đó cần ngưng ≥ 48 giờ trước CTCA [12–14].
Kiểm soát tần số tim: thuốc chẹn beta
Đặc tính dược lý, chỉ định, chống chỉ định và tác dụng phụ
Đặc tính dược lý
Thuốc gắn thụ thể β-adrenergic, ức chế tác dụng norepinephrine/epinephrine → giảm co bóp, giảm tần số, giảm dẫn truyền; kéo dài tâm trương và giảm dao động mạch vành trong khi chụp [15]. Nên ưu tiên sử dụng thuốc chọn lọc β1. Chẹn β2 có thể gây co mạch ngoại vi, giảm tưới máu cơ quan (kể cả thận) và giảm độ lọc cầu thận [15].
Bảng 1: Các chống chỉ định và tương tác thuốc chính khi dùng nitroglycerin, thuốc chẹn beta và ivabradine
| Nitroglycerin | Thuốc chẹn beta | Ivabradine |
| Quá mẫn
Hạ huyết áp Bệnh cơ tim phì đại có tắc nghẽn Hẹp van động mạch chủ nặng Hẹp van hai lá nặng Tăng áp phổi nguyên phát Viêm màng ngoài tim co thắt Glaucoma Dùng thuốc ức chế phosphodiesterase Uống rượu |
Hen hoặc COPD nặng
Huyết áp tâm thu < 100 mmHg Nhịp chậm (< 60 nhịp/phút) Block nhĩ thất độ II/III Hẹp van động mạch chủ nặng Suy tim sung huyết cấp U tủy thượng thận chưa điều trị Chẹn kênh canxi (verapamil và diltiazem) |
Tần số tim < 70 nhịp/phút
Suy tim Nhồi máu cơ tim cấp gần đây Đau thắt ngực không ổn định Hạ huyết áp nặng (< 90/50 mmHg) Suy gan nặng Hội chứng suy nút xoang Block xoang-nhĩ Block nhĩ thất độ III Chẹn kênh canxi (verapamil và diltiazem) |
Thận trọng
Block AV độ I, COPD nhẹ, Raynaud, phụ nữ cho con bú; phối hợp thuốc làm chậm tần số. Dù có thể làm nặng hẹp động mạch chủ, hẹp động mạch cảnh, thuyên tắc phổi, chẹn beta vẫn có thể dùng trong quy trình Triple-Rule-Out (đánh giá 3 bệnh lý BĐMV tắc nghẽn, bóc tách động mạch chủ, thuyên tắc phổi) nhưng phải cá thể hoá, nhất là bối cảnh cấp tính [17,18].
Phác đồ sử dụng
Thuốc chẹn beta đường tĩnh mạch hạ nhịp nhanh/hiệu quả hơn đường uống, nhưng đường uống được ưu tiên nhờ an toàn, dễ dùng; nên bắt đầu với thuốc đường uống 1–2 ngày trước chụp (đặc biệt ngoại trú), và bổ sung đường tĩnh mạch nếu chưa đạt mục tiêu [23].
Trong nhóm thuốc chọn lọc trên tim, metoprolol tartrate là được dùng phổ biến nhờ có cả đường uống và đường tiêm mạch với thời gian đạt đỉnh nhanh, thời gian bán hủy ngắn nhất trong các thuốc đường uống.
Đường uống (metoprolol tartrate, sinh khả dụng 40–50%)
Hai phác đồ sử dụng metoprolol tartrate đường uống là:
- Phác đồ ngoại trú cho bệnh nhân sử dụng 50–100 mg/ngày, ít nhất 1–2 ngày trước chụp và tiếp tục sáng ngày chụp (tổng khoảng 3 ngày).
- Hoặc phác đồ trực tiếp tại bệnh viện: 50 – 100 mg 1 giờ trước chụp. Ngưỡng liều cao hơn 100 mg thường cần khi tần số tim > 80 lần/phút.
Thông thường, lựa chọn thứ nhất được ưu tiên nếu bệnh nhân đã có chỉ định thuốc chẹn beta ngoại trú, lựa chọn thứ hai được cân nhắc khi bệnh nhân chưa dùng chẹn beta trước đó. Nếu chỉ dùng đường uống mà đạt tần số tim tối ưu, thường không cần theo dõi sau chụp [15].
Bảng 2. Dược động học của thuốc chẹn beta β1 để giảm tần số tim trong thời gian ngắn
| Thuốc | Tính chọn lọc | Sinh khả dụng đường uống (%F) | Khởi phát đường uống | Thời gian đạt đỉnh | Thời gian bán hủy (giờ) |
| Metoprolol | β1 | 40 | 1 giờ | 5–10 phút | 3–4 giờ |
| Atenolol | β1 | 50 | < 2 giờ | 5 phút | 6–7 giờ |
| Esmolol | β1 | – | – | Ngay lập tức | 9 phút |
Thuốc chẹn beta đường tĩnh mạch (IV) (khi cần đạt mục tiêu tần số nhanh)
Thường sử dụng metoprolol tartrate dạng tiêm tĩnh mạch giúp hạ nhịp nhanh. Tiêm tĩnh mạch chậm 2,5–5 mg ngay trên bàn chụp, theo dõi mạch, huyết áp, ECG; nếu chưa đạt, lặp lại mỗi 2–5 phút đến tổng liều ≤15 mg [21–23]. Các lựa chọn chẹn beta khác (xem Bảng 2): atenolol 5–10 mg (đỉnh ~5 phút; t½ 6–7 giờ) và esmolol 1–3 mg/kg (khởi phát tức thì; t½ ~9 phút), có thể tiêm bolus hoặc truyền do t½ ngắn. Theo dõi kiểm tra mạch, huyết áp sau tiêm và sau chụp, đặc biệt ở bệnh nhân ngoại trú cho đến khi đánh giá lâm sàng ổn định [22,23].
Xử trí tác dụng không mong muốn ban đầu
Nhịp chậm <40 l/p hoặc có triệu chứng: atropine IV 0,5–1 mg (tối đa 3 mg); cân nhắc glucagon IV 2–10 mg; trường hợp nặng có thể cần tạo nhịp tạm thời. Khuyến cáo bệnh nhân tránh lái xe ≥ 2 giờ do có thể nhìn mờ [15]. Đối với tác dụng phụ hạ huyết áp nặng có thể bolus 10–20 mL/kg dịch tinh thể; hạ huyết áp tư thế thường tự hồi phục trong ~1 giờ. Trên đối tượng có bệnh nền hô hấp, khi xảy ra co thắt phế quản cấp tính, xử trí ban đầu bao gồm hỗ trợ oxy và các thuốc dãn phế quản qua đường khí dung. Tuy nhiên, cần lưu ý phân biệt với phản ứng dị ứng thuốc cản quang iod, trong trường hợp nhẹ có thể dùng kháng histamin, các trường hợp nặng hơn cần bảo vệ đường thở và có thể dùng adrenaline theo quy trình đơn vị [24].
Quy trình thực hành trước CTCA
Tại phòng chờ theo dõi mạch và sinh hiệu. Nếu nhịp đều và thấp, tiến hành chuẩn bị CTCA. Mục tiêu tham khảo: <65–70 nhịp/phút với CT 64 lát; < 75 nhịp/phút với CT phân giải cao. Nếu nhịp nhanh/không đều (> 65–70 lần/phút cho CT 64 lát; >75 lần/phút cho CT phân giải cao): thử nhịn thở hít sâu để đánh giá biến thiên; nếu vẫn không đạt, cân nhắc thuốc chẹn beta, chẹn kênh canxi hoặc ức chế kênh If) [15]. Chỉ dùng khi đã loại trừ chống chỉ định hoặc tình huống cần theo dõi sát; cá thể hoá liều dựa vào bệnh sử và cận lâm sàng[16].
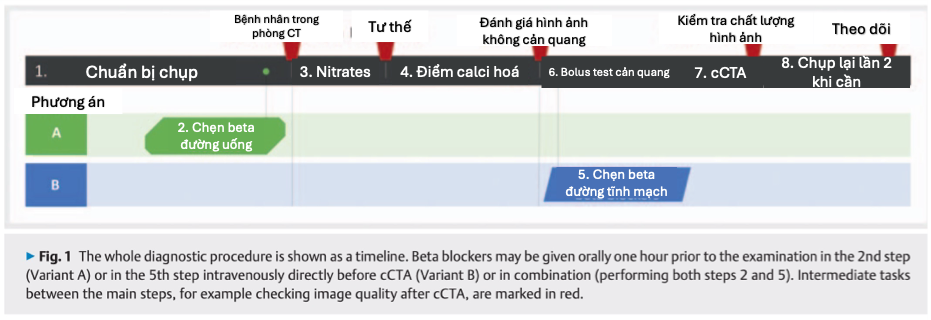
Hình 1: Quy trình chẩn đoán được trình bày theo mốc thời gian. Thuốc chẹn beta có thể dùng đường uống trước chụp (Phương án A), tiêm tĩnh mạch ngay trước chụp (Phương án B), hoặc kết hợp cả hai.
Kiểm soát tần số tim: Thuốc chẹn kênh canxi (CCB)
Đây là nhóm thuốc thuộc hàng thứ hai, sử dụng khi bệnh nhân có chống chỉ định với chẹn beta và tần số tim chưa kiểm soát được ở mức thích hợp. Nhóm được sử dụng là nhóm non-DHP, giúp ức chế dòng Ca²⁺ loại L tại cơ tim, nút xoang và nút nhĩ–thất [20,25].
Liều dùng và đường dùng của Diltiazem/Verapamil: Uống: đỉnh 0,5–1 giờ; t½ 3–4,5 giờ. IV: đỉnh ~3 phút. Hiệu quả hạ nhịp thực tế thường thấp hơn kỳ vọng [26].
Chống chỉ định: suy tim hoặc rối loạn chức năng thất trái nặng, hạ huyết áp, hội chứng suy nút xoang chưa điều trị, block AV II/III, rung/cuồng nhĩ, NMCT cấp kèm sung huyết trên X-quang. Tác dụng phụ: phù, đỏ bừng, đau đầu, táo bón (tăng ở người cao tuổi), buồn nôn, phát ban, buồn ngủ. Tương tác cần lưu ý là 2 thuốc này thường bị ảnh hưởng bởi các thuốc chuyển hoá qua CYP3A4. Lưu ý: không khuyến cáo phối hợp non-DHP với chẹn beta trong CCTA do nguy cơ giảm tần số tim, giảm co bóp tăng tác dụng không mong muốn [25,26].
Kiểm soát tần số tim: Ivabradine
Ivabradine là một thuốc đường uống dùng để kiểm soát tần số tim nếu >70 nhịp/phút ở bệnh nhân có nhịp xoang. Thuốc gắn vào các kênh ion If ở nút xoang gây chậm tần số tim. Ivabradine gây giảm tần số tim phụ thuộc liều, không ảnh hưởng đến co cơ tim hoặc kháng lực mạch máu hệ thống [27]. Có nhiều chiến lược sử dụng Ivabradine trước CCTA bằng đường uống (thời gian đạt đỉnh: 1 giờ khi nhịn ăn, 2 giờ sau khi ăn; T½: 2 giờ), ivabradine 15 mg liều duy nhất hoặc 5 mg x 2 lần/ngày trong 5 ngày [28]. Các chống chỉ định chính đối với ivabradine được tóm tắt trong Bảng 1. Ivabradine được chuyển hóa nhiều ở gan và ruột thông qua men CYP3A4 thực hiện, do đó có nhiều tương tác thuốc, phối hợp của ivabradine và chẹn kênh calci là chống chỉ định.
Các thuốc trong chụp cộng hưởng từ tim (CMR)
CMR là phương pháp không xâm lấn, không bức xạ ion hoá, đánh giá giải phẫu, chức năng, cấu trúc và thiếu máu cơ tim. CMR gắng sức và CMR tưới máu sử dụng thuốc tăng co bóp/giãn mạch nhằm mục đích phát hiện rối loạn vận động vùng hoặc khiếm khuyết tưới máu; cả hai đã được tối ưu hoá, đối chiếu với chuẩn xâm lấn/không xâm lấn và chứng minh giá trị chẩn đoán–tiên lượng [30,31]. Khi dùng thuốc cần theo dõi sinh hiệu liên tục và sẵn sàng nguồn lực hồi sức.
Adenosine
Thường được dùng làm thuốc gắng sức trong CMR và hình ảnh học hạt nhân thông qua cơ chế chủ vận purinergic không chọn lọc (A₁, A₂A, A₂B, A₃) làm giãn tiểu ĐMV qua A₂A. Nếu ĐMV bình thường adenosine gây tăng tưới máu, ngược lại vùng hẹp đáp ứng kém. Từ đó cho thấy khiếm khuyết tưới máu tương đối (bắt đầu dưới nội tâm mạc) trên chuỗi tưới máu động CMR [31–33].
Cách dùng: truyền liên tục 140 μg/kg/phút ≥3 phút trước và trong pha chụp; đường truyền riêng cho adenosine và gadolinium; theo dõi ECG/HA liên tục. T½ <10 giây → tác dụng hết nhanh sau ngừng [31,34].
Chống chỉ định và tác dụng phụ tham khảo thêm bảng 4. Tuy nhiên tác dụng phụ do Adenosin thường hết sau truyền 10 phút [31,35]. Trước chụp, bệnh nhân phải ngưng caffeine 24 giờ, theophylline 48 giờ; ngưng dipyridamole và nitrate tác dụng kéo dài >24 giờ [31–35].
Dobutamine
Làm một catecholamine tổng hợp ưu thế β₁ (kèm β₂). Liều thấp (≤10 μg/kg/phút) tăng co bóp/HR/nhu cầu O₂; liều cao (20–40 μg/kg/phút): có thể giãn mạch hệ thống nhẹ [36–39] Được dùng thay adenosine khi chống chỉ định hoặc nghi hẹp 3 nhánh; mức liều thấp đánh giá tính sống còn; liều cao gợi ý thiếu máu qua rối loạn vận động vùng [40,41].
Phác đồ bắt đầu 10 μg/kg/phút trong 3 phút, tăng 10 μg/kg/phút mỗi 3 phút tới 40 μg/kg/phút; nếu chỉ đánh giá sống còn: 10–15 μg/kg/phút. Trong trường hợp suy giảm chức năng thất trái, liều khởi đầu nên là 5 μg/kg/phút và tăng dần 5 μg/kg/phút. Khởi phát 1–2 phút; t₁/₂ <5 phút [34,15]. Mục tiêu tần số tim ≥85% tần số tim tối đa [0,85×(220–tuổi)]; có thể thêm atropine 0,3 mg, lặp tới 1,5 mg nếu chưa đạt đích [34,15].
Chống chỉ định: HA ≥220/120 mmHg, đau thắt ngực không ổn định, hẹp van ĐMC nặng (PG đỉnh >50 mmHg hoặc AVA <1 cm²), rối loạn nhịp phức tạp, bệnh cơ tim phì đại có, viêm cơ tim/nội tâm mạc/màng ngoài tim, suy tim mất bù.
Tác dụng phụ hồi hộp, đau ngực; nặng hơn có thể NMCT, VT/VF kéo dài; thường hết ~10 phút sau ngừng. Nếu tác dụng phụ kéo dài: nitroglycerin ngậm và/hoặc metoprolol IV theo quy trình [34].
Bảng 3. Chỉ định ngừng truyền dobutamine
| Tham số/Triệu chứng | Thay đổi/Khởi phát |
| Tần số tim | Đạt giá trị mục tiêu [(220-tuổi) × 0,85] |
| Huyết áp | Tăng > 240/120 mmHg
Hạ huyết áp tâm thu có triệu chứng > 40 mmHg so với ban đầu |
| ECG | ST chênh xuống > 3 mm
Rối loạn nhịp thất bất kỳ |
| Bằng chứng thiếu máu cục bộ | Bất thường vận động vùng mới |
| Triệu chứng | Đau ngực khởi phát
Phản ứng phó giao cảm nghiêm trọng Bất kỳ tác dụng phụ không thể dung nạp, bao gồm đau đầu hoặc buồn nôn |
Atropine
Atropine là thuốc kháng cholinergic được sử dụng để ức chế tác dụng của hoạt động phó giao cảm quá mức lên tim, biểu hiện qua nhịp chậm xoang và block nút nhĩ–thất. Thuốc thường được dùng trong CMR gắng sức bằng dobutamine như một thuốc bổ trợ và được tiêm tĩnh mạch chậm với liều 0,3 mg đến liều tối đa là 1,5 mg (khởi phát: ngay lập tức; T1/2: 4 giờ) cho đến khi đạt được tần số tim mục tiêu. Atropine cũng được dùng để điều trị nhịp chậm có triệu chứng ở những bệnh nhân đã dùng thuốc chẹn beta trong CTCA với liều tối đa 3 mg. Các tác dụng phụ xem thêm bảng 4.
Dipyridamole
Dipyridamole, thường phối hợp aspirin để dự phòng thứ phát sau đột quỵ, gây giãn mạch gián tiếp khi tiêm tĩnh mạch bằng cách tăng nồng độ adenosine tại chỗ (hình 2). Trong MRI gắng sức, adenosine được ưa dùng hơn do dipyridamole có nhiều tác dụng phụ hơn.
Regadenoson
Tác động qua chủ vận A₂A chọn lọc; hiệu quả tương đương adenosine, ít ảnh hưởng chronotropy/dromotropy (hình 2). Ưu điểm dùng được ở hen/COPD, ít bị ảnh hưởng bởi caffeine. Quy trình: 0,4 mg IV bolus ~10 giây; bắt đầu tiêm chất tương phản sau 1–2 phút; có thể dùng aminophylline 100 mg sau pha gắng sức để đảo ngược tác dụng [44,45]. Hiện được EMA/AIFA phê duyệt cho hình ảnh hạt nhân; CMR là ngoài chỉ định [44–48].
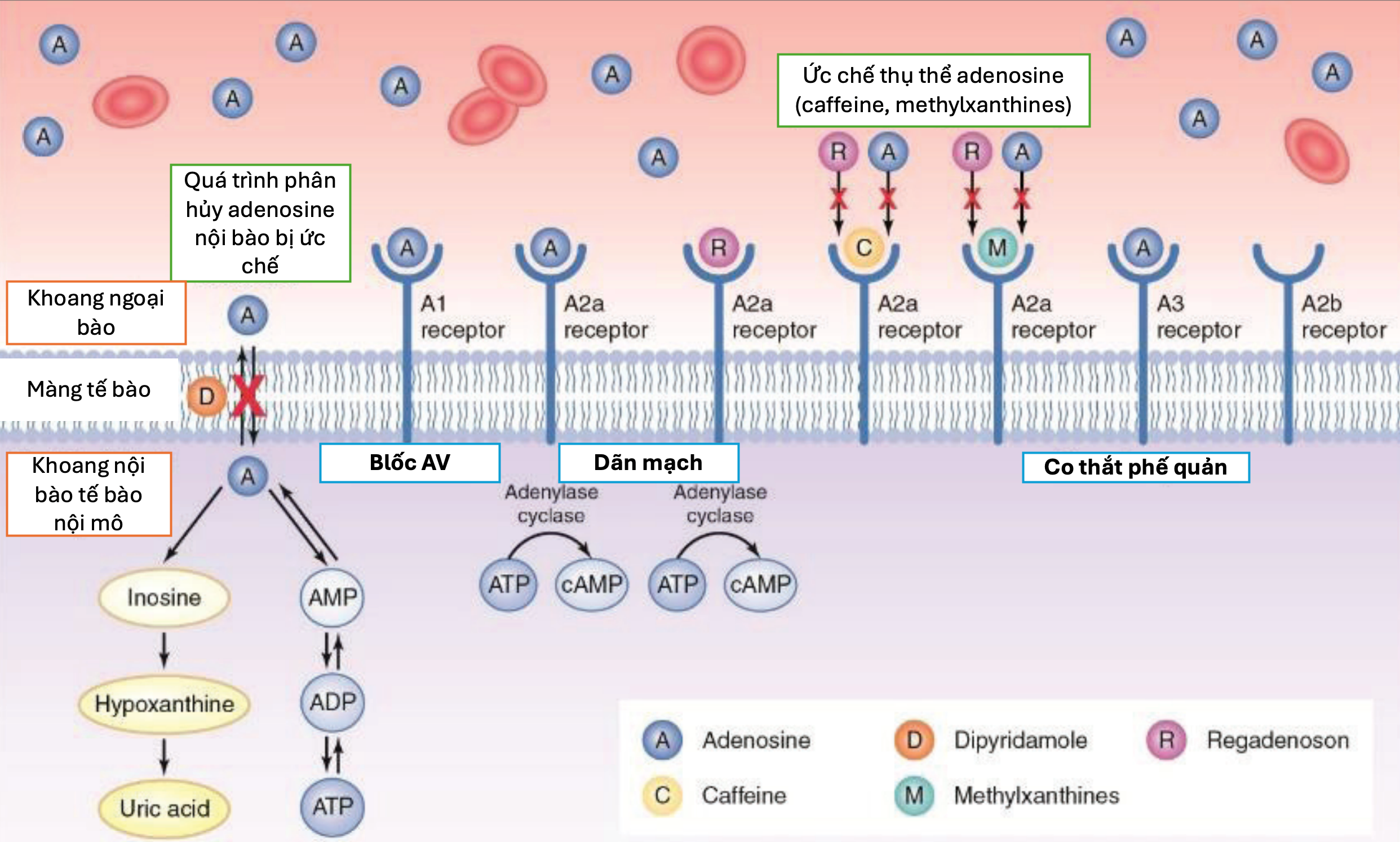
Hình 2: Cơ chế tác dụng của các thuốc giãn mạch vành
(ADP: adenosine diphosphate; AMP: adenosine monophosphate; ATP: adenosine triphosphate AV: atrioventricular – nhĩ–thất; cAMP: cyclic adenosine monophosphate)
Bảng 4. Các đặc điểm chính của các thuốc dùng trong CMR gắng sức dược lý – đã được sửa đổi từ [31]
| Tác nhân | Dobutamine | Dipyridamole | Adenosine | Regadenoson |
| Hiệu ứng | Liều thấp: inotropic Liều cao: chronotropic | Giãn mạch | Giãn mạch | Giãn mạch |
| Thụ thể | Đồng vận β1 (+++) Đồng vận α1 (+)
Đồng vận β2 (+) |
do ức chế tái hấp thu adenosine nội sinh | Đồng vận A không chọn lọc | Đồng vận chọn lọc |
| Liều truyền tĩnh mạch/
thời gian |
Từ (liều thấp) 10 µg/kg/phút (giai đoạn 3 phút) tăng 10 µg/kg/phút mỗi 3 phút đến tối đa (liều cao) 40-50 µg/kg/phút | 0,57 mg/kg trong 4 phút | 140 µg/kg/phút trong ít nhất 3 phút | 0,4mg/5ml trong 10 giây |
| T1/2 | 2 phút | 30–45 phút | <10 giây | 5,2 ± 0,2 phút |
| Tương tác thuốc | Thuốc chẹn beta | Theophylline/ caffeine |
Theophylline/caffeine | Theophylline/ caffeine |
| Chống chỉ định | Rối loạn nhịp thất kéo dài, đau thắt ngực không ổn định, nhồi máu cơ tim gần đây, tắc nghẽn đường ra thất trái đáng kể có rối loạn huyết động, bóc tách động mạch chủ, huyết áp tâm thu > 180-200 mmHg | COPD nặng, hen nặng, hạ huyết áp nghiêm trọng (huyết áp tâm thu < 90 mmHg), block nhĩ thất độ II/III, hội chứng suy nút xoang, hội chứng Wolff–Parkinson–White, đau thắt ngực không ổn định, nhồi máu cơ tim/hội chứng vành cấp gần đây | Block nhĩ thất, hội chứng suy nút xoang, hội chứng QT dài, hội chứng Wolff–Parkinson–White, đau thắt ngực không ổn định, nhồi máu cơ tim/hội chứng vành cấp gần đây |
Kết luận
Thuốc hỗ trợ có thể cần thiết để tối ưu chất lượng CT/MRI tim nhưng vẫn gây băn khoăn về an toàn và chỉ định. Bài tổng quan này tóm lược các thuốc thường dùng trong chẩn đoán hình ảnh tim không xâm lấn về cơ chế, liều, chống chỉ định, xử trí tác dụng phụ—nhằm tăng tự tin cho các bác sĩ lâm sàng tim mạch cũng như chẩn doán hình ảnh khi lựa chọn. Việc sử dụng phải tuân quy trình chuẩn của đơn vị, cá thể hoá theo nguy cơ–lợi ích, theo dõi sinh hiệu chặt chẽ và phối hợp giữa bác sĩ tim mạch và chẩn đoán hình ảnh.
Tài liệu tham khảo
- Miller JM, Rochitte CE, Dewey M et al (2008) Diagnostic per formance of coronary angiography by 64-row CT. N Engl J Med 359:2324–2336
- Budoff MJ, Dowe D, Jollis JG et al (2008) Diagnostic perfor mance of 64-multidetector row coronary computed tomographic angiography for evaluation of coronary artery stenosis in indi viduals without known coronary artery disease: results from the prospective multicenter ACC URA CY (Assessment by Coronary Computed Tomographic Angiography of Individuals Undergo ing Invasive Coronary Angiography) trial. J Am Coll Cardiol 52:1724–1732
- Meijboom WB, Meijs MF, Schuijf JD et al (2008) Diagnostic accuracy of 64-slice computed tomography coronary angiography: a prospective, multicenter, multivendor study. J Am Coll Cardiol 52:2135–2144
- Marano R, De Cobelli F, Floriani I et al (2009) Italian multicenter, prospective study to evaluate the negative predictive value of 16- and 64-slice MDCT imaging in patients scheduled for coronary angiography (NIMISCAD-Non Invasive Multicenter Italian Study for Coronary Artery Disease). Eur Radiol 19:1114–1123
- Mowatt G, Cook JA, Hillis GS et al (2008) 64-Slice computed tomography angiography in the diagnosis and assessment of coro nary artery disease: systematic review and meta-analysis. Heart 94:1386–1393
- Knuuti J, Wijns W, Saraste A et al (2020) 2019 ESC guidelines for the diagnosis and the management of chronic coronary syn dromes. Eur Heart J 41(3):407–477
- Srichai MB, Hecht EM, Kim D et al (2009) Dual-source computed tomography angiography image quality in patients with fast heart rates. J Cardiovasc Comput Tomogr 3:310–311
- Sabarudin A, Sun Z (2013) Beta-blocker administration protocol for prospectively ECG-triggered coronary CT angiography. World J Cardiol 5(12):453–458
- Ignarro LJ, Napoli C, Loscalzo J (2002) Nitric oxide donors and cardiovascular agents modulating the bioactivity of nitric oxide: an overview. Circ Res 90(1):21–28
- Takx RAP, Suchá D, Park J, Leiner T, Hoffmann U (2015) Sub lingual Nitroglycerin Administration in Coronary Computed Tomography Angiography: a systematic review. Eur Radiol 25(12):3536–3542
- Thadani U, Rodgers T (2006) Side effects of using nitrates to treat angina. Expert Opin Drug Saf 5(5):667–674
- Ahmad S (1991) Nitroglycerin and intracranial hypertension. Am Heart J 121:1850–1885
- Chun EJ, Lee W, Choi YH et al (2008) Effects of nitroglycerin on the diagnostic accuracy of electrocardiogram-gated coronary computed tomography angiography. J Comput Assist Tomogr 32(1):86–92
- Kang DK, Noh HW, Park KJ, Choi SY (2007) Assessment of the image quality and diagnostic accuracy of coronary CT angiogra phy: effect of sublingual administration of nitroglycerin. J Korean Radiol Soc 56:127–135
- McParland P, Nicol ED, Harden SP (2010) Cardiac drugs used in cross-sectional cardiac imaging: what the radiologist needs to know. Clin Radiol 65(9):677–684
- Pannu HK, Alvarez W, Fishman EK (2006) Beta-blockers for car diac CT: a primer for the radiologist. AJR Am J Roentgenol 186(6 Suppl 2):S341–S345
- Takakuwa KM, Halpern EJ, Gingold EL, Levin DC, Shofer FS (2009) Radiation dose in a “triple rule-out” coronary CT angi ography protocol of emergency department patients using 64- MDCT: the impact of ECG-based tube current modulation on age, sex, and body mass index. AJR Am J Roentgenol 192(4):866–872
- Bastarrika G, Thilo C, Headden et al (2009) Cardiac CT in the assessment of acute chest pain in the emergency department. AJR Am J Roentgenol 193(2):397–409
- Maffei E, Palumbo AA, Martini C et al (2009) “In-house” pharma cological management for computed tomography coronary angi ography: heart rate reduction, timing and safety of different drugs used during patient preparation. Eur Radiol 19(12):2931–2940
- Degertekin M, Gemici G, Kaya Z et al (2008) Safety and efficacy of patient preparation with intravenous esmolol before 64-slice computed tomography coronary angiography. Coron Artery Dis 19(1):33–36
- Shapiro MD, Pena AJ, Nichols JH et al (2008) Efficacy of prescan beta-blockade and impact of heart rate on image quality in patients undergoing coronary multidetector computed tomography angi ography. Eur J Radiol 66(1):37–41
- Roberts WT, Wright AR, Timmis JB, Timmis AD (2009) Safety and efficacy of a rate control protocol for cardiac CT. Br J Radiol 82(976):267–271
- Mahabadi AA, Achenbach S, Burgstahler et al (2010) Safety, efficacy, and indications of beta-adrenergic receptor blockade to reduce heart rate prior to coronary CT angiography. Radiology 257(3):614–623
- Singh J, Daftary A (2008) Iodinated contrast media and their adverse reactions. J Nucl Med Technol 36(2):69–74
- Elliott WJ, Ram CVS (2011) Calcium channel blockers. J Clin Hypertens Greenwich Conn 13(9):687–689
- Nicol ED, Arcuri N, Rubens MB et al (2008) Considerations when introducing a new cardiac MDCT service. Avoiding the pitfalls. Clin Radiol 63(4):355–369
- Koruth JS, Lala A, Pinney S, Reddy VY, Dukkipati SR (2017) The clinical use of Ivabradine. J Am Coll Cardiol 70(14):1777–1784
- Celik O, Atasoy MM, Ertürk M et al (1987) Single dose ivabra dine versus intravenous metoprolol for heart rate reduction before coronary computed tomography angiography (CCTA) in patients receiving long-term calcium channel-blocker therapy. Acta Radiol 55(6):676–681
- Ohana M, Sellers SL, Mooney J et al (2018) Prevalence and impact of scan-related anxiety during coronary CT angiography: a prospective cohort study of 366 patients. J Cardiovasc Comput Tomogr 12(5):364–371
- Di Cesare E, Cademartiri F, Carbone I et al (2013) Clinical indica tions for the use of cardiac MRI. By the SIRM Study Group on Cardiac Imaging. Radiol Med 118:752–798
- Marano R, Natale L, Chiribiri A et al (2015) Cardiac MR perfu sion imaging: where we are. Radiol Med 120:190–205
- Wilson RF, Wyche K, Christensen BV et al (1990) Effects of adenosine on human coronary arterial circulation. Circulation 82(5):1595–1606
- Fenster MS, Feldman MD, Camarano G et al (1997) Correlation of adenosine thallium 201 perfusion patterns with markers for inducible ischaemia. Am Heart J 133:406–412
- Kramer CM, Barkhausen J, Flamm SD et al (2013) Standardized cardiovascular magnetic resonance (CMR) protocols 2013 update. J Cardiovasc Magn Reson 15:91
- Cerqueira MD, Verani MS, Schwaiger M et al (1994) Safety profile of adenosine stress perfusion imaging: results from the Adenoscan Multicenter Trial Registry. J Am Coll Cardiol 23(2):384–389
- Kobori M, Shida K, Negishi H, Masuda Y, Hosoyamada A (1991) Evaluation of dopamine and dobutamine for use in circulatory depression associated with induced total spinal block. Masui 40(2):190–201
- Ruffolo RR Jr (1987) The pharmacology of dobutamine. Am J Med Sci 294(4):244–248
- Vallet B, Dupuis B, Chopin C (1991) Dobutamine: mechanisms of action and use in acute cardiovascular pathology. Ann Cardiol Angeiol 40(6):397–402
- Iskandrian AS, Verani MS, Heo J (1994) Pharmacologic stress testing: mechanism of action, hemodynamic responses, and results in detection of coronary artery disease. J Nucl Cardiol 1(1):94–111
- Nagel E, Lehmkuhl HB, Bocksch W et al (1999) Non invasive diagnosis of ischaemia-induced wall motion abnormalities with the use of high-dose dobutamine stress MRI: comparison with dobutamine stress echocardiography. Circulation 99(6):763–770
- Wellnhoffer E, Olariu A, Klein C et al (2004) Magnetic resonance low-dose dobutamine test is superior to scar quantification for the prediction of functional recovery. Circulation 109(18):2172–2174
- Takase B, Nagata M, Kihara T et al (2004) Whole-heart dipyrida mole stress first pass myocardial perfusion MRI for the detection of coronary artery disease. Jpn Heart J 45:475–486
- Bodi V, Sanchis J, Lopez-Lereu MP et al (2007) Prognostic value of dipyridamole stress cardiovascular magnetic resonance imaging in patients with known or suspected coronary artery disease. J Am Coll Cardiol 50(12):1174–1179
- Kazmirczak F, Nijjar PS, Zhang L et al (2019) Safety and prognos tic value of regadenoson stress cardiovascular magnetic resonance imaging in heart transplant recipients. J Cardiovasc Magn Reson 21(1):9
- Johnson SG, Peters S (2010) Advances in pharmacologic stress agents: focus on regadenoson. J Nucl Med Technol 38(3):163–171
- Leaker BR, O’Connor B, Hansel TT et al (2008) Safety of regadenoson, an adenosine A2A receptor agonist for myocardial perfusion imaging, in mild asthma and moderate asthma patients: a randomized, double-blind, placebo-controlled trial. J Nucl Car diol 15:329–336
- Thomas GS, Tammelin BR, Schiffman GL et al (2008) Safety of regadenoson, a selective adenosine A2A agonist, in patients with chronic obstructive pulmonary disease: a randomized, dou ble- blind, placebo-controlled trial (regcopd trial). J Nucl Cardiol 15:319–328
- Zhao G, Messina E, Xu X et al (2007) Caffeine attenuates the duration of coronary vasodilation and changes in hemodynam ics induced by regadenoson (CVT-3146), a novel adenosine A2A receptor agonist. J Cardiovasc Pharmacol 49:369–375







