(…)
7. Tiếp tục điều chỉnh VA và nguy cơ SCD liên quan đến các trạng thái bệnh đặc biệt
7.1. Bệnh Tim thiếu máu cục bộ
7.1.1. Ngăn ngừa SCD thứ phát ở các bệnh nhân Bệnh Tim thiếu máu cục bộ
TS PHẠM HỮU VĂN
|
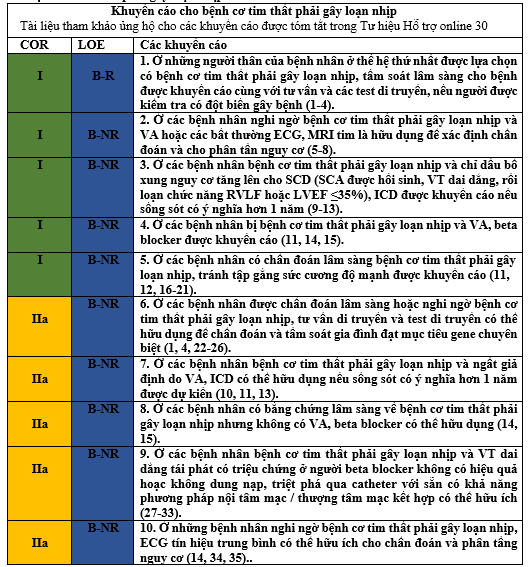
Các khuyến cáo cho ngăn ngừa SCD thứ phát ở các bệnh nhân Bệnh Tim thiếu máu cục bộ Tài liệu ủng hộ các khuyến cáo được tóm tắt trong tư liệu hỗ trợ online 17 và 18 |
||
|
COR |
LOE |
Các khuyến cáo |
|
I
|
B-R |
1. Ở những bệnh nhân bệnh tim thiếu máu cục bộ, người SCA sống sót do VT/VF hoặc trải qua VT không ổn định về huyết động (LOE: BR) (1-4) hoặc VT ổn định (LOE: BNR) (5) không phải do các nguyên nhân có thể sửa chữa được, ICD được khuyến cáo nếu khoảng thời gian sống có ý nghĩa hơn 1 năm được dự kiến. |
|
B-NR |
||
|
Báo cáo giá trị: Giá trị trung bình (LOE: B-R)
|
2. ICD đường tĩnh mạch cung cấp giá trị trung bình trong dự phóng SCD thứ phát đặc biệt khi nguy cơ các bệnh nhân tử vong do VA được xem là cao và nguy cơ tử vong không do loạn nhịp (hoặc tim hoặc không phải tim) được xem là thấp trên cơ sở gánh nặng đồng bệnh xuất của các bệnh nhân và trạng thái chức năng (6). |
|
|
I |
B-NR |
3. Ở những bệnh nhân bệnh thiếu máu cục bộ và ngất không giải thích được, người có thể tạo ra VT đơn hình dai dẳng trong nghiên cứu điện sinh lý, ICD được khuyến cáo nếu phạm vị sống còn lớn hơn 1 năm theo dự kiến (7). |
Văn bản Hỗ trợ Đặc biệt- Khuyến cáo
1. Trong thử nghiệm AVID (1), ICD cải thiện sự sống sót tổng thể so với điều trị chống loạn nhịp (chủ yếu là amiodarone) ở những bệnh nhân sống sót sau SCD hoặc VT không ổn định huyết động, với giảm nguy cơ tương đối trong 2 năm trong tử suất là 27% và giảm nguy cơ tuyệt đối là 7%. CIDS (Nghiên cứu Máy Khử rung Cấy ở Canada) (2), đã phải dừng sớm sau kết quả của AVID được đưa ra, đã cho thấy tương tự, nhưng không có ý nghĩa thống kê, lợi ích ICD hơn hẳn điều trị các thuốc chống loạn nhịp. Phân tích gộp tiếp theo sử dụng dữ liệu từ 3 RCTs cho thấy giảm đáng kể về tỷ lệ tử vong do rối loạn nhịp và tử vong do tất cả các nguyên nhân với ICD dự phòng thứ phát (3).
Trong những người sống sót do VA nguy hiểm đến tính mạng có thể do các yếu tố tạm thời hoặc có thê phục hồi, như AMI, ảnh hưởng các thuốc thúc đầy loạn nhịp, hoặc rối loạn điện giải, ICD không được cấy nếu nguyên nhân có thể sửa chữa được. Đây là quần thể bệnh nhân đòi hỏi vẫn cần được đánh giá, điều trị và theo dõi chặt chẽ, như trong AVID đăng ký, tử suất còn cao ở quần thể có thể có nguyên nhân có thể hồi phục đối với ngừng tim của họ (8). Sự gia tăng nhỏ trong troponin thể hiện sự thách thức ở các bệnh nhân lựa chọn cho ICD, khi đó thường không thể xác định đánh giá troponin do thiếu máu cục bộ do VT/VF và hồi sức hay không, trong đó trường hợp ICD nhiều khả năng được đảm bảo hoặc chỉ định cho thấy thiếu máu cục bộ gây ra rối loạn nhịp, trong đó trường hợp ngăn ngừa thiếu máu cục bộ nên được tập trung điều trị.
ICDs có thể cải thiện kết cục của bệnh nhân với VT dai dẳng trơ và bệnh tim cấu trúc (5); tuy nhiên, điều này đã không được chứng minh trong bất ký RCT. Triệt phá VT đã được sử dụng như là sự thay thế ở các bệnh nhân lựa chon có VT rất trơ và dường như giảm được tái phát, nhưng ảnh hưởng tử suất dài hạn chưa rõ; không có bằng chứng đầy đủ để khuyến cáo phương pháp tiếp cận này như là sự lựa chọn để cấy ICD (9, 10).
2. Các kết quả kinh tế của cấy ICD cho dự phòng SCD thứ phát được đánh giá trong các thử nghiệm AVID và CIDS (11, 12), cũng như trong mô hình mô phỏng (13) và một nghiên cứu quan sát của các lợi ích khác của chăm sóc y tế (14). Tất cả các nghiên cứu so sánh những người nhận ICD với những người không nhận được ICD, tất cả đều cho thấy những người nhận ICD có tuổi thọ cao hơn và chi phí chăm sóc y tế cao hơn. Tất cả các nghiên cứu đều báo cáo tỷ lệ chi phí – hiệu quả tăng lên từ 64.000 USD đến 100.000 USD/năm sống thêm do ICD (11-14), bổ sung, nằm trong khoảng giá trị trung gian do các tiêu chuẩn áp dụng trong báo cáo chi phí / giá cả ACC/AHA (15) .
3. VAs là nguyên nhân quan trọng gây ngất hoặc gần ngất ở bệnh nhân thiếu máu cục bộ, đặc biệt những người bị nhồi máu trước. Một nghiên cứu trên 70 bệnh nhân bị ngất không giải thích được thực hiện nghiên cứu điện sinh lý đã phát hiện 37 bệnh nhân; 31 với VT. Trong 3 năm theo dõi, những bệnh nhân nghiên cứu điện sinh lý dương tính có tỷ lệ SCD cao hơn và tử suất toàn bộ 3 năm (61% so với 15%) cao hơn những người có nghiên cứu điện sinh lý âm tính (7). ICD được bảo đảm cho bệnh nhân bị ngất và VT đơn hình dai dẳng được thúc đẩy thậm chí nếu họ không đáp ứng với tiêu chuẩn cho ngăn ngừa nguyên phát (Hình 4).
Hình 3. Ngăn ngừa thứ phát ở bệnh nhân Bệnh Tim thiếu máu tim cục bộ
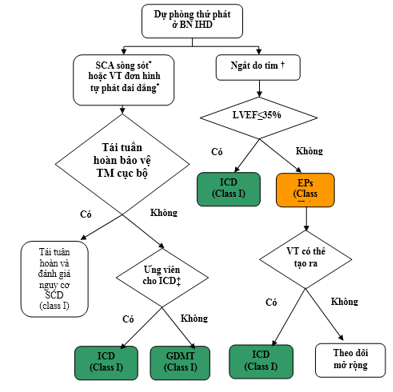
Màu tương xứng với Class khuyến cáo ở bảng 1
Xem phần 4.3.1 và 7.1.1 cho thảo luận.
*Các nguyên nhân có thể hồi phục.
†Bệnh sử phù hợp với bệnh căn loạn nhịp cho ngất.
‡ Ứng viên ICD được xác định băng tình trạng chức năng, tuổi thọ, hoặc sự ưu thích của bệnh nhân.
EP: thuộc điện sinh lý; GDMT: Điều trị và điều chỉnh theo hướng dẫn; ICD: Máy khử rung tim có thể cấy; IHD: bệnh tim thiếu máu cục bộ; LVEF: phân suất tống máu thất trái; BN: bệnh nhân; SCA: ngừng tim đột ngột; SCD: đột tử tim; và VT: nhịp nhanh thất.TM: thiếu máu
Tài liệu tham khảo
1. The AVID Investigators. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Engl J Med. 1997;337:1576-83.
2. Connolly SJ, Gent M, Roberts RS, et al. Canadian implantable defibrillator study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation. 2000;101:1297-302.
3. Connolly SJ, Hallstrom AP, Cappato R, et al. Meta-analysis of the implantable cardioverter defibrillator secondary prevention trials. AVID, CASH and CIDS studies. Antiarrhythmics vs Implantable Defibrillator study. Cardiac Arrest Study Hamburg . Canadian Implantable Defibrillator Study. Eur Heart J. 2000;21:2071-8.
4. Kuck KH, Cappato R, Siebels J, et al. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study Hamburg (CASH). Circulation. 2000;102:748-54.
5. Raitt MH, Renfroe EG, Epstein AE, et al. “Stable” ventricular tachycardia is not a benign rhythm: insights from the antiarrhythmics versus implantable defibrillators (AVID) registry. Circulation. 2001;103:244-52.
6. Owens DK, Sanders GD, Heidenreich PA, et al. Effect of risk stratification on cost-effectiveness of the implantable cardioverter defibrillator. Am Heart J. 2002;144:440-8.
7. Bass EB, Elson JJ, Fogoros RN, et al. Long-term prognosis of patients undergoing electrophysiologic studies for syncope of unknown origin. Am J Cardiol. 1988;62:1186-91.
8. Wyse DG, Friedman PL, Brodsky MA, et al. Life-threatening ventricular arrhythmias due to transient or correctable causes: high risk for death in follow-up. J Am Coll Cardiol. 2001;38:1718-24.
9. Maury P, Baratto F, Zeppenfeld K, et al. Radio-frequency ablation as primary management of well-tolerated sustained monomorphic ventricular tachycardia in patients with structural heart disease and left ventricular ejection fraction over 30%. Eur Heart J. 2014;35:1479-85.
10. Pauriah M, Cismaru G, Magnin-Poull I, et al. A stepwise approach to the management of postinfarct ventricular tachycardia using catheter ablation as the first-line treatment: a single-center experience.Circ Arrhythm Electrophysiol. 2013;6:351-6.
11. Larsen G, Hallstrom A, McAnulty J, et al. Cost-effectiveness of the implantable cardioverter-defibrillator versus antiarrhythmic drugs in survivors of serious ventricular tachyarrhythmias: results of the Antiarrhythmics Versus Implantable Defibrillators (AVID) economic analysis substudy. Circulation. 2002;105:2049-57.
12. O’Brien BJ, Connolly SJ, Goeree R, et al. Cost-effectiveness of the implantable cardioverter-defibrillator: results from the Canadian Implantable Defibrillator Study (CIDS). Circulation. 2001;103:1416-21.
13. Buxton M, Caine N, Chase D, et al. A review of the evidence on the effects and costs of implantable cardioverter defibrillator therapy in different patient groups, and modelling of cost-effectiveness and cost-utility for these groups in a UK context. Health Technol Assess. 2006;10:iii-iv, ix-xi, 1-164..
14. Weiss JP, Saynina O, McDonald KM, et al. Effectiveness and cost-effectiveness of implantable cardioverter defibrillators in the treatment of ventricular arrhythmias among medicare beneficiaries. Am J Med. 2002;112:519- 27.
15. Anderson JL, Heidenreich PA, Barnett PG, et al. ACC/AHA statement on cost/value methodology in clinical practice guidelines and performance measures: a report of the American College of Cardiology/American Heart Association Task Force on Performance Measures and Task Force on Practice Guidelines. Circulation. 2014;129:2329-45.
7.1.1.1. Co thắt Động mạch Vành
|
Các khuyến cáo cho các Bệnh nhân với co thắt Động mạnh vành Tài liệu tham khảo hỗ trợ khuyến cáo được tóm tắt trong Tài liệu Hỗ trợ online 20. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I
|
B-NR |
1. Ở các bệnh nhân VA do co thắt động mạch vành, điều trị bằng liều dung nạp tối đa các blocker kênh canxi và ngừng hút thuốc lá đã cho thấy giảm thiếu máu cục bộ và VA tài phát (1, 2). |
|
IIa |
B-NR |
2. Ở các bệnh nhân được hồi sinh từ SCA do co thắt động mạch vành ở người điều trị nội không hiệu quả hoặc không dung nạp, ICD là phù hợp nếu dự kiến phạm vi sống sót trên 1 năm. (3-6). |
|
IIb |
B-NR |
3. Ở các bệnh nhân được hồi sinh từ SCA do co thắt động mạch vành, ICD thêm vào điều trị nội có thể là phù hợp nếu dự kiến phạm vi sống sót > 1 năm (3-6). |
Các văn bản Hỗ trợ Riêng biệt – Khuyến cáo
1. Co thắt động mạch vành gây ra rối loạn vận mạch và có thể xuất hiện khi có hoặc không có bệnh tim thiếu máu cục bộ do vữa xơ động mạch. Các cơn co thắt có thể dẫn đến VA, ngất và SCD. Điều trị gồm việc loại bỏ các yếu tố nguy cơ như ngừng hút thuốc và điều trị bằng thuốc giãn mạch, bao gồm thuốc chẹn kênh canxi dihydropyridin có hoặc không có nitrat. Tóm tắt chi tiết hơn về các phương pháp điều trị co thắt động mạch vành có thể tìm thấy trong các tài liệu hướng dẫn khác (7, 8).
2. Bệnh nhân co thắt mạch vành sống sót do SCA là một quần thể có nguy cơ cao (5). VA tái phát, thậm chí đe dọa tính mạng, có thể phòng ngừa được nếu co thắt động mạch vành có thể được giải quyết có hiệu quả bằng cách thay đổi các yếu tố nguy cơ, ngừng hút thuốc, và điều trị liên tục với nitrat và thuốc chẹn kênh canxi dihydropyridine. Tuy nhiên, SCA hoặc VA có thể tái phát bất chấp điều trị nội khoa hoặc nếu tuân thủ kém. Liệu máy khử rung tim có thể mặc có thể cung cấp sự bảo vệ trong khi trị liệu nội đang được đánh giá nhưng chưa được khẳng định nhưng được quan tâm (10). ICD có thể cắt các cơn VT / VF khởi đầu bằng co thắt, có khả năng ngăn ngừa SCD.
3. Các bệnh nhân có co thắt mạch vành, sống sót do SCA là nhóm quần thể nguy cơ cao, một số ủng hộ sử dụng ICD ở những bệnh nhân đó trên cơ sở tần số các biến cố từ các nghiên cứu quan sát (5) thậm chí trước khi xác định đáp ứng của bệnh nhân đối với hoặc tuân thủ điều trị thuốc. SCA tài phát có thể xuất hiện mặc dù điều trị thuốc. Bất kể sự thay đổi yếu tố nguy cơ (như sử dụng ma túy), ngừng hút thuốc lá, và tiếp tục điều trị bằng chẹn kênh canxi dihydropyridin, có hoặc không có nitrate trong điều trị cơ bản (9).
Tài liệu tham khảo
1. Chevalier P, Dacosta A, Defaye P, et al. Arrhythmic cardiac arrest due to isolated coronary artery spasm: long-term outcome ofseven resuscitated patients. J Am Coll Cardiol. 1998;31:57-61.
2. Myerburg RJ, Kessler KM, Mallon SM, et al. Life-threatening ventricular arrhythmias in patients with silent myocardial ischemia due to coronary-artery spasm. N Engl J Med. 1992;326:1451-5.
3. Ahn JM, Lee KH, Yoo SY, et al. Prognosis of variant angina manifesting as aborted sudden cardiac death. J Am Coll Cardiol. 2016;68:137-45.
4. Matsue Y, Suzuki M, Nishizaki M, et al. Clinical implications of an implantable cardioverter-defibrillator in patients with vasospastic angina and lethal ventricular arrhythmia. J Am Coll Cardiol. 2012;60:908-13.
5. Takagi Y, Yasuda S, Tsunoda R, et al. Clinical characteristics and long-term prognosis of vasospastic angina patients who survived out-of-hospital cardiac arrest: multicenter registry study of the Japanese Coronary Spasm Association. Circ Arrhythm Electrophysiol. 2011;4:295-302.
6. Meisel SR, Mazur A, Chetboun I, et al. Usefulness of implantable cardioverter-defibrillators in refractory variant angina pectoris complicated by ventricular fibrillation in patients with angiographically normal coronary arteries. Am J Cardiol. 2002;89:1114-6.
7. JCS Joint Working Group. Guidelines for diagnosis and treatment of patients with vasospastic angina (coronary spastic angina) (JCS 2008). Circ J. 2010;74:1745-62.
8. Amsterdam EA, Wenger NK, Brindis RG, et al. 2014 AHA/ACC guideline for the management of patients with non-STelevation acute coronary syndromes: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines.Circulation. 2014;130:e344-426.
9. Morikawa Y, Mizuno Y, Yasue H. Letter by Morikawa et al regarding article, “coronary artery spasm: a 2009 update”. Circulation. 2010;121:e16. 10.Sasaki S, Tomita H, Shibutani S, et al. Usefulness of the wearable cardioverter-defibrillator in patients at high risk for sudden cardiac death. Circ J. 2014;78:2987-9.
7.1.1.2. VT/VF sau mổ bắc cầu (Post CABG VT/VF)
Tỷ lệ VT dai dẳng / VF sau khi CABG là thấp, nhưng các VA này có liên quan đến tử suất ở bệnh viện cao (1). VF xảy ra rất sớm (trong khi phẫu thuật hoặc trong vòng 24 giờ sau phẫu thuật) có thể là do ảnh hưởng tạm thời của tái tưới máu, rối loạn điện giải và kiềm toan, và sử dụng các inotrop. Bệnh nhân có VF hoặc VT đa hình trong giai đoạn hậu phẫu thường được kết hợp với thiếu máu cục bộ nhiều hơn, trong khi các bệnh nhân có VT đơn hình thường có nhồi máu cũ và sẹo cơ tim (2). VT đa hình / VF xuất hiện sau CABG đảm bảo cách tiếp cận điều trị nhằm điều trị thiếu máu cục cơ tim, gồm cả nhu cầu đánh giá khả năng ghép tự thân, cũng như xác định và điều trị các biến chứng cơ học và rối loạn điện giải cấp cũng như rối loạn thăng bằng kiềm toan. Các yếu tố nguy cơ cho xuất hiện VT đơn hình sớm sau CABG gồm MI trước đó, sẹo thất, rối loạn LV, đặt cầu nối tự thân qua mạch vành đã tắc không phải tuần hoàn bên đến vùng nhồi máu kéo dài (3). Không giống như VT đa hình và VF, VT đơn hình dai dẳng là điển hình không phải do thiếu máu cục bộ. Nhiền bệnh nhân này có VT dai dẳng có thể tạo ra trong nghiên cứu điện sinh lý. Điều chỉnh VA có triệu chứng ở giai đoạn sớm sau CABG theo khuyến cáo cho điều chỉnh VT cấp và hiện hành đã thể hiện chi tiết trong văn bản này. Ở các bệnh nhân không có VT dai dẳng hoặc VF nhưng có rối loạn LV trước khi thực hiện CABG, cấy ICD đã không cải thiện được sống sót (4). Đối với những bệnh nhân có rối loạn chức năng LV được thực hiện tái tuần hoàn, cho khả năng chức năng LV có thể được cải thiện, rất nhiều người ủng hộ việc đánh giá lại chức năng LV sau 3 tháng tái tuần hoàn trước khi quyết định cấy ICD. Đối với bệnh nhân có gánh nặng NSVT cao và LVEF giảm, nghiên cứu điện sinh lý có thể hữu ích cho việc phân tầng nguy cơ; những người có VT dai dẳng có thể tạo ra có thể có lợi ích từ ICD (6). Áo khử rung tim có thể mặc đóng một vai trò ở các bệnh nhân có nguy cơ SCD trong pha sớm sau tái tuần hoàn để cho phép thời gian phục hôi chức năng thất (7).
Tài liệu tham khảo
1. Ascione R, Reeves BC, Santo K, et al. Predictors of new malignant ventricular arrhythmias after coronary surgery: a case-control study. J Am Coll Cardiol. 2004;43:1630-8.
2. Saxon LA, Wiener I, Natterson PD, et al. Monomorphic versus polymorphic ventricular tachycardia after coronary artery bypass grafting. Am J Cardiol. 1995;75:403-5.
3. Steinberg JS, Gaur A, Sciacca R, et al. New-onset sustained ventricular tachycardia after cardiac surgery. Circulation. 1999;99:903-8.
4. Bigger JT Jr. Prophylactic use of implanted cardiac defibrillators in patients at high risk for ventricular arrhythmias after coronary-artery bypass graft surgery. Coronary Artery Bypass Graft (CABG) Patch Trial Investigators. N Engl J Med. 1997;337:1569-75.
5. Vakil K, Florea V, Koene R, et al. Effect of coronary artery bypass grafting on left ventricular ejection fraction in men eligible for implantable cardioverter-defibrillator. Am J Cardiol. 2016;117:957-60.
6. Mittal S, Lomnitz DJ, Mirchandani S, et al. Prognostic significance of nonsustained ventricular tachycardia after revascularization. J Cardiovasc Electrophysiol. 2002;13:342-6.
7. Zishiri ET, Williams S, Cronin EM, et al. Early risk of mortality after coronary artery revascularization in patients with left ventricular dysfunction and potential role of the wearable cardioverter defibrillator.Circ Arrhythm Electrophysiol. 2013;6:117-28.
7.1.2. Dự phòng SCD nguyên phát ở Các Bệnh nhân có Bệnh Tim Thiếu máu cục bộ
|
Các khuyến cáo cho dự phòng tiên phát SCD ở Các Bệnh nhân có bệnh Tim thiếu máu cục bộ Tài liệu tham khảo hỗ trợ khuyến cáo được tóm tắt trong Tài liệu Hỗ trợ online 21. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I
|
A |
1. Ở bệnh nhân có LVEF 35% hoặc thấp hơn do bệnh tim thiếu máu cục bộ ít nhất 40 ngày sau khi MI và ít nhất 90 ngày sau tái tuần hoàn, và với NYHA II hoặc III HF mặc dù đã GDMT, ICD được khuyến cáo nếu dự kiến sống sót có ý nghĩa lớn hơn 1 năm (1, 2) |
|
I |
A |
2. Ở các bệnh nhân LVEF 30% hoặc thấp hơn do bệnh tim thiếu máu cục bộ ít nhất 40 ngày sau MI và ít nhân 90 ngày sau tái tuần hoàn, và với HF NYHA class I mặc dù GDMT, ICD được khuyến cáo nếu dự kiến sống sót có ý nghĩa > 1 năm (2, 3). |
|
Báo cáo giá trị: Giá trị Cao (LOE: B-R) |
3. ICD qua đường tĩnh mạch cung cấp giá trị cao trong ngăn ngừa SCD tiên phát đặc biệt khi nguy cơ tử vong ở bệnh nhân do VA được xem là cao và nguy cơ tử vong không do loạn nhịp (hoặc do tim hoặc không do tim) được xem là thấp trên cơ sở gánh nặng đồng bệnh suất và trạng thái chức năng của bệnh nhân (4). |
|
|
I |
B-R |
4. Ở các bệnh nhân có NSVT do MI trước đó, LVEF 40% hoặc thấp hơn và VT dai dẳng hoặc VF có thể bị thúc dẩy trong nghiên cứu điện sinh lý, ICD được khuyến cáo nếu dự kiến sống sót có ý nghĩa > 1 năm (5). |
|
IIa |
B-NR |
5. Ở những bệnh nhân NYHA class IV có triệu chứng không ở bệnh viện người ứng viên cho ghép tim hoặc LVAD, ICD là phù hợp nếu dự kiến sống sót có ý nghĩa > 1 năm (6-9) |
|
III: Không lợi ích |
C-EO |
6. ICD không được chỉ định cho bệnh nhân NYHA class IV có suy tim trơ với thuốc không là ứng viên cho ghép tim, LVAD, hoặc khử rung tái đồng bộ không kèm theo cho cả hai khả năng tạo nhịp và khử rung tim. |
Văn bản Ủng hộ Riêng biệt– Khuyến cáo
1. Cơ sở lý luận để khuyến cáo ICD được cung cấp cho bệnh nhân HF NYHA II hoặc III, cộng với LVEF <35%, dựa trên cơ sở lợi ích sống sót được nhận thấy trong SCD-HeFT và MADIT-II (sử dụng điểm cắt LVEF < 35% và 30%, theo thứ tự). Lựa chọn cho cấy ICD cần mang tính cá thế. Bệnh nhân bị nhiều bệnh nặng kèm theo kết hợp với sống sót < 1 năm thường không được xem xét cho ứng viên của ICD. Khuyến cáo để chờ đợi ít nhất 40 ngày sau khi nhồi máu cơ tim trước khi cấy ghép một ICD dự phòng tiên phát được dựa trên cơ sở thực tế những bệnh nhân như vậy được loại trừ khỏi MADIT-II và SCD-HeFT cũng như 2 RCT khác cho thấy không có lợi ích sống còn nếu cấy ICD sớm trước MI cấp (10, 11).
2. Trong thử nghiệm MADIT-II (2), bệnh nhân được ngẫu nhiên với LVEF ≤ 30% và MI trước đó đối với ICD hay không, khoảng một phần ba bệnh nhân có NYHA class I có triệu chứng. Một phân tích nhóm nhỏ ủng hộ lợi ích của ICD đối với sự sống còn trong phân nhóm này (2).
3. Kết quả kinh tế của việc cấy ICD trong dự phòng SCD tiên phát được đánh giá trong 3 RCT [MADIT-I (12), MADIT-II (13) và SCD-HeFT (14)], 1 nghiên cứu quan sát (15) và 4 mô hình mô phỏng (16-19), tất cả đều có kết quả chung nhất quán. Tất cả các nghiên cứu cho thấy tỷ lệ sống sót và tuổi thọ tăng lên, và chi phí chăm sóc y tế cao hơn với ICD hơn là không có ICD. Các tỷ lệ chi phí hiệu quả gia tăng nói chung < 50.000 đô la một năm cho cuộc sống được thêm vào một ICD, cung cấp giá trị cao theo các tiêu chí được áp dụng cho hướng dẫn hiện hành (20). Giá trị được cung cấp bằng một ICD luôn cao khi tuổi thọ dự kiến sẽ tăng > 1,4 năm (18). Ngược lại, khi tỷ lệ sống sót không tăng lên do cấy ICD, như trong thử nghiệm CABG-Patch (18), ICD không cung cấp giá trị, do chi phí cao hơn không kèm theo sự gia tăng tuổi thọ.
4. MUSTT (nghiên cứu nhịp nhanh tạm thời đa trung tâm) chứng minh bệnh nhân có tiền sử MI, NSVT và LVEF giảm với VT có thể được tạo ra trong nghiên cứu điện sinh lý có tần số tử suất toàn bộ cao hơn so với các bệnh nhân tương tự không có VT dai dẳng có thể được tạo ra (21). Bệnh nhân nhận được một ICD sau khi thất bại tạo ra VT đã được ức chế bằng các thuốc chống loạn nhịp có tần số tử suất thấp hơn so với những người không nhận được ICD. Mặc dù các tiêu chuẩn đưa vào MUSTT được đòi hỏi LVEF < 40%, LVEF trung bình ở bệnh nhân tham gia là 30%, và cấy ICD không được chọn ngẫu nhiên mà được bác sĩ điều trị chọn lọc cho bệnh nhân VT khi không thể ngăn chặn bằng điều trị thuốc chống loạn nhịp. MUSTT cho phép ghi danh các bệnh nhân đã được < 40 ngày sau khi MI cấp tính hoặc tái tuần hoàn. ICD không có lợi trong 2 RCTs khác để kiểm tra hiệu quả của ICD trong giai đoạn cấp tính của MI (10, 11). Trong một nghiên cứu quan sát ở một trung tâm duy nhất, một nghiên cứu về điện sinh lý đã được thực hiện trung bình 9 ngày sau khi bị nhồi máu cấp tính ở 115 bệnh nhân với LVEF < 40% và ICDs được khuyến cáo cho những người có VT có thể tạo ra. Theo dõi trung bình 12 tháng. VT dai dẳng ở 27% bệnh nhân, và 22% trong số đó nhận được ICDs đã cắt được VT tự phát bằng ICD trong quá trình theo dõi. Không có bệnh nhân nào không có VT có thể tạo ra có VT hoặc SCD trong quá trình theo dõi (22). 5. Trong một phân tích hồi cứu đăng ký UNOS (Mạng lưới chia sẻ nội tạng: United Network for Organ Sharing) kéo dài từ năm 1999 đến năm 2014, dữ liệu trên 32.599 bệnh nhân cho thấy trong thời gian theo dõi trung bình là 154 ngày, 3.638 bệnh nhân (11%) chết trong khi danh sách chờ ghép tim (9% trong nhóm ICD so với 15% ở nhóm không thuộc nhóm ICD, p <0,0001). Sự hiện diện của một ICD khi niêm yết đã được kết hợp với việc giảm nguy cơ tương đối 13% đối trong tử suất. Trong nhóm bệnh nhân có LVAD (n = 9.478), ICD có liên quan đến giảm nguy cơ tử vong được điều chỉnh 19% (9). Trong một nghiên cứu khác 380 bệnh nhân được liệt kê để cấy ghép tim giữa năm 2005 và 2009 tại trung tâm ghép tim hạng ba số 1, 122 bệnh nhân đã nhận được ICD trước hoặc trong vòng 3 tháng sau khi được liệt kê để cấy ghép tim. Bệnh nhân không phải là ICD có nhiều khả năng chết trong danh sách cấy ghép. Trong một mô hình đa biến, ICD không liên quan đến sự sống sót được cải thiện; tuy nhiên, phân tích đó bị giới hạn bởi quy mô mẫu nhỏ (8). Một nghiên cứu nhỏ (n = 79) được tiến hành tại 1 viện nghiên cứu cho thấy ICDs làm giảm nguy cơ SCD ở bệnh nhân LVEF 30% đang chờ ghép tim; tuy nhiên, nghiên cứu này đã hạn chế do số lượng nhỏ bệnh nhân (6). Trong một nghiên cứu hồi cứu đa trung tâm 1.089 bệnh nhân được liệt kê để cấy ghép tim, 550 bệnh nhân (51%) có ICD. Trong 216 bệnh nhân, ICD cho ngăn ngừa SCD tiên phát, và ở 334 bệnh nhân, ICD đã được dự phòng thứ phát. 539 bệnh nhân còn lại không nhận được ICD. Trong khoảng thời gian trung bình trong danh sách chờ đợi 8 tháng, ICD có liên quan đến việc giảm tỷ lệ tử vong do mọi nguyên nhân ở nhóm nghiên cứu sơ cứu và thứ phát (ước tính 1 năm: 88 ± 3% đối lại 77 ± 3% đối lại 67 ± 3 %; p = 0.0001). Mối quan hệ này giữa ICD và sự sống còn được cải thiện vẫn tồn tại thậm chí sau khi điều chỉnh các yếu tố gây nhiễu tiềm ẩn (7). 6. Không có đầy đủ dữ liệu từ RCTs về giá trị của ICD ở bệnh nhân HF NYHA class IV. Các bệnh nhân HF NYHA class IV đã được bao gồm trong nghiên cứu COMPANION (So sánh các điều trị nội, tạo nhịp, và khử rung tim trong suy tim: Comparison of Medical Therapy, Pacing, and Defibrillation in Heart Failure), cho thấy trạng thái chức năng tất cả được cải thiện và sống sót với khử rung tái đồng bộ (CRT-D) (23). Trừ phi một bệnh nhân như vậy là ứng cử viên cho CRT hoặc các điều trị suy tim tăng cường như nghép tim hoặc LVAD (dụng cụ hỗ trợ thất trái), ICD không được dự kiến kéo dài sự sống còn (23).
Hình 4. Ngăn ngừa SCD tiên phát ở các bệnh nhân có bệnh tim thiếu máu cục bộ
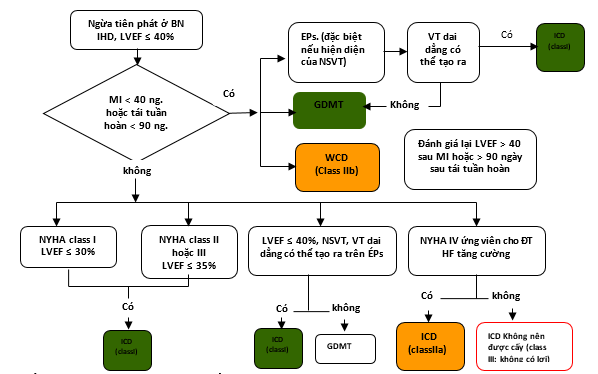
Màu sắc tương ứng với Class khuyến cáo ở bảng 1.
Xem phần 7.1.2 cho thảo luận.
* Kịch bản tồn tại đối với việc đặt ICD sớm trong các tình huống được lựa chọn chẳng hạn như các bệnh nhân có chỉ định tạo nhịp hoặc ngất
† Điều trị HF tăng cường gồm CRT, ghép tim, và LVAD. được cho do VT. Đây là những chi tiết khác trong một tuyên bố đồng thuận của chuyên gia HRS / ACC / AHA (24).
CRT: điều trị tái đồng bộ tim, EP: thuộc điện sinh lý;; GDMT: điều trị và quản lý theo hướng dẫn ( guideline-directed management and therapy); HF: suy tim; ICD: khử rung tim; IHD: bệnh tim thiếu máu cục bộ; LVEF: phân suất tống máu; MI: nhồi máu cơ tim; NSVT: nhịp nhanh thất tạm thời; NYHA: Hội Tim New York; pts: bệnh nhân; SCD: đột tử tim; VT: nhanh thất; WCD; áo khử rung có thể mặc.
Tài liệu tham khảo
1. Bardy GH, Lee KL, Mark DB, et al. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med. 2005;352:225-37.
2. Moss AJ, Zareba W, Hall WJ, et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med. 2002;346:877-83.
3. Moss AJ, Hall WJ, Cannom DS, et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med. 1996;335:1933-40.
4. Owens DK, Sanders GD, Heidenreich PA, et al. Effect of risk stratification on cost-effectiveness of the implantable cardioverter defibrillator. Am Heart J. 2002;144:440-8.
5. Buxton AE, Lee KL, Fisher JD, et al. A randomized study of the prevention of sudden death in patients with coronary artery disease. Multicenter Unsustained Tachycardia Trial Investigators. N Engl J Med. 1999;341:1882-90.
6. Cantero-Pérez EM, Sobrino-Márquez JM, Grande-Trillo A, et al. Implantable cardioverter defibrillator for primary prevention in patients with severe ventricular dysfunction awaiting heart transplantation. Transplant Proc. 2013;45:3659-61.
7. Frohlich GM, Holzmeister J, Hubler M, et al. Prophylactic implantable cardioverter defibrillator treatment in patients with end-stage heart failure awaiting heart transplantation. Heart. 2013;99:1158-65.
8. Gandjbakhch E, Rovani M, Varnous S, et al. Implantable cardioverter-defibrillators in end-stage heart failure patients listed for heart transplantation: results from a large retrospective registry. Arch Cardiovasc Dis. 2016;109:476-85.
9. Vakil K, Duval S, Cogswell R, et al. Impact of implantable cardioverter-defibrillators on waitlist mortality among patients awaiting heart transplantation: an UNOS/OPTN analysis. JACC Clin Electrophysiol. 2017;3:33-40.
10. Hohnloser SH, Kuck KH, Dorian P, et al. Prophylactic use of an implantable cardioverter-defibrillator after acute myocardial infarction. N Engl J Med. 2004;351:2481-8.
11. Steinbeck G, Andresen D, Seidl K, et al. Defibrillator implantation early after myocardial infarction. N Engl J Med. 2009;361:1427-36.
12. Mushlin AI, Hall WJ, Zwanziger J, et al. The cost-effectiveness of automatic implantable cardiac defibrillators: results from MADIT. Multicenter Automatic Defibrillator Implantation Trial. Circulation. 1998;97:2129-35.
13. Zwanziger J, Hall WJ, Dick AW, et al. The cost effectiveness of implantable cardioverter-defibrillators: results from the Multicenter Automatic Defibrillator Implantation Trial (MADIT)-II. J Am Coll Cardiol. 2006;47:2310-8.
14. Mark DB, Nelson CL, Anstrom KJ, et al. Cost-effectiveness of defibrillator therapy or amiodarone in chronic stable heart failure: results from the Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT). Circulation. 2006;114:135- 42.
15. Al-Khatib SM, Anstrom KJ, Eisenstein EL, et al. Clinical and economic implications of the Multicenter Automatic Defibrillator Implantation Trial-II. Ann Intern Med. 2005;142:593-600.
16. Buxton AE, Calkins H, Callans DJ, et al. ACC/AHA/HRS 2006 key data elements and definitions for electrophysiological studies and procedures: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Data Standards. Circulation. 2006;114:2534-70.
17. Cowie MR, Marshall D, Drummond M, et al. Lifetime cost-effectiveness of prophylactic implantation of a cardioverter defibrillator in patients with reduced left ventricular systolic function: results of Markov modelling in a European population. Europace. 2009;11:716-26. 18. Sanders GD, Hlatky MA, Owens DK. Cost-effectiveness of implantable cardioverter-defibrillators. N Engl J Med. 2005;353:1471-80.
19. Smith T, Jordaens L, Theuns DA, et al. The cost-effectiveness of primary prophylactic implantable defibrillator therapy in patients with ischaemic or non-ischaemic heart disease: a European analysis. Eur Heart J. 2013;34:211-9.
20. Anderson JL, Heidenreich PA, Barnett PG, et al. ACC/AHA statement on cost/value methodology in clinical practice guidelines and performance measures: a report of the American College of Cardiology/American Heart Association Task Force on Performance Measures and Task Force on Practice Guidelines.Circulation. 2014;129:2329-45.
21. Buxton AE, Lee KL, DiCarlo L, et al. Electrophysiologic testing to identify patients with coronary artery disease who are at risk for sudden death. Multicenter Unsustained Tachycardia Trial Investigators. N Engl J Med. 2000;342:1937-45.
22. Zaman S, Sivagangabalan G, Narayan A, et al. Outcomes of early risk stratification and targeted implantable cardioverter-defibrillator implantation after ST-elevation myocardial infarction treated with primary percutaneous coronary intervention. Circulation. 2009;120:194-200.
23. Bristow MR, Saxon LA, Boehmer J, et al. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med. 2004;350:2140-50.
24. Kusumoto FM, Calkins H, Boehmer J, et al. HRS/ACC/AHA expert consensus statement on the use of implantable cardioverter-defibrillator therapy in patients who are not included or not well represented in clinical trials. Circulation. 2014;130:94-125.
7.1.3. Điều trị và ngăn chặn VA tái phát ở các bệnh nhân có bệnh tim thiếu máu cực bộ

Văn bản Hỗ trợ riêng biệt – Khuyến cáo
1. Các thuốc chống loạn nhịp thông thường nhất được sử dụng để ức chế VA gồm amiodarone và sotalol, trong khi mexiletin, quinidine và ranolaazine đôi khi được sử dụng (17, 18). Amiodaron dường như có hiệu quả hơn sotalol và có tần số thúc đẩy rối loạn nhịp thất thấp, nhưng có nguy cơ tác dụng phụ liên quan đến thuốc tăng lên dẫn đến ngừng thuốc ở nhiều bệnh nhân trong phạm vi 18 đến 24 tháng kể từ khi bắt đầu điều trị (1,19). Dữ liệu hỗ trợ hiệu quả của sotalol đối với việc ức chế VA là mâu thuẫn, nhưng với tác động bất lợi hơn amiodarone, nó có thể là thuốc chống loạn nhịp đầu tiên tốt hơn ở bệnh nhân thích hợp (1-3). Tuy nhiên, sotalol thường tránh ở những bệnh nhân giảm LVEF nặng < 20% do ảnh hưởng inotropic âm tính của thuốc và nguy cơ torsades de pointes. Trong nghiên cứu điều trị giả dược mù đôi với 674 bệnh nhân HF và > 10 PVCs / h và LVEF 40% được phân ngẫu nhiên dùng amiodarone (336 bệnh nhân) hoặc giả dược (338 bệnh nhân), không có sự khác biệt đáng kể về tỷ lệ tử vong hay SCD giữa hai nhóm. Có xu hướng giảm tỷ lệ tử vong chung ở những bệnh nhân bệnh tim không do thiếu máu (NICM) những bệnh nhân đã nhận được amiodarone (p = 0.07) (20).
2. Bệnh nhân có MI trước có thể xuất hiện với VT đơn hình dai dẳng hoặc các đợt VF tái phát được khởi đầu bằng các PVC phát sinh từ Purkinje Fibers ở vùng quanh nhồi máu. Các cơn bão VA được kết hợp với tử suất tăng lên (12). Nền loạn nhịp thường ở dưới nội tâm mạc. VANISH ngẫu nhiên (Ventricular Tachycardia Ablation versus Escalated Antiarrhythmic Drug Therapy in Ischemic Heart Disease) (4) được so sánh với điều trị chống loạn nhịp theo bậc thang đối lại với triệt phá qua catheter cho các bệnh nhân có MI trước đó và VT đơn hình dai dẳng tái phát mặc dù có thuốc chống loạn nhịp. Kết quả trước tiên, kết hợp tử vong, bão VT, hoặc các sốc ICD xuất hiện ở 59,1% ở nhóm triệt phát và 68,5% ở nhóm điều trị theo bậc thang. Không có sự khác biệt về tử suất giữa các nhóm. Các sốc ICD tái phát và bão VT và biến cố liên quan đến điều trị là thấp hơn ở nhóm triệt phá. Trong phân tích phân nhóm, các bệnh nhân có VT có điều trị amiodarone có kết cục tốt hơn với triệt phá so sánh với amiodarone hoặc thêm mexiletine vào amiodarone. Đối với các bệnh nhân dùng thuốc ngoài amiodarone, triệt phá qua catheter không làm giảm nguy cơ sốc ICD hoặc bão VT so với chuyển sang amiodarone. Mặc dù VT tái phát sau triệt phá qua catheter được kết hợp với tử suất tăng lên (9), liệu tử suất có được giảm xuống bằng triệt phá qua catheter đã không được tính toán. Các biến chứng của thủ thuật xẩy ra ở khoảng 6% bệnh nhân, hầu hết có liên quan đến việc tiếp cận mạch máu, nhưng có thể xảy ra đột quỵ, tràn dịch màng ngoài tim gây ép tim, cũng như block nhĩ thất có thể xuất hiện. Tử suất do thủ thuật <1% ở các trung tâm có kinh nghiệm (4, 9).
VT đơn hình dai dẳng thường xuất hiện khi các cơn riêng lẻ không thường xuyên ở những bệnh nhân có MI từ trước. Một số nghiên cứu không ngẫu nhiên đã cho thấy việc triệt phá qua catheter làm giảm VT tái phát hoặc sốc ICD (5, 7, 8). Một phân tích gộp 5 nghiên cứu triệt phá VT (5) được báo cáo VT tái phát ở 35% bệnh nhân sau triệt phá qua catheter so với 55% ở thuốc chống loạn nhịp. Trong một nghiên cứu đa trung tâm về triệt phá qua catheter (7) cho các bệnh nhân có > 3 cơn VT dai dẳng trong 6 tháng trước, 53% không bị VT tái phát sau 6 tháng theo dõi; số lượng VT trung bình đã giảm từ 11,5 đến 0. Mức độ ưu việt của triệt phá đã vượt qua điều trị thuốc bậc thang được thấy trong tiêu chí phối hợp của tử vong, bão VT, hoặc sốc ICD bằng nghiên cứu VANISH (4).
3. Bệnh nhân có MI trước phát triển VT đơn hình dai dẳng thường có các cơn tái phát. Nghiên cứu VTACH (Ventricular Tachycardia Ablation in Addition to Implantable Defibrillators in Coronary Heart Disease) (11) các bệnh nhân được ngẫu nhiên trải qua cấy ICD cho VT đơn hình dai dẳng, không có điều trị VT đơn hình dai dẳng ổn định, đã thất bại điều trị bằng các thuốc chống loạn nhịp, để triệt phá qua catheter đối lại với cấy ICD đơn thuần. Sau 2 năm, bất kỳ VT nào đã tái phát ở 53% nhóm triệt phá và 71% nhóm đối chứng. Triệt phá đã làm kéo dài thời gian đến VT tái phát từ trung bình 5,9 tháng đến 18,6 tháng (11). Một số nghiên cứu không ngẫu nhiên cho thấy triệt phá qua catheter làm giảm nguy cơ tái phát VT hoặc sốc ICD ở các bệnh nhân có VT dai dẳng liên quan đến MI trước đo (5, 7, 8). Trong một nghiên cứu đa trung tâm về triệt phá qua catheter (7) cho các bệnh nhân với > 3 VT dai dẳng trong 6 tháng trước, 53% không bị VT tái phát sau 6 tháng theo dõi; số trung bình VT đã giảm từ 11,5 đến 0. Một phân tích gộp 5 nghiên cứu triệt phá VT (5) cho thấy VT tái phát ở 35% bệnh nhân sau triệt phá qua catheter so với 55% điều trị bằng thuốc chống loạn nhịp. Một nghiên cứu 63 bệnh nhân khác có VT tái phát sau MI đã chứng minh thành công cấp thời với triệt phá qua catheter ở 83% VT có thể lập bản đồ và 40% VT không thể lập bản đồ (8). Tính ưu việt của triệt phá hơn hẳn điều trị thuốc theo bậc thang cho các bệnh nhân có VT tái phát mặc dù các thuốc chống loạn nhịp đã được chỉ ra từ nghiên cứu VANISH (4). Xem Phần 5.6.
4. CAST (21) đã chứng minh tần số tử suất cao hơn hoặc ngừng tim không tử vong ở các bệnh nhân sau MI được điều trị bằng encainide hoặc flecainide khi sử dụng để ức chế PVC và NSVT (13). Propafenone có liên quan đến tử suất gia tăng ở những người sống sót do SCA so với các thuốc chẹn beta, amiodarone, và ICD (22).
5. Cấy ICD trước khi đạt được ức chế VA thường xuyên hoặc liên hồi đưa bệnh nhân với nguy cơ cao của sốc lắp đi lặp lại, có thể gây bất lợi về tâm lý và kết hợp với tử suất tăng lên (23, 24).
6. VT đơn hình dai dẳng trong trạng thái MI trước đó là điển hình do vào lại liên quan đến sẹo và không phải do thiếu máu cục bộ cấp. Mặc dù nó có thể phù hợp với khuyến cáo tái tuần hoàn khi chỉ định khác cho tái tuần hoàn, tái tuần hoàn đơn thuần không làm giảm tái phát VT đơn hình cũng như điều trị chuyên biệt như thuốc chống loạn nhịp hoặc triệt phá có thể cần thiết để ngăn chặn tái phát (16). Ngược lại, tái tuần hoàn có thể có lợi ích ở các bệnh nhân có bệnh tim thiếu máu cục bộ và VF, VT đa hình, hoặc rối loạn nhịp được tạo ra khi gắng sức kết hợp với thiếu máu cục bộ (25).
Hình 5. Điều trị VA Tái phát ở các Bệnh nhân Có Bệnh Tim Thiếu máu cục bộ hoặc Bệnh Tim không do Thiếu máu cục bộ (NICM)
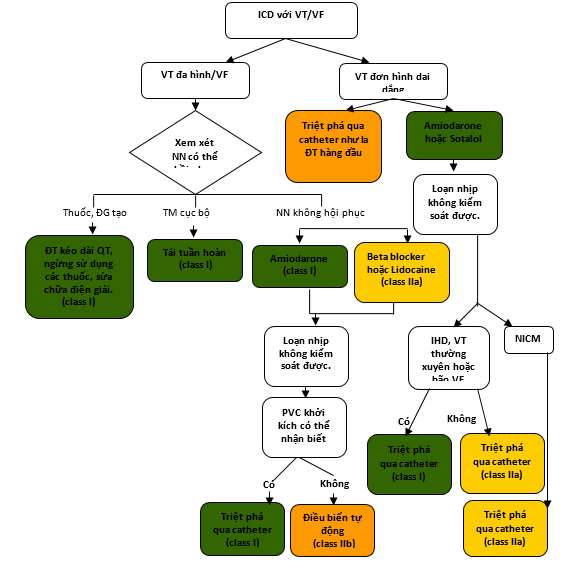
Các màu tương ứng với các Class Khuyến cáo ở bảng 1.
Các mục 5.6, 6, 7.1.3, và 7.2 để thảo luận.
*Điều chỉnh nên bắt đầu với việc chắc chắn ICD được lập trình phù hợp và các nguyên nhân thúc đẩy tiềm tàng, gồm làm xấu đi suy tim, đã được giải quyết. Để biết thông tin về lập trình ICD tối ưu, tham khảo Tuyên bố đồng thuận chuyên gia HRS / EHRA / APHRS / SOLAECE năm 2015 (26). APHRS: Hội Nhịp Tim Châu Á Thái Bình Dương; EHRA: Hội Nhịp Tim châu Âu; HRS: Hội Nhịp Tim; IHD: Bệnh Tim Thiếu máu cục bộ; ICD: Máy khử rung tim có thể cấy; PVC: phức hợp thất sớm; NICM: bệnh cơ tim không do thiếu máu; SOLAECE: Hội Điện sinh lý và Tạo nhịp Tim Mỹ La tinh; VF, rung thất; và VT: nhịp nhanh thất. NN: nguyên nhân. ĐT: điều trị.IHD: bệnh tim thiếu máu cục bộ. NICM: bệnh tim không do thiếu máu cục bộ.
Tài liệu tham khảo.
1. Connolly SJ, Dorian P, Roberts RS, et al. Comparison of beta-blockers, amiodarone plus beta-blockers, or sotalol for prevention of shocks from implantable cardioverter defibrillators: the OPTIC Study: a randomized trial. JAMA. 2006;295:165-71.
2. Pacifico A, Hohnloser SH, Williams JH, et al. Prevention of implantable-defibrillator shocks by treatment with sotalol. d,l-Sotalol Implantable Cardioverter-Defibrillator Study Group. N Engl J Med. 1999;340:1855-62.
3. Kettering K, Mewis C, Dornberger V, et al. Efficacy of metoprolol and sotalol in the prevention of recurrences of sustained ventricular tachyarrhythmias in patients with an implantable cardioverter defibrillator. Pacing Clin Electrophysiol. 2002;25:1571-6.
4. Sapp JL, Wells GA, Parkash R, et al. Ventricular tachycardia ablation versus escalation of antiarrhythmic drugs. N Engl J Med. 2016;375:111-21.
5. Mallidi J, Nadkarni GN, Berger RD, et al. Meta-analysis of catheter ablation as an adjunct to medical therapy for treatment of ventricular tachycardia in patients with structural heart disease. Heart Rhythm. 2011;8:503-10.
6. Marchlinski FE, Haffajee CI, Beshai JF, et al. Long-term success of irrigated radiofrequency catheter ablation of sustained ventricular tachycardia: post-approval THERMOCOOL VT trial. J Am Coll Cardiol. 2016;67:674-83.
7. Stevenson WG, Wilber DJ, Natale A, et al. Irrigated radiofrequency catheter ablation guided by electroanatomic mapping for recurrent ventricular tachycardia after myocardial infarction: the multicenter thermocool ventricular tachycardia ablation trial. Circulation. 2008;118:2773-82.
8. Tanner H, Hindricks G, Volkmer M, et al. Catheter ablation of recurrent scar-related ventricular tachycardia using electroanatomical mapping and irrigated ablation technology: results of the prospective multicenter Euro-VT-study. J Cardiovasc Electrophysiol. 2010;21:47-53.
9. Tung R, Vaseghi M, Frankel DS, et al. Freedom from recurrent ventricular tachycardia after catheter ablation is associated with improved survival in patients with structural heart disease: an International VT Ablation Center Collaborative Group study. Heart Rhythm. 2015;12:1997-2007.
10.Al-Khatib SM, Daubert JP, Anstrom KJ, et al. Catheter ablation for ventricular tachycardia in patients with an implantable cardioverter defibrillator (CALYPSO) pilot trial. J Cardiovasc Electrophysiol. 2015;26:151-7.
11.Kuck KH, Schaumann A, Eckardt L, et al. Catheter ablation of stable ventricular tachycardia before defibrillator implantation in patients with coronary heart disease (VTACH): a multicentre randomised controlled trial. Lancet. 2010;375:31-40.
12.Sesselberg HW, Moss AJ, McNitt S, et al. Ventricular arrhythmia storms in postinfarction patients with implantable defibrillators for primary prevention indications: a MADIT-II substudy. Heart Rhythm. 2007;4:1395-402.
13.Echt DS, Liebson PR, Mitchell LB, et al. Mortality and morbidity in patients receiving encainide, flecainide, or placebo. The Cardiac Arrhythmia Suppression Trial. N Engl J Med. 1991;324:781-8.
14.Sears SF Jr, Todaro JF, Lewis TS, et al. Examining the psychosocial impact of implantable cardioverter defibrillators: a literature review. Clin Cardiol. 1999;22:481-9.
15.Steinberg JS, Gaur A, Sciacca R, et al. New-onset sustained ventricular tachycardia after cardiac surgery. Circulation. 1999;99:903-8.
16.Brugada J, Aguinaga L, Mont L, et al. Coronary artery revascularization in patients with sustained ventricular arrhythmias in the chronic phase of a myocardial infarction: effects on the electrophysiologic substrate and outcome. J Am Coll Cardiol. 2001;37:529-33.
17.Claro JC, Candia R, Rada G, et al. Amiodarone versus other pharmacological interventions for prevention of sudden cardiac death. Cochrane Database Syst Rev 2015;12:CD008093.
18.Bunch TJ, Mahapatra S, Murdock D, et al. Ranolazine reduces ventricular tachycardia burden and ICD shocks in patients with drug-refractory ICD shocks. Pacing Clin Electrophysiol. 2011;34:1600-6.
19.Goldschlager N, Epstein AE, Naccarelli GV, et al. A practical guide for clinicians who treat patients with amiodarone: 2007. Heart Rhythm. 2007;4:1250-9.
20.Singh SN, Fletcher RD, Fisher SG, et al. Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. Survival Trial of Antiarrhythmic Therapy in Congestive Heart Failure. N Engl J Med. 1995;333:77-82.
21. The Cardiac Arrhythmia Suppression Trial II Investigators.. Effect of the antiarrhythmic agent moricizine on survival after myocardial infarction. The Cardiac Arrhythmia Suppression Trial II Investigators. N Engl J Med. 1992;327:227-33.
22.Kuck KH, Cappato R, Siebels J, et al. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study Hamburg (CASH). Circulation. 2000;102:748-54.
23.Sears SE Jr,Conti JB. Understanding implantable cardioverter defibrillator shocks and storms: medical and psychosocial considerations for research and clinical care. Clin Cardiol 2003;26:107-11.
24.Sweeney MO, Sherfesee L, Degroot PJ, et al. Differences in effects of electrical therapy type for ventricular arrhythmias on mortality in implantable cardioverter-defibrillator patients. Heart Rhythm. 2010;7:353-60.
25.Berntsen RF, Gunnes P, Lie M, et al. Surgical revascularization in the treatment of ventricular tachycardia and fibrillation exposed by exercise-induced ischaemia. Eur Heart J. 1993;14:1297-303.
26.Wilkoff BL, Fauchier L, Stiles MK, et al. 2015 HRS/EHRA/APHRS/SOLAECE expert consensus statement on optimal implantable cardioverter-defibrillator programming and testing. J Arrhythm. 2016;32:1-28.
7.2. Bệnh Tim không do thiếu máu cục bộ (NICM)

Văn bản Hỗ trợ Riêng biệt – Khuyến cáo
1. MRI tim cho phép đánh giá bệnh tim cấu trúc và đánh giá chức năng LV và RV gồm định lượng LVEF, khối lượng và thể tích LV, cũng như cấu trúc van. MRI tim có thể giúp đánh giá các tiến triển thâm nhiễm cơ tim và bằng chứng sẹo, cho thấy bằng gia tăng quá mức trễ, kết hợp với VA (1-4, 6).
2. Sự hiện diện của gia tăng quá mức trễ được kết hợp với hậu quả xấu, gồm SCD (1-3).
3. Điều quan trọng phải xem xét các nguyên nhân di truyền của NICM. Mục tiêu của test di truyền cho NICM là xác định những người thân có nguy cơ đột biến gây bệnh và để giúp làm rõ tiên lượng. Sự đột biến của Lamin A / C và NKX 2.5 (7-12) liên quan đến nguy cơ cao về bệnh dẫn truyền sớm, loạn nhịp và SCD, và nhận dạng chúng thường gợi ý xem xét sử dụng sớm ICD. Tuy nhiên, vẫn chưa rõ liệu việc điều trị dược lý sớm đối với các đối tượng đột biến, không triệu chứng có thể ngăn ngừa hoặc làm chậm biểu hiện của bệnh hoặc liệu xét nghiệm di truyền cuối cùng sẽ cải thiện sự sống sót hay không.
Tài liệu tham khảo
1. Greulich S, Deluigi CC, Gloekler S, et al. CMR imaging predicts death and other adverse events in suspected cardiac sarcoidosis. JACC Cardiovasc Imaging. 2013;6:501-11.
2. Kuruvilla S, Adenaw N, Katwal AB, et al. Late gadolinium enhancement on cardiac magnetic resonance predicts adverse cardiovascular outcomes in nonischemic cardiomyopathy: a systematic review and meta-analysis. Circ Cardiovasc Imaging. 2014;7:250-8.
3. Piers SR, Tao Q, van Huls van Taxis CF, et al. Contrast-enhanced MRI-derived scar patterns and associated ventricular tachycardias in nonischemic cardiomyopathy: implications for the ablation strategy. Circ Arrhythm Electrophysiol. 2013;6:875-83.
4. Ackerman MJ, Priori SG, Willems S, et al. HRS/EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies: this document was developed as a partnership between the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA). Europace. 2011;13:1077-109.
5. Hershberger RE, Morales A, Siegfried JD. Clinical and genetic issues in dilated cardiomyopathy: a review for genetics professionals. Genet Med. 2010;12:655-67.
6. Coleman GC, Shaw PW, Balfour PC Jr, et al. Prognostic value of myocardial scarring on CMR in patients with cardiac sarcoidosis: a systematic review and meta-analysis. JACC Cardiovasc Imaging. 2016; 2017;10:411-20.
7. Anselme F, Moubarak G, Savoure A, et al. Implantable cardioverter-defibrillators in lamin A/C mutation carriers with cardiac conduction disorders. Heart Rhythm. 2013;10:1492-8.
8. Kumar S, Baldinger SH, Gandjbakhch E, et al. Long-term arrhythmic and nonarrhythmic outcomes of lamin A/C mutation carriers. J Am Coll Cardiol. 2016;68:2299-307.
9. Meune C, Van Berlo JH, Anselme F, et al. Primary prevention of sudden death in patients with lamin A/C gene mutations. N Engl J Med. 2006;354:209-10.
10.Pasotti M, Klersy C, Pilotto A, et al. Long-term outcome and risk stratification in dilated cardiolaminopathies. J Am Coll Cardiol. 2008;52:1250-60.
11.Van Berlo JH, de Voogt WG, van der Kooi AJ, et al. Meta-analysis of clinical characteristics of 299 carriers of LMNA gene mutations: do lamin A/C mutations portend a high risk of sudden death? J Mol Med. 2005;83:79-83.
12.van Rijsingen IA, Arbustini E, Elliott PM, et al. Risk factors for malignant ventricular arrhythmias in lamin A/C mutation carriers: a European cohort study. J Am Coll Cardiol. 2012;59:493-500.
7.2.1. Ngăn ngừa SCD Thứ phát ở các Bệnh nhân NICM

Văn bản Hỗ trợ Riêng biệt – Khuyến cáo
1. Ba thử nghiệm lâm sàng ngẫu nhiên so sánh ICD với điều trị thuốc ở bệnh nhân được hồi sức từ SCA do VT / VF hoặc VT có ý nghĩa huyết động (1, 2, 4). Các thuốc chống loạn nhịp thường được sử dụng gồm amiodarone, thuốc chẹn beta, hoặc cả hai, mặc dù trong nghiên cứu CASH (Cardiac Arrest Study Hamburg) (4), cũng có một nhánh propafenone đã phải ngừng sớm do tử vong tăng lên. Ba thử nghiệm thu nhận 1,963 bệnh nhân, nhưng chỉ có 292 (14,8%) NICM. Một phân tích gộp trong đó dữ liệu từ AVID và CIDS đã được tổng hợp giảm không có ý nghĩa 31% trong tử suất do mọi nguyên nhân liên quan đến điều trị nội khoa ở các bệnh nhân NICM (3). Mặc dù phân tích này không đủ mạnh, việc giảm tử suất được quan sát phù hợp với lợi ích được quan sát trong toàn bộ quần thể nghiên cứu. Trong thử nghiệm AVID (1), bệnh nhân không đủ điều kiện cho RCT đã được đưa vào đăng ký và VT không có triệu chứng nghiêm trọng hoặc tổn thương huyết động có liên quan đến tần số tử vong tương tự như bệnh nhân VT không ổn định được chỉ định điều trị nội khoa. Do đó, VT ổn định có thể là dấu hiệu cho một chất nền có khả năng phát sinh loạn nhịp nguy hiểm tiếp theo (5).
2. Các nghiên cứu quan sát nhỏ cho thấy tử suất cao và các sốc ICD phù hợp thường gặp ở những bệnh nhân bị ngất và NICM (7-9). Giả định các VAs ác tính có thể là nguyên nhân gây ra ngất và ICD nên được bảo vệ mới đây đã được thử thách. Trong phân tích phân nhóm của SCD-HeFT bao gồm 472 bệnh nhân, ICD không làm hoặc ngất tái phát hoặc nguy cơ tử suất tăng lên kết hợp với ngất (10). Một phân tích dưới nhóm nghiên cứu MADIT-RIT (Nghiên cứu Cấy Máy Khử rung Tự động Đa trung tâm – Giảm Điều trị Không phù hợp) đã nhận thấy ngất do loạn nhịp chỉ ở 39% bệnh nhân (11). Những nghiên cứu này cho thấy ngất ở một số bệnh nhân HF có thể chỉ ra bệnh cơ tim giai đoạn cuối kết hợp với tiên lượng xấu (11). Trong phân tích nhỏ của DEFINITE, VT / VF dai dẳng có thể tạo ra được xác định ở một số ít bệnh nhân, nhưng nó kết hợp với điều trị ICD phù hợp (14). Nghiên cứu khác về test điện sinh lý trong NICM cho thấy có 27% số bệnh nhân có thể tạo ra VT / VF liên quan đến các biến cố ICD trong tương lai (15). Trong một nghiên cứu bệnh nhân với NICM, tử suất do tim có tương quan với LVEF nhưng không có khả năng thúc đẩy trong nghiên cứu điện sinh lý (16). Dựa cơ sở các dữ liệu này, nhiều chuyên gia không hài lòng loại trừ ICD khỏi các bệnh nhân NICM đã ngất nhiều khả năng do VA thậm chí nếu nghiên cứu điện sinh lý cho thấy không có VT dai dẳng có thể tạo ra.
3. Việc tiếp cận với ICDs có thể bị hạn chế do các cân nhắc về tài chính, y học hoặc cá nhân. Ngoài ra, không phải tất cả các bệnh nhân có nguy cơ cao SCD đều đáp ứng các chỉ định ICD, chẳng hạn như những người có HF giai đoạn IV không có CRT hoặc có tuổi thọ < 1 năm. Một phân tích gộp các RCTs, xem xét việc sử dụng amiodarone để phòng ngừa SCD, bao gồm 15 nghiên cứu với 8522 bệnh nhân được chỉ định dùng amiodarone hoặc giả dược / đối chứng (12). Amiodaron giảm nguy cơ SCD xuống 29%; tuy nhiên, nó không làm giảm tử vong do mọi nguyên nhân và có liên quan đến tăng nguy cơ độc tính phổi và tuyến giáp. Trong phân tích phân nhóm, lợi ích của amiodarone xuất hiện tương tự ở bệnh nhân thiếu máu cơ tim cục bộ và cả ở các bệnh nhân NICM (12). Trong một phân tích gộp riêng rẽ (13), chứng cứ là không đủ để ủng hộ cho hiệu quả của amiodarone trong việc giảm SCD và tử suất do mọi nguyên nhân ở những người sống sót sau ngừng tim hoặc những người bị ngất do VA. Một phân tích dưới nhóm nghiên cứu VALIANT (Valsartan trong Nhồi máu cơ tim cấp) cho thấy amiodarone có liên quan đến sự gia tăng tử vong ở bệnh nhân HF NYHA III (17). Những dữ liệu này nói lên cần tiếpphảicẩn thận và tinh tế để sử dụng amiodarone cho dự phòng thứ phát SCD ở bệnh nhân NICM.
Tài liệu tham khảo
1. The Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Engl J Med. 1997;337:1576-83.
2. Connolly SJ, Gent M, Roberts RS, et al. Canadian implantable defibrillator study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation. 2000;101:1297-302.
3. Desai AS, Fang JC, Maisel WH, et al. Implantable defibrillators for the prevention of mortality in patients with nonischemic cardiomyopathy: a meta-analysis of randomized controlled trials. JAMA. 2004;292:2874-9.
4. Kuck KH, Cappato R, Siebels J, et al. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study Hamburg (CASH). Circulation. 2000;102:748-54.
5. Raitt MH, Renfroe EG, Epstein AE, et al. “Stable” ventricular tachycardia is not a benign rhythm: insights from the Antiarrhythmics versus Implantable Defibrillators (AVID) registry. Circulation. 2001;103:244-52.
6. Brilakis ES, Shen WK, Hammill SC, et al. Role of programmed ventricular stimulation and implantable cardioverter defibrillators in patients with idiopathic dilated cardiomyopathy and syncope. Pacing Clin Electrophysiol. 2001;24:1623-30.
7. Fonarow GC, Feliciano Z, Boyle NG, et al. Improved survival in patients with nonischemic advanced heart failure and syncope treated with an implantable cardioverter-defibrillator. Am J Cardiol. 2000;85:981-5.
8. Knight BP, Goyal R, Pelosi F, et al. Outcome of patients with nonischemic dilated cardiomyopathy and unexplained syncope treated with an implantable defibrillator. J Am Coll Cardiol. 1999;33:1964-70.
9. Middlekauff HR, Stevenson WG, Stevenson LW, et al. Syncope in advanced heart failure: high risk of sudden death regardless of origin of syncope. J Am Coll Cardiol. 1993;21:110-6.
10.Olshansky B, Poole JE, Johnson G, et al. Syncope predicts the outcome of cardiomyopathy patients: analysis of the SCD-HeFT study. J Am Coll Cardiol. 2008;51:1277-82.
11.Ruwald MH, Okumura K, Kimura T, et al. Syncope in high-risk cardiomyopathy patients with implantable defibrillators: frequency, risk factors, mechanisms, and association with mortality: results from the multicenter automatic defibrillator implantation trial-reduce inappropriate therapy (MADIT-RIT) study. Circulation. 2014;129:545-52.
12.Piccini JP, Berger JS, O’Connor CM. Amiodarone for the prevention of sudden cardiac death: a meta-analysis of randomized controlled trials. Eur Heart J. 2009;30:1245-53.
13.Claro JC, Candia R, Rada G, et al. Amiodarone versus other pharmacological interventions for prevention of sudden cardiac death. Cochrane Database Syst Rev. 2015;12:CD008093.
14.Daubert JP, Winters SL, Subacius H, et al. Ventricular arrhythmia inducibility predicts subsequent ICD activation in nonischemic cardiomyopathy patients: a DEFINITE substudy. Pacing Clin Electrophysiol. 2009;32:755-61.
15.Gatzoulis KA, Vouliotis AI, Tsiachris D, et al. Primary prevention of sudden cardiac death in a nonischemic dilated cardiomyopathy population: reappraisal of the role of programmed ventricular stimulation. Circ Arrhythm Electrophysiol. 2013;6:504-12.
16.Hilfiker G, Schoenenberger AW, Erne P, et al. Utility of electrophysiological studies to predict arrhythmic events. World J Cardiol. 2015;7:344-50.
17.Thomas KL, Al-Khatib SM, Lokhnygina Y, et al. Amiodarone use after acute myocardial infarction complicated by heart failure and/or left ventricular dysfunction may be associated with excess mortality. Am Heart J. 2008;155:87-93
7.2.2. Ngăn ngừa SCD tiên phát ở các Bệnh nhân NICM

Văn bản Hỗ trợ Riêng biệt – Khuyến cáo
1. Đối với tất cả các bệnh nhân NICM, điều bắt buộc phải GDMT cho HF ít nhất 3 tháng trước khi cho ICD dự phòng tiên phát. Bốn RCTs tiền cứu (1, 2, 5, 6) ICD được đánh giá khởi đầu cho ngăn ngừa tiên phá SCD ở các bệnh nhân NICM. Hai (2, 6) là các nghiên cứu nhỏ đã được ngưng sớm do tần số biến cố thấp. Trong DEFINITE (5), ICD làm giảm nguy cơ SCD, với xu hướng làm giảm tử suất do mọi nguyên nhân. SCD-HeFT bao gồm 792 bệnh nhân NICM (1). Tổng số tử vong trong 5 năm 27% ở nhóm giả dược và 21% ở nhóm ICD (p = 0,06). Một phân tích gộp các nghiên cứu này cho thấy giảm có ý nghĩa 31% tử vong do mọi nguyên nhân đối với ICD so với điều trị thuốc (4). DANISH (Danish Study to Assess the Efficacy of ICDs in Patients with Non-ischemic Systolic Heart Failure on Mortality: Nghiên cứu Đan Mạch Đánh giá Hiệu quả của ICD ở Các Bệnh nhân Suy tim Không do thiếu máu cục bộ trên Tử suất) (11) câu hỏi đã được đặt ra về vai trò của ICD dự phòng tiên phát ở các bệnh nhân NICM. Nghiên cứu ngẫu nhiên này với 1116 bệnh nhân NICM có LVEF <35% và HF class II, III, hoặc IV (nếu CRT được lên kế hoạch) đưa đến ICD hoặc không ICD. CRT (hoặc ICD hoặc máy tạo nhịp tim) hiện diện ở 58% bệnh nhân trong nhóm ICD và điều trị thuốc. Do đó, kết quả của DANISH không nên được tổng quát cho bệnh nhân NICM không đủ tiêu chuẩn cho CRT. Trong thời gian theo dõi trung bình 5,6 năm, ICD làm giảm SCD từ 8,4% xuống còn 4,3%, nhưng không có sự khác biệt về tần số tử vong do mọi nguyên nhân (11). Một số phân tích gộp đã được xuất bản (12, 13). Một số cung cấp dữ liệu về ICDs có và không có CRT đã cho thấy lợi ích sống sót từ ICD (13). Dữ liệu thứ hai đã được sử dụng ở 2 nghiên cứu và đã áp dụng cách tiếp cận mạnh mẽ hơn để giảm sự không đồng nhất bằng cách loại trừ các bệnh nhân có CRT và các bệnh nhân ngẫu nhiên đối với thuốc chống loạn nhịp; giảm nguy cơ tử vong tương đối 25% bằng ICD đã được chỉ ra (12).
2. Bệnh Lamino là các bệnh do các đột biến gây ra chủ yếu ở gen Lamin A / C sản sinh ra nhiều bệnh di truyền khác nhau gồm các phân typ loạn dưỡng cơ và chứng già trước tuổi (progeria). Sự liên quan đến tim đơn độc cũng được quan sát thấy và là một nguyên nhân quan trọng gây ra bệnh cơ tim gia đình (9). Bệnh này có tính thâm nhập cao nên tất cả những người bị ảnh hưởng đều có chứng bệnh ở tuổi 60. Biểu hiện của tim có thể gồm rung nhĩ, rối loạn dẫn truyền, VA và NICM. Một số nghiên cứu quan sát cho thấy có nguy SCD cao khi có tim bị biểu hiện (7-10). Một nghiên cứu cho biết SCD là phương thức tử vong thường gặp nhất (46%) trong cả hai kiểu hình tim và thần kinh cơ của bệnh Lamin (9). Trong một nhóm gồm 269 cá thể dương tính đột biến LMNA (10), NSVT trong quá trình theo dõi điện tâm đồ lưu động, LVEF < 45% ở lần đánh giá đầu tiên, nam giới và đột biến không phải misense (không xẩy ra ở ADN) là các yếu tố nguy cơ độc lập cho VA. VA ác tính được quan sát chỉ ở những người có ≥2 các yếu tố nguy ơ này (10). Không có nghiên cứu nào được kiểm tra tính hiệu quả của ICD trong sống sót dài hạn.
3. Bệnh nhân NICM có HF class I đã không được bao gồm trong SCD-HeFT hoặc DANISH (1, 11). Mặc dù các bệnh nhân này đã được đưa vào nghiên cứu DEFINITE, nhưng chỉ có 99 (21,6%) trong số 458 bệnh nhân trong nghiên cứu DEFINITE có HF class I (5). Do đó, không chắc chắn liệu ICD ngăn ngừa tiên phát ở các bệnh nhân như vậy có cải thiện được sống sót hay không.
4. Không có đầy đủ dữ liệu từ RCTs về giá trị của ICD ở bệnh nhân NYHA class IV. Các bệnh nhân HF class IV ngoại trú được gồm trong nghiên cứu COMPANION, tất cả, cho thấy tình trạng chức năng được cải thiện và sự sống sót với CRT-D (3). Trừ phi bệnh nhân như vậy là ứng cử viên cho CRT hoặc điều trị HF tăng cường như ghép tim hoạc LVAD (dụng cụ hỗ trọ thất trái), ICD không được hy vọng để kéo dài sự sống sót có ý nghĩa (3).
Tài liệu tham khảo
1. Bardy GH, Lee KL, Mark DB, et al. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med. 2005;352:225-37.
2. Bänsch D, Antz M, Boczor S, et al. Primary prevention of sudden cardiac death in idiopathic dilated cardiomyopathy: the Cardiomyopathy Trial (CAT). Circulation. 2002;105:1453-8.
3. Bristow MR, Saxon LA, Boehmer J, et al. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med. 2004;350:2140-50.
4. Desai AS, Fang JC, Maisel WH, et al. Implantable defibrillators for the prevention of mortality in patients with nonischemic cardiomyopathy: a meta-analysis of randomized controlled trials. JAMA. 2004;292:2874-9.
5. Kadish A, Dyer A, Daubert JP, et al. Prophylactic defibrillator implantation in patients with nonischemic dilated cardiomyopathy. N Engl J Med. 2004;350:2151-8.
6. Strickberger SA, Hummel JD, Bartlett TG, et al. Amiodarone versus implantable cardioverter-defibrillator: randomized trial in patients with nonischemic dilated cardiomyopathy and asymptomatic nonsustained ventricular tachycardia–AMIOVIRT. J Am Coll Cardiol. 2003;41:1707-12.
7. Anselme F, Moubarak G, Savoure A, et al. Implantable cardioverter-defibrillators in lamin A/C mutation carriers with cardiac conduction disorders. Heart Rhythm. 2013;10:1492-8.
8. Pasotti M, Klersy C, Pilotto A, et al. Long-term outcome and risk stratification in dilated cardiolaminopathies. J Am Coll Cardiol. 2008;52:1250-60.
9. Van Berlo JH, de Voogt WG, van der Kooi AJ, et al. Meta-analysis of clinical characteristics of 299 carriers of LMNA gene mutations: do lamin A/C mutations portend a high risk of sudden death? J Mol Med. 2005;83:79-83.
10.van Rijsingen IA, Arbustini E, Elliott PM, et al. Risk factors for malignant ventricular arrhythmias in lamin A/C mutation carriers: a European cohort study. J Am Coll Cardiol. 2012;59:493-500.
11.Køber L, Thune JJ, Nielsen JC, et al. Defibrillator implantation in patients with nonischemic systolic heart failure. N Engl J Med. 2016;375:1221-30.
12.Al-Khatib SM, Fonarow GC, Joglar JA, et al. Primary prevention implantable cardioverter defibillators in patients with nonischemic cardiomyopathy: a meta-analysis. JAMA Cardiol. 2017;2:685-8.
13.Golwala H, Bajaj NS, Arora G, et al. Implantable cardioverter-defibrillator for nonischemic cardiomyopathy: an updated meta-analysis. Circulation. 2017;135:201-3.
7.2.3. Điều trị VA tái phát ở các bệnh nhân NICM

Văn bản Hỗ trợ Đặc biệt – Khuyến cáo
1 ICDs giảm tử suất do VA, nhưng các sốc ICD gây đau đớn và liên quan đến bệnh suất một cách đáng kể và QoL (chất lượng sống) kém. Mặc dù ICDs có khả năng lập trình cao và cung cấp phương pháp điều trị chống nhịp nhanh có thể cắt hầu hết các đợt VT mà không cần sốc, phòng ngừa các cú sốc, vừa thích hợp vừa không phù hợp, vẫn là mối quan tâm quan trọng. Trong nghiên cứu OPTIC (Optimal Pharmacological Therapy in Cardioverter Defibrillator Patients), 412 bệnh nhân có VT và VF đã nhận được ICD trong vòng 21 ngày sau khi loạn nhịp được ghi nhận (1) được chọn ngẫu nhiên để điều trị amiodarone cộng với beta blocker, sotalol đơn thuần hoặc thuốc chẹn beta. Hơn 1 năm, các cú sốc xảy ra với 38,5% chỉ riêng cho thuốc chẹn beta, 24,3% được chỉ định cho sotalol, và 10,3% được chỉ định dùng amiodarone plus beta blocker. Tỷ lệ ngưng dùng thuốc nghiên cứu ở 1 năm là 18,2% đối với amiodarone, 23,5% đối với sotalol, và 5,3% đối với thuốc chẹn beta. Các phản ứng phụ ở phổi và tuyến giáp và nhịp chậm có triệu chứng thường gặp hơn ở những bệnh nhân được phân ngẫu nhiên cho amiodarone. Do đó, amiodaron cộng với thuốc chẹn beta có hiệu quả hơn so với sotalol trong việc phòng ngừa các cú sốc ICD nhưng làm tăng nguy cơ tác dụng phụ liên quan đến thuốc (1). Sotalol không nên dùng cho bệnh nhân có LVEF <20% do hiệu quả inotrop âm tính.
2. VT đơn hình dai dẳng do NICM thường hơn do vào lại liên quan đến sẹo. MRI tim thường cho thấy vị trí vết sẹo, có xu hướng là nền do theo vòng van 2 lá hoặc ở vách (4, 5). Nền VT có thể dưới nội tâm mạc, dưới thượng tâm mạc, hoặc trong cơ tim, cũng như tất cả các khu vực có thể bị ảnh hưởng và đòi hỏi triệt phá nội tâm mạc và thượng tâm mạc. Trong nghiên cứu HELP-VT (Heart Center of Leipzig VT) (2), triệt phá thành công tất cả các hình thái VT đã đạt được ở 66,7% bệnh nhân NICM, so với tỷ lệ thành công 77,4% ở bệnh cơ tim thiếu máu cục bộ. Phương pháp tiếp cận thượng tâm mạc để triệt phá được đòi hỏi ở 30,2% bệnh nhân NICM, so với chỉ 1,2% bệnh cơ tim thiếu máu. Triệt phá thượng tâm mạc là dự báo độc lập của triệt phá thành công. Thành công cấp thời và thành công lâu dài của triệt phá thấp hơn cho NICM, so với các bệnh nhân sau MI. Tỷ lệ sống sót do VT tái phát sau khi triệt phá qua catheter dường như là tốt hơn cho các bệnh nhân có thiếu máu cục bộ so với NICM (57% so với 40.5% trong 1 năm) (2). Các nguy cơ tương tự như những trường hợp quan sát thấy đối với triệt phá VT sau nhồi máu, với những nguy cơ bổ sung về tiếp cận thượng tâm mạc và triệt phá khi cần thiết. Mặc dù bất kỳ NICM có thể tạo ra VT liên quan đến sẹo, sarcoidosis tim (xem phần 7.6) và đột biến Lamin đặc biệt liên quan đến VT đơn hình dai dẳng (6).
Hình 6. Dự phòng SCD Thứ phát và Nguyên phát ở các bệnh nhân NICM
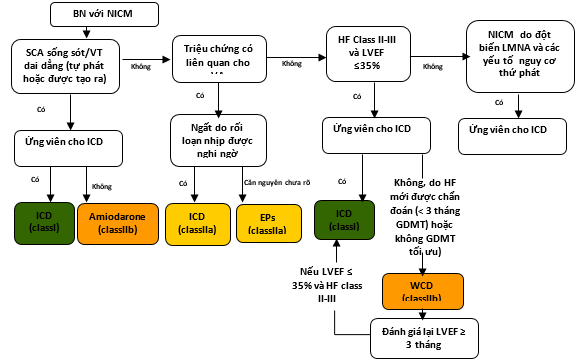
Các màu tương ứng với Class của khuyến cáo ở bảng 1.
Xem phần 7.2 để thảo luận.
* Ứng cử viên ICD được xác định theo trạng thái chức năng, tuổi thọ hoặc sở thích của bệnh nhân.
2 ° chỉ thứ phát; EP: nghiên cứu điện sinh lý; GDMT: điều chỉnh và điều trị theo hướng dẫn; HF: suy tim; ICD: máy khử rung tim có thẻ cấy; LVEF: phân suất tống máu thất trái; NICM, bệnh cơ tim không do thiếu máu; SCA: ngừng tim đột ngột; SCD: đột tử tim; VA, loạn nhịp thất; và WCD: máy khử rung tim có thể mặc.
Tài liệu tham khảo
1. Connolly SJ, Dorian P, Roberts RS, et al. Comparison of beta-blockers, amiodarone plus beta-blockers, or sotalol for prevention of shocks from implantable cardioverter defibrillators: the OPTIC Study: a randomized trial. JAMA. 2006;295:165-71.
2. Dinov B, Fiedler L, Schonbauer R, et al. Outcomes in catheter ablation of ventricular tachycardia in dilated nonischemic cardiomyopathy compared with ischemic cardiomyopathy: results from the Prospective Heart Centre of Leipzig VT (HELP-VT) Study. Circulation. 2014;129:728-36.
3. Tung R, Vaseghi M, Frankel DS, et al. Freedom from recurrent ventricular tachycardia after catheter ablation is associated with improved survival in patients with structural heart disease: an International VT Ablation Center Collaborative Group study. Heart Rhythm. 2015;12:1997-2007.
4. Piers SR, Tao Q, Tvan Huls van Taxis CF, et al. Contrast-enhanced MRI-derived scar patterns and associated ventricular tachycardias in nonischemic cardiomyopathy: implications for the ablation strategy. Circ Arrhythm Electrophysiol. 2013;6:875-83.
5. Desjardins B, Yokokawa M, Good E, et al. Characteristics of intramural scar in patients with nonischemic cardiomyopathy and relation to intramural ventricular arrhythmias. Circ Arrhythm Electrophysiol. 2013;6:891-7.
6. Naruse Y, Sekiguchi Y, Nogami A, et al. Systematic treatment approach to ventricular tachycardia in cardiac sarcoidosis. Circ Arrhythm Electrophysiol. 2014;7:407-13.
7.3 Bệnh cơ tim thất phải gây loạn nhịp
Tóm tắt
Bệnh cơ tim thất phải gây loạn nhịp là bệnh cơ tim di truyền, ảnh hưởng ưu thế thất phải nhưng có thể ảnh hưởng đến thất trái, các khu vực cơ tim bị thay thế bằng tổ chức xơ và tổ chức mỡ thường gây ra VA và SCD.
Văn bản Hỗ trợ Riêng biệt – Khuyến cáo
1. Người thân thế hệ thứ nhất được chọn là những người thân được sẵn sàng để thực hiện test tiếp theo và họ có lợi ích từ tầm soát và test tiếp theo (chứ không phải những bệnh nhân bị bệnh nặng hoặc những người không muốn được kiểm tra và thử nghiệm). Bệnh thất phải gây loạn nhịp thường do đột biến liên quan đến protein liên kết giữa các tế bào và chúng thường có tính di truyền chiếm ưu thế autosom với sự xâm nhập khác nhau. SCD có thể là biểu hiện khởi đầu của bệnh cơ tim thất phải gây loạn nhịp. Tầm soát lâm sàng bằng ECG, hình ảnh học tim, và theo dõi nhịp lưu động và / hoặc test gắng sức có thể nhận biết các thành viên gia đình có nguy cơ bệnh cơ tim thất phải gây loạn nhịp. Bệnh thất phải gây loạn nhịp được phát hiện bằng lâm sàng ở khoảng 35% đến 40% các người thân thế hệ thứ nhất (3, 4), thường gặp nhất ở anh chị em hoặc người thân thế hệ thứ nhất có triệu chứng (4). Khi một người tầm soát được phát hiện có đột biến gây ra bệnh, tầm soát type gene mục tiêu có thể nhận biết các người thân đột biến dương tính (1), với khoảng 35% các cá thể đột biến dương tính cuối cùng phát triển bệnh tiến triển (1, 4). Trong các nghiên cứu về bệnh cơ tim thất phải gây loạn nhịp, những cá nhân đột biến dương tính không có biểu hiện bệnh khởi đầu, 8-16% có biến cố loạn nhịp lớn trong vòng 7 đến 39 năm tiếp theo (1, 4, 26). Việc xác định sớm các thành viên bị ảnh hưởng hoặc có khả năng bị ảnh hưởng có thể cho phép thay đổi thói quen sống trong tham gia thể thao và theo dõi hàng loạt sự phát triển của các bất thường điện tâm đồ, các triệu chứng, rối loạn thất trái, hoặc rối loạn nhịp. Khi test di truyền đối với bệnh cơ tim thất phải gây loạn nhịp có sự phức tạp tinh tế, quyết định tiến hành tâm soát gia đình được dễ dàng bằng tư vấn thông tin di truyền để thảo luận về chi phí test, mất tiềm ẩn gene đơn thuần khi xác định biểu hiện bệnh, giám sát nối tiếp để phát triển các bất thường về điện tâm đồ, triệu chứng, rối loạn chức năng thất trái, hoặc loạn nhịp tim. Vì xét nghiệm di truyền đối với bệnh lý cơ tim thất phải có sự phức tạp tinh tế, quyết định tiến hành sàng lọc gia đình được tạo điều kiện bằng tư vấn di truyền thông báo để thảo luận về chi phí xét nghiệm, thiếu tiềm năng của một gen đơn như là yếu tố quyết định sự biểu hiện bệnh, tư vấn tiến triển bệnh không chắc chắn về tâm lý, gợi ý về thay đổi lối sống, tâm soát, và điều trị tiềm tàng.
2. MRI tim cung cấp đánh giá chất lượng cao về chức năng tâm thất, kích thước, bất thường chuyển động thành khu trú, và mức độ sẹo và xơ hóa (gia tăng gadolinium trễ) được thấy ở 30% đến 95% bệnh nhân có chẩn đoán lâm sàng bệnh cơ tim thất phải gây loạn nhịp (5, 6, 37, 38). MRI tim phát hiện sự liên quan đến cả hai thất ở 34% đến 56% bệnh nhân, với liên quan đến LV đơn độc được ghi nhận ở 4% đến 9% bệnh nhân (37-40). MRI tim nên bao gồm đánh giá gia tăng gadolinium trễ đến cuối cùng với định lượng xơ hóa. Áp dụng Tiêu chuẩn của Tổ Công tác 2010 đối với các tiêu chuẩn MRI tim để chẩn đoán bệnh cơ tim thất phải gây loạn nhịp đã cải thiện tính đặc hiệu của test này (5, 8). Các phát hiện về điện tâm đồ và Holter đi trước các bất thường của MRI tim có thẻ phát hiện ở các cá thể bệnh cơ tim thất phải gây loạn nhịp có đột biến dương tính, với chỉ có 4% bệnh nhân có kết quả điện tâm đồ và Holter bình thường và có bất thường về MRI tim, cho thấy việc đánh giá cấu trúc tim và chức năng sử dụng MRI tim có thể là không cần thiết ở những cá thể đột biến dương tính không có bất thường điện học (7). Sự hiện diện của bất thường điện tâm đồ và các triệu chứng MRI tim bất thường có thể xác định bệnh nhân có nguy cơ phát triển VA tăng cao (7, 38). Các vùng sẹo được xác định trên MRI tim có tương quan với khu vực nền VT được xác định bằng lập bản đồ nội và ngoại tâm mạc (38). Trong giai đoạn sớm của bệnh, MRI tim cơ bản có thể cung cấp thông tin hữu ích cùng với các điểm bất thường về điện tâm đồ và nhịp tim để theo dõi sự tiến triển của bệnh theo thời gian. Kinh nghiệm và chuyên môn trong việc giải thích MRI tim rất quan trọng (5, 8).
3. Bệnh cơ tim thất phải gây loạn nhịp được đặc trưng bằng mất đi tế bào cơ thất tiến triển với sự thay thế bằng tổ chức mỡ và xơ, kết hợp với rối loạn chức năng thất tiến triển có thể liên quan đến cả hai thất, VA, ngất, và SCD có thể xuất hiện ở tuổi tương đối trẻ, đặc biệt ở thập niên thứ 2 và thứ 3 của đời sống và thường xuất hiện trong quá trình hoạt động thể lực (1, 16, 22, 41). VT dai dẳng là một yếu tố tiên đoán quan trọng của SCA và SCD hoặc các sốc ICD phù hợp ở bệnh nhân bị bệnh cơ tim thất phải gây loạn nhịp tim (10, 13). Ở những bệnh nhân nhận ICD để dự tiên phát, sốc ICD phù hợp được thông báo ở 24% đến 48% bệnh nhân (9, 10, 12, 13). Do VT ở bệnh nhân bệnh cơ tim thất phải gây loạn nhịp là đơn hình ở 55% đến 90% các cơn trên cơ sở thông tin từ ICD hoặc các nghiên cứu điện sinh lý (12, 36), các thuật toán về chống nhịp nhanh được sử dụng để cắt cơn VT.
4. PVCs thường xuyên,> 760 đến 1000 / 24 giờ trong quá trình theo dõi lưu động nhịp tim, có tương quan với nguy cơ rối loạn nhịp (9, 23). Sự hiện diện của NSVT hoặc VT dai dẳng là một yếu tố tiên đoán quan trọng của các biến cố bất lợi (9, 12, 13, 42, 43). Nguy cơ rối loạn nhịp tăng lên do gắng sức nặng phù hợp với điều biến beta adrenergic của biểu hiện bệnh (17, 20, 21). Một đăng ký quan sát báo cáo điều trị bằng atenolol hoặc amiodarone có liên quan đến VA ít có liên quan đến VA thích hợp về lâm sàng, trong khi sotalol không có hiệu quả hoặc loạn nhịp tăng lên (15). Theo dõi bệnh nhân để đánh giá gánh nặng VA và mức độ đầy đủ của điều trị chẹn beta thường được áp dụng (9, 14, 23, 42).
5. Bệnh nhân bệnh cơ tim thất phải gây loạn nhịp có nguy cơ SCD tăng lên một cách có ý nghĩa trong quá trình gắng sức (16, 17, 20, 21). Gắng sức mạnh mẽ ở bệnh nhân bệnh cơ tim thất phải gây loạn nhịp đã được nhìn thấy suy chức năng cơ tim bằng siêu âm tim và MRI tim (19). Sự tham gia vào hoạt động thế lực cường độ cao / khoảng thời gian hoặc dẻo dai sẽ đẩy nhanh quá trình xâm nhập / tiến triển của bệnh và nguy cơ rối loạn nhịp cho bệnh nhân bệnh cơ tim thất phải gây loạn nhịp và các cá thể có đột biến dương tính, cũng như các thành viên gia đình có đột biến dương tính (17, 19-21). Bệnh nhân bệnh cơ tim thất phải gây loạn nhịp tham gia vào các thể thao cạnh tranh có nguy cơ VT và SCD tăng lên, so sánh với những người tham gia vào thể thao giải trí hoặc không vận động (17-19, 21). Gắng sức ảnh hưởng đến tiến triển của bệnh một cách tuyến tính; các thành viên trong gia đình hoạt động được hạn chế ít hơn mức tối thiểu theo hướng dẫn về hoạt động của AHA (<650 giờ tương đương chuyển hóa / năm [MET- h / năm]) ít có khả năng phát triển VA hoặc tiến triển bệnh (21). Trong một nghiên cứu về bệnh cơ tim thất phải gây loạn nhịp những người tham gia nghiên cứu và các vận động viên gắng sức (được định nghĩa là những người có hoạt động mạnh 4 giờ / tuần) được nhận thấy có chức năng hai thất giảm so với những người không phải vận động viên thể thao là bệnh nhân bệnh cơ tim thất phải gây loạn nhịp và các thành viên gia đình có đột biến dương tính (19). Nhiều ý kiến khuyên hạn chế cường độ tập luyện và thời gian kéo dài đến < 650 MET-h / năm, hoặc 12,5 MET-h / tuần (21).
6. Những người bệnh cơ tim thất phải gây loạn nhịp tham gia nghiên cứu thường được chẩn đoán bằng sự biểu hiện của các triệu chứng lâm sàng cùng với các tiêu chuẩn của Tổ Công tác về bệnh cơ tim thất phải gây loạn nhịp gồm bất thường về ECG, các thay đổi cấu trúc và chức năng bệnh cơ tim thất phải gây loạn nhịp thường được chẩn đoán bằng sự hiện diện của các triệu chứng lâm sàng cùng với sự xuất hiện của loạn nhịp tim, bao gồm: bất thường về ECG, thay đổi về cấu trúc và chức năng của mỗi tâm thất, rối loạn nhịp, và bệnh cơ tim thất phải gây loạn nhịp ở nhưng người thân thế hệ thứ nhất (6). Đột biến di truyền bệnh lý đã được bổ xung vào các tiểu chuẩn chính của Tổ Công tác năm 2010 (44). Hiệu quả của việc kiểm tra di truyền ở những người tham gia kiểm tra bị nghi ngờ bệnh cơ tim thất phải gây loạn nhịp thường từ 30% đến 54% và lên đến 58% ở những bệnh nhân có tiền sử SCD gia đình một cách mạnh mẽ ở nhiều thành viên (3, 25, 45). Test di truyền âm tính cho bệnh cơ tim thất phải gây loạn nhịp không loại trừ bệnh, test dương tính hiện nay không hướng dẫn điều trị (22). Đối với người tham gia nghiên cứu với chẩn đoán lâm sàng của bệnh cơ tim thất phải gây loạn nhịp, xác định các đột biến gây bệnh cung cấp thông tin tiên lượng hạn chế liên quan đến nguy cơ VT / VF (22, 26) hoặc sự phát triển HF (22). Trong một nghiên cứu đa trung tâm lớn, sự có mặt của các đột biến dương tính trong số những người tham gia xét nghiệm đã không kết hợp với sự khác biệt trong tử suất hoặc ghép tim (1). Tuy nhiên, việc xác định được đột biến gây bệnh làm dễ dàng cho việc tầm soát di truyền đạt đích đối với đột biến đó ở những người thân thế hệ đầu tiên, có thể nhận biết khoảng 60% đến 70% số lượng gen dương tính (1), cao nhất trong số các anh chị em và những người có các triệu chứng (4). Việc tầm soát đột biến chuyên biệt có thể xác định một số thành viên trong gia đình có gene dương tính trước khi biểu hiện bệnh, đồng thời làm giảm nhẹ sự cần thiết phải thay đổi sinh hoạt và giám sát dài hạn (2, 3).
7. Ngất đã được báo cáo từ 16% đến 39% ở bệnh nhân bệnh cơ tim thất phải gây loạn nhịp trong thời điểm chẩn đoán (13, 14, 16, 41, 43), thường liên quan đến gắng sức, và có liên quan đến nguy cơ cao về loạn nhịp trong một số nghiên cứu (10, 41). Trong số những bệnh nhân bị bệnh cơ tim thất phải gây loạn nhịp và ICD được cấy, ngất là một yếu tố tiên đoán quan trọng của sốc thích hợp trong 1 nghiên cứu (10), nhưng không nhận thấy trong các nghiên cứu khác (9, 12, 13, 43). Các nghiên cứu đã không cung cấp thông tin về chức năng tâm thất hoặc các bất thường trên điện tim ở các bệnh nhân ngất, hạn chế đánh giá của nghiên cứu như là một yếu tố nguy cơ độc lập. Ngất có thể là điểm báo trước tiến triển của bệnh nền và nên được lồng ghép vào quyết định tiến trình cho cấy ICD với bệnh nhân.
8. Bệnh nhân bệnh cơ tim thất phải gây loạn nhịp không triệu chứng và không VA hoặc rối loạn chức năng thất thường được quan sát không điều trị chống loạn nhịp khác với điều trị beta blocker, với việc đánh giá lại định kỳ liên tục về sự phát triển loạn nhịp hoặc rối loạn chức năng thất (46, 47). Atenolol đã được chứng minh là làm giảm VA trong 1 nghiên cứu (15). Theo dõi và / hoặc kiểm tra test gắng sức có thể được thực hiện để đánh giá mức độ đầy đủ của liều beta-blockers.
9. Kiểm tra các ICDs cho thấy > 90% VTs tự phát dai dẳng trong bệnh cơ tim thất phải gây loạn nhịp là đơn hình (12), trong khi VT đơn hình dai dẳng có thể tạo ra trong nghiên cứu điện sinh lý ở 55% bệnh nhân (36). VT thường liên quan đến vào lại do sẹo, và dưới nội tâm mạc thường có sẹo lan rộng hơn so với nội tâm mạc (27). Ở các trung tâm có kinh nghiệm, việc sử dụng lập bản đồ màng ngoài tim và triệt phá được kết hợp với kết quả tốt hơn (27, 28, 30, 31, 33). Các biến chứng quan trọng gồm tamponade màng ngoài tim, MI, và tử vong xảy ra ở 2,3% đến 3,3% các trường hợp triệt phá (27-29), nhấn mạnh sự cần thiết phải thực hiện ở các trung tâm có chuyên môn về thủ thuật thượng tâm mạc. Việc triệt phá làm giảm tần suất VT tái phát, mặc dù 27% đến 55% bệnh nhân (27,28) có ít nhất 1 lần tái phát; sự triệt phá VT ở bệnh nhân bệnh cơ tim thất phải gây loạn nhịp không loại trừ được sự cần thiết cho ICD ở các ứng viên phù hợp. Nguy cơ tiềm ẩn tái phát VT do tiến triển bệnh nên được xem xét với bệnh nhân khi xem xét việc triệt phá. Không có sự so sánh ngẫu nhiên liệu pháp chống loạn nhịp để ngăn ngừa VT tái phát. Chẹn beta, sotalol và amiodarone đã được sử dụng (15). Trong một loạt nghiên cứu, sotalol đã ức chế VT có thể tạo ra ở 58% bệnh nhân với <10% bệnh nhân bị tái phát loạn nhịp trong thời gian theo dõi (48). Hiệu quả của các loại thuốc khác nhau dường như rất khác nhau, và do đó cần nhiều nghiên cứu hơn nữa.
10. Ở bệnh cơ tim thất phải gây loạn nhịp, các khu vực sẹo xơ hóa mõ ở thành tự do thất phải tạo ra khu vực hoạt động của thất bị chậm gây ra lệch hướng bị phân đoạn QRS tiếp theo, được biết như các sóng epsilon trên ECG bề mặt (tiêu chuẩn chính) và điện thế trễ trên ECG tín hiệu trung bình (tiêu chuẩn phụ) trong Tiêu chuẩn Tổ Công Tác năm 2010 của Tổ công tác về chẩn đoán bệnh cơ tim thất phải gây loạn nhịp (6). Khi khoảng thời gian QRS ECG chuẩn ≤ 110 ms, tiêu chuẩn cho ECG tín hiệu trung bình bất thường gồm 1 trong số những điểm sau: thời gian QRS được lọc ≥114 ms, khoảng thời gian cuối của QRS < 40 μV vượt quá 37 ms, hoặc căn bậc hai của số trung bình phương điện thế ở 40 ms kết thúc ≤20 μV (6). Những phát hiện bất thường về ECG tín hiệu trung bình có tương quan với mức độ nghiêm trọng của bệnh trên MRI tim (35), và sự gia tăng các biến cố có hại ở nam giới (34). Trong đánh giá việc sử dụng test chẩn đoán bệnh cơ tim thất phải gây loạn nhịp, ECG tín hiệu trung bình có giá trị lớn hơn MRI tim hoặc sinh thiết (14).
11. Giá trị của nghiên cứu điện sinh lý không chắc chắn ở bệnh nhân bệnh cơ tim thất phải gây loạn nhịp không triệu chứng với chức năng thất bảo tồn trong dự kiến nguy cơ SCD tiếp theo. Các nghiên cứu kích thích thất có chương trình ở các bệnh nhân với bệnh cơ tim thất phải gây loạn nhịp rõ ràng hoặc có thể gồm hầu hết các bệnh nhân có triệu chứng, đưa ra các khuyến cáo về bệnh nhân không triệu chứng khó khăn. Các nghiên cứu điện sinh lý gồm VT dai dẳng ở khoảng 60% bệnh nhân (10, 36); nhiều người trong số họ đã từng có các cơn VT dai dẳng tự phát. Ở các bệnh nhân có ICD dự phòng tiên phát, gồm, VT dai dẳng có thể tạo ra không dự báo được các sốc ICD phù hợp tiếp theo (13). Trong 1 nghiên cứu gồm các bệnh nhân có triệu chứng, bệnh nhân không có VT có thể tạo ra ít khả năng để nhận được sốc ICD phù hợp (9). Ở những bệnh nhân không có bằng chứng VA trên theo dõi lưu động, nghiên cứu điện sinh lý âm tính có thể đã hạn chế giá trị về thực hiện quyết định cho ICD.
Tài liệu tham khảo
1. Groeneweg JA, Bhonsale A, James CA, et al. Clinical presentation, long-term follow-up, and outcomes of 1001 arrhythmogenic right ventricular dysplasia/cardiomyopathy patients and family members. Circ Cardiovasc Genet. 2015;8:437-46.
2. Marcus FI, Edson S, Towbin JA. Genetics of arrhythmogenic right ventricular cardiomyopathy: a practical guide for physicians. J Am Coll Cardiol. 2013;61:1945-8.
3. Quarta G, Muir A, Pantazis A, et al. Familial evaluation in arrhythmogenic right ventricular cardiomyopathy: impact of genetics and revised task force criteria. Circulation. 2011;123:2701-9.
4. te Riele AS, James CA, Groeneweg JA, et al. Approach to family screening in arrhythmogenic right ventricular dysplasia/cardiomyopathy. Eur Heart J. 2016;37:755-63.
5. Liu T, Pursnani A, Sharma UC, et al. Effect of the 2010 task force criteria on reclassification of cardiovascular magnetic resonance criteria for arrhythmogenic right ventricular cardiomyopathy. J Cardiovasc Magn Reson. 2014;16:47.
6. Marcus FI, McKenna WJ, Sherrill D, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the task force criteria. Circulation. 2010;121:1533-41.
7. te Riele AS, Bhonsale A, James CA, et al. Incremental value of cardiac magnetic resonance imaging in arrhythmic risk stratification of arrhythmogenic right ventricular dysplasia/cardiomyopathy-associated desmosomal mutation carriers. J Am Coll Cardiol. 2013;62:1761-9.
8. Vermes E, Strohm O, Otmani A, et al. Impact of the revision of arrhythmogenic right ventricular cardiomyopathy/dysplasia task force criteria on its prevalence by CMR criteria. JACC Cardiovasc Imag. 2011;4:282-7.
9. Bhonsale A, James CA, Tichnell C, et al. Incidence and predictors of implantable cardioverter-defibrillator therapy in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy undergoing implantable cardioverter-defibrillator implantation for primary prevention. J Am Coll Cardiol. 2011;58:1485-96.
10. Corrado D, Calkins H, Link MS, et al. Prophylactic implantable defibrillator in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia and no prior ventricular fibrillation or sustained ventricular tachycardia. Circulation. 2010;122:1144-52.
11. Corrado D, Wichter T, Link MS, et al. Treatment of arrhythmogenic right ventricular cardiomyopathy/dysplasia: an international task force consensus statement. Circulation. 2015;132:441-53.
12. Link MS, Laidlaw D, Polonsky B, et al. Ventricular arrhythmias in the North American multidisciplinary study of ARVC: predictors, characteristics, and treatment. J Am Coll Cardiol. 2014;64:119-25.
13. Piccini JP, Dalal D, Roguin A, et al. Predictors of appropriate implantable defibrillator therapies in patients with arrhythmogenic right ventricular dysplasia. Heart Rhythm. 2005;2:1188-94.
14. Marcus FI, Zareba W, Calkins H, et al. Arrhythmogenic right ventricular cardiomyopathy/dysplasia clinical presentation and diagnostic evaluation: results from the North American Multidisciplinary Study. Heart Rhythm. 2009;6:984-92.
15. Marcus GM, Glidden DV, Polonsky B, et al. Efficacy of antiarrhythmic drugs in arrhythmogenic right ventricular cardiomyopathy: a report from the North American ARVC Registry. J Am Coll Cardiol. 2009;54:609-15.
16. Corrado D, Basso C, Thiene G, et al. Spectrum of clinicopathologic manifestations of arrhythmogenic right ventricular cardiomyopathy/dysplasia: a multicenter study. J Am Coll Cardiol. 1997;30:1512-20.
17. James CA, Bhonsale A, Tichnell C, et al. Exercise increases age-related penetrance and arrhythmic risk in arrhythmogenic right ventricular dysplasia/cardiomyopathy-associated desmosomal mutation carriers. J Am Coll Cardiol. 2013;62:1290-7.
18. Ruwald AC, Marcus F, Estes NA 3rd, et al. Association of competitive and recreational sport participation with cardiac events in patients with arrhythmogenic right ventricular cardiomyopathy: results from the North American multidisciplinary study of arrhythmogenic right ventricular cardiomyopathy. Eur Heart J. 2015;36:1735-43.
19. Saberniak J, Hasselberg NE, Borgquist R, et al. Vigorous physical activity impairs myocardial function in patients with arrhythmogenic right ventricular cardiomyopathy and in mutation positive family members. Eur J Heart Fail. 2014;16:1337-44.
20. Sawant AC, Bhonsale A, te Riele AS, et al. Exercise has a disproportionate role in the pathogenesis of arrhythmogenic right ventricular dysplasia/cardiomyopathy in patients without desmosomal mutations. J Am Heart Assoc. 2014;3:e001471.
21. Sawant AC, te Riele AS, Tichnell C, et al. Safety of American Heart Association-recommended minimum exercise for desmosomal mutation carriers. Heart Rhythm. 2016;13:199-207.
22. Bhonsale A, Groeneweg JA, James CA, et al. Impact of kiểu gene on clinical course in arrhythmogenic right ventricular dysplasia/cardiomyopathy-associated mutation carriers. Eur Heart J. 2015;36:847-55.
23. Bhonsale A, James CA, Tichnell C, et al. Risk stratification in arrhythmogenic right ventricular dysplasia /cardiomyopathy-associated desmosomal mutation carriers. Circ Arrhythm Electrophysiol. 2013;6:569-78.
24. Hershberger RE, Lindenfeld J, Mestroni L, et al. Genetic evaluation of cardiomyopathy–a Heart Failure Society of America practice guideline. J Card Fail. 2009;15:83-97.
25. Kapplinger JD, Landstrom AP, Salisbury BA, et al. Distinguishing arrhythmogenic right ventricular cardiomyopathy/dysplasia-associated mutations from background genetic noise. J Am Coll Cardiol. 2011;57:2317-27.
26. Rigato I, Bauce B, Rampazzo A, et al. Compound and digenic heterozygosity predicts lifetime arrhythmic outcome and sudden cardiac death in desmosomal gene-related arrhythmogenic right ventricular cardiomyopathy. Circ Cardiovasc Genet. 2013;6:533-42.
27. Philips B, te Riele AS, Sawant A, et al. Outcomes and ventricular tachycardia recurrence characteristics after epicardial ablation of ventricular tachycardia in arrhythmogenic right ventricular dysplasia/cardiomyopathy. Heart Rhythm. 2015;12:716-25.
28. Philips B, Madhavan S, James C, et al. Outcomes of catheter ablation of ventricular tachycardia in arrhythmogenic right ventricular dysplasia/cardiomyopathy. Circ Arrhythm Electrophysiol. 2012;5:499-505.
29. Dalal D, Jain R, Tandri H, et al. Long-term efficacy of catheter ablation of ventricular tachycardia in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy. J Am Coll Cardiol. 2007;50:432-40.
30. Garcia FC, Bazan V, Zado ES, et al. Epicardial substrate and outcome with epicardial ablation of ventricular tachycardia in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Circulation. 2009;120:366-75.
31. Bai R, Di BL, Shivkumar K, et al. Ablation of ventricular arrhythmias in arrhythmogenic right ventricular dysplasia/cardiomyopathy: arrhythmia-free survival after endo-epicardial substrate based mapping and ablation. Circ Arrhythm Electrophysiol. 2011;4:478-85.
32. Berruezo A, Fernandez-Armenta J, Mont L, et al. Combined endocardial and epicardial catheter ablation in arrhythmogenic right ventricular dysplasia incorporating scar dechanneling technique. Circ Arrhythm Electrophysiol. 2012;5:111-21.
33. Santangeli P, Zado ES, Supple GE, et al. Long-term outcome with catheter ablation of ventricular tachycardia in patients with arrhythmogenic right ventricular cardiomyopathy. Circ Arrhythm Electrophysiol. 2015;8:1413-21.
34. Choudhary N, Tompkins C, Polonsky B, et al. Clinical Presentation and Outcomes by Sex in Arrhythmogenic Right Ventricular Cardiomyopathy: findings from the North American ARVC Registry. J Cardiovasc Electrophysiol. 2016;27:555-62.
35. Kamath GS, Zareba W, Delaney J, et al. Value of the signal-averaged electrocardiogram in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm. 2011;8:256-62.
36. Saguner AM, Medeiros-Domingo A, Schwyzer MA, et al. Usefulness of inducible ventricular tachycardia to predict long-term adverse outcomes in arrhythmogenic right ventricular cardiomyopathy. Am J Cardiol. 2013;111:250-7.
37. Sen-Chowdhry S, Syrris P, Prasad SK, et al. Left-dominant arrhythmogenic cardiomyopathy: an under-recognized clinical entity. J Am Coll Cardiol. 2008;52:2175-87.
38. Te Riele AS, James CA, Philips B, et al. Mutation-positive arrhythmogenic right ventricular dysplasia/cardiomyopathy: the triangle of dysplasia displaced. J Cardiovasc Electrophysiol. 2013;24:1311-20.
39. Rastegar N, Zimmerman SL, Te Riele AS, et al. Spectrum of biventricular involvement on cmr among carriers of arvd/c-associated mutations. JACC Cardiovasc Imag. 2015;8:863-4.
40. Sen-Chowdhry S, Syrris P, Ward D, et al. Clinical and genetic characterization of families with arrhythmogenic right ventricular dysplasia/cardiomyopathy provides novel insights into patterns of disease expression. Circulation. 2007;115:1710-20.
41. Dalal D, Nasir K, Bomma C, et al. Arrhythmogenic right ventricular dysplasia: a United States experience. Circulation. 2005;112:3823-32.
42. Brun F, Groeneweg JA, Gear K, et al. Risk stratification in arrhythmic right ventricular cardiomyopathy without implantable cardioverter-defibrillators. JACC Clin Electrophysiol. 2016;2:558-64.
43. Corrado D, Leoni L, Link MS, et al. Implantable cardioverter-defibrillator therapy for prevention of sudden death in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia. Circulation. 2003;108:3084-91.
44. van Rijsingen IA, Arbustini E, Elliott PM, et al. Risk factors for malignant ventricular arrhythmias in lamin A/C mutation carriers: a European cohort study. J Am Coll Cardiol. 2012;59:493-500.
45. Cox MG, van der Zwaag PA, van der Werf C, et al. Arrhythmogenic right ventricular dysplasia/cardiomyopathy: pathogenic desmosome mutations in index-patients predict outcome of family screening: Dutch arrhythmogenic right ventricular dysplasia/cardiomyopathy kiểu gene-kiểu hình follow-up study. Circulation. 2011;123:2690-700.
46. Saeed M, Homoud MK, Wang PJ, et al. Role of invasive electrophysiologic testing in risk stratification for sudden cardiac death. J Invasive Cardiol. 2001;13:758-62.
47. Zhu DW, Sun H, Hill R, et al. The value of electrophysiology study and prophylactic implantation of cardioverter defibrillator in patients with hypertrophic cardiomyopathy. Pacing Clin Electrophysiol. 1998;21:299-302.
48. Wichter T, Borggrefe M, Haverkamp W, et al. Efficacy of antiarrhythmic drugs in patients with arrhythmogenic right ventricular disease. Results in patients with inducible and noninducible ventricular tachycardia. Circulation. 1992;86:29-37.







