TÓM TẮT:
Ức chế DDP-4 (hay Glipitins) là loại thuốc viên hạ đường huyết thế hệ mới hiệu quả trong việc điều trị đái tháo đường typ 2. Các nghiên cứu về cơ chế và dữ liệu tiền lâm sàng chỉ ra hiệu quả trên mạch máu và tim, bằng cả hiệu ứng phụ thuộc GLP-1 và hiệu ứng độc lập GLP-1.
André J. Scheen
Nature Reviews Cardiology
Người dịch: BS Đặng Quý Đức khoa Nội tim mạch BVCR
Ức chế DDP-4 làm tăng nồng độ nhiều loại peptide có khả năng giãn mạch máu và bảo vệ tim mạch. Về mặt lâm sàng, ức chế DPP-4 cải thiện các yếu tố nguy cơ ở bệnh nhân đái tháo đường typ 2. Chúng cải thiện khả năng kiểm soát đường huyết (chủ yếu gây giảm đường huyết sau ăn), không gây tăng cân (hoặc giảm cân nhẹ), làm hạ huyết áp, cải thiện lipid máu sau ăn, làm giảm chất chỉ điểm viêm, loại bỏ quá trình oxy hóa do stress, và cải thiện chức năng nội mô. Một vài hiệu quả được mô tả ở bệnh nhân bệnh tim thiếu máu cục bộ, suy tim sung huyết, dù vậy các mối liên quan lâm sàng cần phải nghiên cứu thêm. Phân tích hậu kiểm (post –hoc) pha II-III, những thử nghiệm có đối chứng cho thấy khuynh hướng giảm tỷ lệ mới mắc biến cố tim mạch chính của Gliptins so với placebo hoặc hoạt chất khác. Tuy vậy, mối tương quan thật sự giữa lợi ích tim mạch và ức chế DPP-4 vẫn tiếp tục được chứng minh. Các thử nghiệm lâm sàng tiền cứu về mối liên hệ của ức chế DPP4 và các kết cục trên tim mạch vẫn đang được thực hiện ở bệnh nhân đái tháo đường typ 2 có nguy cơ tim mạch cao.
GIỚI THIỆU:
Đái tháo đường typ 2 làm tăng nguy cơ tim mạch cũng như tử vong. Tuy vậy, kiểm soát đường huyết nghiêm ngặt dường như cũng không cải thiện tử vong, các nghiên cứu lâm sàng ngẫu nhiên cũng chưa đủ dữ liệu chứng minh giảm các yếu tố nguy cơ ở những trường hợp tử vong do tim mạch và nhồi máu cơ tim không gây tử vong. Điều này là do tác dụng phụ của thuốc điều trị đái tháo đường typ 2 là tụt đường huyết và/hoặc tăng cân. Điều trị thuốc ở bệnh nhân đái tháo đường typ 2 quá cân/béo phì là một thử thách. Hơn thế nữa, những hậu quả trên tim mạch do kiểm soát đường huyết chặt chẽ còn phụ thuộc vào cơ chế hoạt động của các thuốc đái tháođường được sử dụng.
Ức chế DPP-4, hay thường gọi là Glipitins, là nhóm thuốc hạ đường huyết đầy hứa hẹn, mở ra một triển vọng mới trong việc điều trị đái tháo đường typ 2. Men DPP-4 thoái hóa incretin như glucagon like peptide 1(GLP-1), chất làm tụy tiết Insulin phụ thuộc với lượng đường. Các chất ức chế DPP-4 như Alogliptin, Linagliptin, Saxaglipitin, Sitaglipitin, và Vildaglipitin đã được đưa ra thị trường và những loại khác đang được phát triển. Các Glipitins này làm giảm đường huyết và HbA1c tương tự như các thuốc hạ đường huyết khác, nhưng ức chế DPP-4 còn có thêm một số lợi điểm. Hai lợi ích quan trọng đã được chứng minh trong các thử nghiệm lâm sàng và được khẳng định trong thực hành lâm sàng. Thứ nhất, nguy cơ hạ đường huyết không đáng kể, đặc biệt so với nhóm sulphonylureas. Thứ hai, không tăng cân, thậm chí giảm cân nhẹ so với Glinides, Sulphonylureas, Thiazolidinediones và Insulin. Những lợi điểm này đã được công bố năm 2012 trong việc quản lý đường huyết ở bệnh nhân đái tháo đường typ 2. Thêm vào đó, một lợi điểm quan trọng là ức chế DPP-4 làm tăng GLP-1, chất có tác động tích cực trên hệ thống tim mạch. Vì vậy, việc điều trị dựa trên incretin mở ra những quan niệm mới trong việc quản lý đái tháo đường typ 2: bảo vệ tim mạch trong nhóm có yếu tố nguy cơ cao. Nồng độ GLP-1 tăng ít hơn khi uống ức chế DPP-4 so với tiêm dưới da chất kích thích thụ thể GLP-1. Tuy nhiên, DPP-4 được cắt ra thành nhiều peptides có tác động trực tiếp trên mạch máu và tim mạch, nên hiệu quả tim mạch độc lập với GLP-1.
Điều trị dựa trên GLP-1 đã được đề cập trong tạp chí trước, và một số tạp chí khác. Nghiên cứu incretin đang được nhấn mạnh ở bệnh lý tim mạch và các yếu tố nguy cơ tim mạch. Trên thực tế, hiệu quả tim mạch của GLP-1 và kích thích thụ thể GLP-1 đã được tổng quan ở một vài bài báo, tương tự như ức chế DPP-4. Dựa trên tổng quan Cochrane, dữ liệu nghiên cứu trong thời gian dài, đặc biệt hiệu quả và mức độ an toàn trên tim mạch, việc sử dụng các thuốc này trở nên phổ biến.
Trong bài viết này, các đánh giá được cập nhật về hiệu quả tim mạch của ức chế DPP-4 ở bệnh nhân đái tháo đường typ 2 bảng 1). Cơ chế hoạt động và các số liệu thực nghiệm ở bệnh nhân đái tháo đường đã được mô tả và hiệu quả của Gliptins trên yếu tố nguy cơ tim mạch sẽ được phân tích. Các số liệu sơ bộ được thống kê xác nhận ức chế DPP-4 có thể làm giảm các nguy cơ tim mạch. Cuối cùng, các nghiên cứu tiền cứu vẫn đang tiếp tục nhằm để đánh giá tính hiệu quả và sự an toàn ở bệnh nhân đái tháo đường typ 2 có nguy cơ tim mạch cao.
Bảng 1: HIỆU QUẢ TIM MẠCH CỦA ỨC CHẾ DPP-4
Vai trò của ức chế DPP-4 ngày càng được khẳng định. Dựa vào kết quả quan sát và thử nghiệm có đối chứng trong thực hành lâm sàng, ức chế DPP-4 cho thấy hiệu quả và an toàn ở bệnh nhân đái tháo đường typ 2. Ức chế DPP-4 có thể được sử dụng khởi đầu đơn trị liệu, hay đa trị liệu khi kết hợp với metformin, sulphonylurea, thiazolidinedione, thậm chí với Insulin (có/không có metformin). Vài nghiên cứu đã thể hiện hiệu quả của việc khởi trị Metformin và Gliptins so với Metformin đơn độc. Hiệu quả và tính an toàn trong việc giảm HbA1c, ít biến cố hạ đường huyết và không tăng cân nên được sử dụng trong thực hành lâm sàng. Mặc dù hiệu quả kiểm soát đường huyết lâu dài, nhưng ảnh hưởng tích cực trên chức năng tế bào βtụy vẫn đang được theo dõi.
HIỆU QUẢ TIM MẠCH CỦA DPP-4:
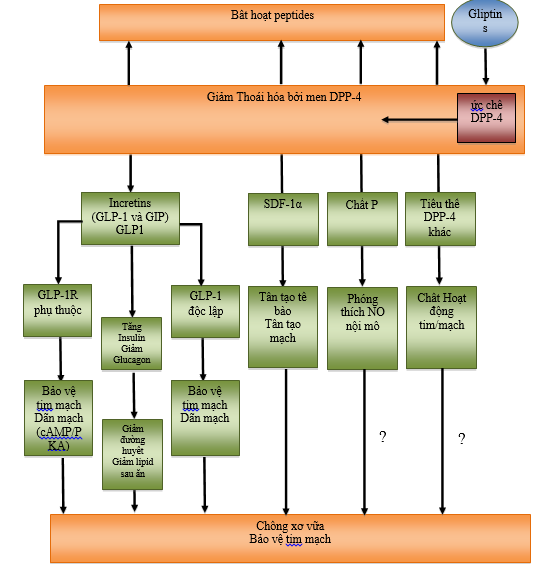
Liều trên sinh lý của GLP-1 thông thường chỉ được sử dụng trong nghiên cứu để tìm ra lợi ích của incretin trên tim và mạch máu. Bằng cách ngăn sự bất hoạt của GLP-1, chất được tiết tự nhiên trong bữa ăn, ức chế DPP-4 làm tăng nồng độ Gliptins trong khoảng sinh lý, điều này không có ảnh hưởng trên tim mạch giống như liều trên sinh lý. Thật vậy, nếu GLP-1 là có lợi cho tim, câu hỏi đặt ra là liệu ức chế DPP-4 có thể đem lại bất kì sự bảo vệ tim mạch nào thông qua việc tăng GLP-1 không, hay ức chế DPP-4 có lợi ích tim mạch độc lập với nồng độ GLP-1 (hình 1).
Ngoài sự hiện diện ở bạch cầu đơn nhân và lympho bào, DPP-4 còn có ở tế bào nội mô và tế bào cơ trơn. Vai trò sinh học thật sự của DPP-4 ở tế bào cơ tim, tế bào cơ trơn mạch vành, và tế bào nội mô cần phải nghiên cứu thêm. DPP-4 còn là một protein tuần hoàn, thông qua mạch máu hệ thống và hệ mạch vành, có thể ảnh hưởng tới nồng độ GLP-1 và các tiểu thể DPP-4 vận mạch khác ở cơ tim và mạch máu. GLP-1 được xem như một tiểu thể chính của DPP-4 có thể ảnh hưởng chức năng tim mạch, và thật sự DPP-4 được chia cắt ra các chuỗi peptids mà đa số chuỗi này có tác động trực tiếp lên tim và mạch máu. Hoạt tính của các tiểu thể DPP-4 đã được biết. Ví dụ: DPP-4 có thể bất hoạt BNP, GIP, NPY, SDF-1α, và chất P. Vì vậy, DPP-4 không chỉ là tác động của GLP-1, mà còn có nhiều tác động độc lập với GLP-1. Phần lớn các tiểu thể được xác định trong nghiên cứu in vitro, nhưng một vài trong số chúng có thể là chất nội sinh. Thông thường, nồng độ các tiểu thể của DPP-4 trong huyết tương thấp và khó địnhlượng nên khó hình dung được sự đóng góp của từng tiểu thể riêng biệt vào những biến đổi sinh học trên hệ tim mạch do sự ức chế DPP-4.
HÌNH 1: Cơ chế hiệu quả ức chế DPP-4 trên hệ tim mạch
QUAN SÁT THỰC NGHIỆM Ở ĐỘNG VẬT:
Kích thích thụ thể GLP-1 và ức chế DPP-4 đã được chứng minh bảo vệ đa yếu tố tim mạch trên mô hình rối loạn tim mạch tiền lâm sàng. Nghiên cứu từ mẫu bệnh động vật cho thấy lợi ích dãn mạch và bảo vệ tim mạch của GLP-1 (7-36) độc lập với thụ thể GLP-1 và được trung hòa từng phần bởi chất chuyển hóa của GLP-1 là GLP-1(9-36). Số liệu cho thấy GLP-1 chuyển hóa thành GLP-1 (9-36) và quá trình bị ức chế bởi DPP-4, điều này có thể tác động đến chức năng tim mạch mặc dù vẫn đang được đánh giá.
Một cơ chế hấp dẫn và đầy lý thú là GLP-1 tăng kích thích bạch cầu tủy xương SDF-1α. SDF-1α là một trong các tiểu thể của DPP-4, ức chế DPP-4 sẽ làm tăng nồng độ SDF-1α, nồng độ SDF-1α tăng làm kích thích tăng sinh tế bào nội mô thay thế tế bào nội mô bị tổn thương, vì vậy thúc đẩy sửa chữa mạch máu và tân tạo mạch (hình 1).
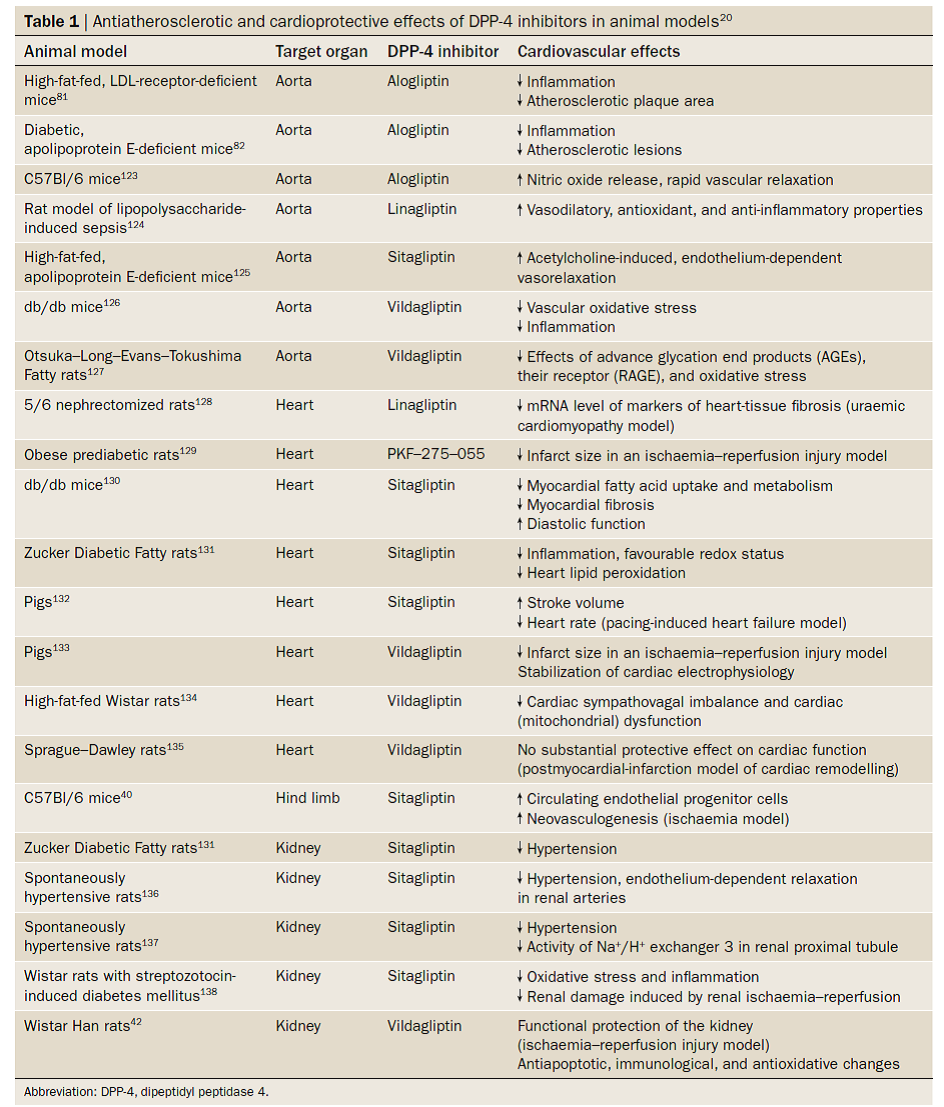
Tóm lại, các nghiên cứu tiền lâm sàng cho thấy sự bảo vệ tim mạch khi làm giảm dược tính của DPP-4 trên động vật có vú và loài gậm nhấm (bảng 1). Điều thú vị là ức chế DPP-4 luôn làm hạn chế tổn thương mô ở các thử nghiệm khác nhau gây thiếu máu ở các cơ quan quan trọng: tim, thận và chi sau. Gliptins hạn chế diện tích vùng nhồi máu cơ tim trong mô hình tổn thương cơ tim do tái tưới máu-thiếu máu cơ tim cục bộ, ít nhất một phần bằng cách tăng nồng độ AMP vòng trong nội bào và hoạt hóa protein độc lập với AMP vòng, một lợi ích hoàn toàn khác với các thuốc hạ đường huyết. Tuy có nhiều bằng chứng tiền lâm sàng hỗ trợ tính chất bảo vệ tim mạch của ức chế DPP-4 (và thậm chí nhiều hơn đối với kích thích thụ thể GLP-1), nhưng đa số các nghiên cứu được thực hiện trên động vật trẻ, khỏe mạnh không có tiền căn xơ vữa động mạch, đái tháo đường và bệnh lý tim mạch. Vì vậy, xác nhận các hiệu quả này có ở người vẫn đang được đòi hỏi chứng minh, đầu tiên là ở bệnh nhân đái tháo đường typ 2 có các yếu tố nguy cơ tim mạch, thứ hai là cho thấy giảm các biến chứng tim mạch ở bệnh nhân này khi được điều trị với ức chế DPP-4.
Bảng1: HIỆU QUẢ BẢO VỆ TIM MẠCH VÀ CHỐNG XƠ VỮA ĐỘNG MẠCH Ở ĐỘNG VẬT
HIỆU QUẢ TRÊN CÁC YẾU TỐ NGUY CƠ TIM MẠCH:
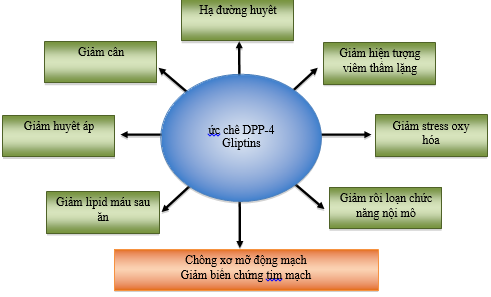
Ngoài hiệu quả hạ đường huyết mà không gây tăng cân, ức chế DPP-4 còn có hiệu quả chống xơ mỡ động mạch, giảm huyết áp tâm thu, hạ lipid máu sau ăn, giảm phản ứng viêm thầm lặng, giảm stress oxy hóa, cải thiện chức năng nội mô (hình 2, bảng 2). Tuy nhiên, hiệu quả lâu dài chống xơ vữa động mạch ở mức lâm sàng và dưới lâm sàng vẫn còn đang được nghiên cứu.
HÌNH 2: Hiệu quả của ức chế DPP-4 trên yếu tố nguy cơ tim mạch ở bệnh nhân đái tháo đường typ 2
Bảng2: ỨC CHẾ DPP-4 VÀ CÁC YẾU TỐ NGUY CƠ TIM MẠCH
|
Nguy cơ tim mạch |
Hiệu quả |
|
Đường huyết cao |
Giảm đường huyết lúc đói và sau ăn. Giảm HbA1c. |
|
Cân nặng |
Không tăng căn (hoặc giảm cân) |
|
Huyết áp |
Không ảnh hưởng (hoặc giảm) |
|
Lipid máu |
Giảm lipid máu sau ăn. Giảm nhẹ Cholesterol toàn phần. |
|
Phản ứng viêm yên lặng |
Giảm CRP, IL-6, IL-18. |
|
Stress Oxy hóa |
Giảm nồng độ Nitrotyrosine. |
|
Chức năng mội mô |
Cải thiện dãn mạch trung bình. |
|
Kết tập tiểu cầu |
Chống kết tập tiểu cầu. |
1.Kiểm soát đường huyết:
Ở một thử nghiệm ở bệnh nhân đái tháo đường typ 2 , ức chế DPP-4 giảm HbA1c có ý nghĩa 0,6% (95% CI 0,5-0,7%) so với giả dược sau 24 tuần. Hiệu quả tương tự khi dùng đơn trị liệu hay phối hợp với thuốc khác như Metformin. Không có sự khác biệt HbA1c giữa ức chế DPP-4 so với ức chế α-glucosidase , sulphonylureas, hoặc thiazolidinediones, trong khi Metformin giảm HbA1c hơn. DPP-4 giảm hiệu quả ở bệnh nhân lớn tuổi (≥ 60 tuổi) hoặc những bệnh nhân đường huyết lúc đói tăng nhẹ hoặc trung bình hơn là bệnh nhân trẻ hoặc bệnh nhân có mức đường huyết quá cao. Không có sự khác biệt trong việc giảm HbA1c giữa các nhóm ức chế DPP-4. Tuy nhiên, những so sánh đối đầu không nhiều. Ở một thử nghiệm 18 tuần trên bệnh nhân đái tháo đường typ 2 đang được điều trị với Metformin mà đường huyết vẫn chưa được kiểm soát thì phối hợp thêm saxagliptin 5mg/ngày hoặc sitagliptin 100mg/ngày cho thấy hiệu quả kiểm soát đường huyết như nhau.
Incretin đóng vai trò chính trong cân bằng đường huyết nội môi. Ví dụ như Vildagliptin làm giảm đường huyết sau ăn và lúc đói đáng kể. Nói chung, các nhóm ức chế DPP-4 thì giảm đường huyết sau ăn gấp đôi đường huyết lúc đói. Đặc điểm này chỉ có tính tương đốiởngười tăng đường huyết sau ăn do stress oxy hóa vàxơ vữa động mạch.
2.Cân nặng:
Phần lớn các bệnh nhân đái tháo đường typ 2 thừa cân hoặc béo phì tại thời điểm chẩn đoán, và béo phì là yếu tố nguy cơ bệnh đái tháo đường cũng như bệnh tim mạch. Hơn nữa, giảm cân giúp kiểm soát đường huyết tốt hơn ở bệnh nhân đái tháo đường typ 2, cũng như làm giảm nguy cơ bệnh tim mạch. Nhiều thuốc truyền thống điều trị đái tháo đường typ 2 (Glitazones, Insulin, Sulphonylureas, ngoại trừ Metformin) làm tăng cân và làm việc điều trị trở nên khó khăn. Hơn nữa việc tăng cân này gây cản trở việc kiểm soát đường huyết. Giảm đường huyết là mục tiêu chính trong điều trị đái tháo đường typ 2, và giảm cân là mục tiêu quan trọng thứ hai. Chiến lược này góp phần vào sự lựa chọn điều trị hiện nay.
Ức chế DPP-4 cải thiện việc kiểm soát đường huyết mà không gây tăng cân. Vì vậy, những thuốc này là một trong những lựa chọn quan trọng trong việc điều trị bệnh nhân đái tháo đường typ 2, mặc dù cơ chế chính xác không tăng cân vẫn còn được nghiên cứu thêm. Trong những bài phân tích tổng hợp và tổng quan có hệ thống, các nhà nghiên cứu đã lựa chọn 27 báo cáo của 19 nghiên cứu và phân ngẫu nhiên 7136 bệnh nhân điều trị với ức chế DPP-4 và 6745 bệnh nhân với thuốc hạ đường huyết thay thế khác. Bệnh nhân đang điều trị ức chế DPP-4 có cân nặng có lợi hơn so với bệnh nhân đang điều trị Sulphonylureas (sự khác biệt trung bình về cân nặng –1.92, 95% CI –2.34 to –1.49) hoặc pioglitazone (–2.96, 95% CI –4.13 to –1.78), nhưng không so sánh với những bệnh nhân đang sử dụng kích thích GLP-1. Trong một thử nghiệm mù đôi, đối đầu trực tiếp kéo dài 26 tuần (DURATION-4) cân nặng thay đổi ở bệnh nhân đái tháo đường typ 2 là –2.0 kg, –2.0 kg, +1.5 kg, và –0.8 kg với Exenatide (2 mg/tuần), Metformin (2,000 mg/ngày), Pioglitazone (45 mg/ngày), và Sitagliptin (100 mg/ngày). Những số liệu này được khẳng định lại ở nghiên cứu DURATION-2 ở bệnh nhân đang điều trị đái tháo đường typ 2 mà đường huyết chưa được kiểm soát bằng đơn trị liệu Metformin.
3.Huyết áp:
Các nghiên cứu tiền lâm sàng và lâm sàng về hiệu quả hạ huyết áp của incretin đã được ghi nhận trước đó. Nhìn chung, ức chế DPP-4 góp phần làm giảm huyết áp ở các nghiên cứu đối chứng-giả dược, ở pha II-III. Ở một vài nghiên cứu cho thấy giảm nhẹ đồng thời vừa cân nặng và huyết áp. Tuy nhiên Sitagliptin giảm nhẹ có ý nghĩa, 2-3mmHg, trong giai đoạn cấp và khi đo Holter huyết áp 24 giờ ở bệnh nhân tăng huyết áp trung bình đến nhẹ và không bị đái tháo đường typ 2.. Số liệu thực nghiệm cho thấy incretin có vai trò điều hòa Natri niệu vì vậy làm giảm huyết áp ở bệnh nhân tăng huyết áp nhạy cảm muối. Tuy nhiên, về mặt cơ chế có thể phức tạp hơn. Trên thực tế, một nghiên cứu thực nghiệm ở chuột cho thấy sự khác biệt giữa Exendin-4 (kích thích thụ thể GLP-1) và Alogliptin (ức chế DPP-4) về khả năng lợi niệu và tăng Natri niệu. Khi thiếu thụ thể GLP-1 Exendin-4 không có tác dụng ở chuột, trong khi đó tác dụng lợi niệu và bài tiết Natri niệu vẫn được duy trì do Alogliptin. Tuy nhiên, tác dụng tái hấp thu Natri và nước của Exendin-4 vẫn có ở chuột đái tháo đường typ 2 có béo phì, nên vẫn làm giảm nhẹ huyết áp.
4.Lipid máu:
Có nhiều thuốc điều trị bệnh đái tháo đường làm giảm mỡ trong máu, nên có hiệu quả ở bệnh nhân có yếu tố nguy cơ tim mạch. Incretin có ảnh hưởng đến chuyển hóa lipid sau ăn nên tác động tốt tới chức năng tim mạch và nội mô. Tăng cường kết nối thụ thể GLP-1 với ức chế DPP-4 làm giảm hấp thu Apolipoprotein B-48 giàu triglycerid. GLP-1 làm giảm sinh chylomicron sau ăn ở bệnh nhân đái tháo đường typ 2 do đáp ứng incretin suy giảm.
Ức chế DPP-4 cho thấy có ảnh hưởng đến nồng độ lipid sau ăn.. Điều trị Vildaglipitin làm giảm Triglycerid sau ăn và giảm chuyển hóa Apolipoprotein B-48. Trong một nghiên cứu thực nghiệm, Vildagliptin làm tăng lipid sau ăn và quá trình oxy hóa, nhờ kích thích giao cảm hơn là tác động trên chuyển hóa. Điều trị Alopiliptin (đơn trị hoặc phối hợp với Pioglitazone) làm giảm có ý nghĩa Triglycerid và Apolipoprotein B-48.
Cơ chế tác động tích cực của DPP-4 trên chuyển hóa lipid đặc biệt là giai đoạn sau ăn vẫn còn đang được tìm hiểu. Tuy nhiên, các nghiên cứu thực nghiệm với kích thích thụ thể GLP-1 và ức chế DPP-4, liều sinh lý hoặc cao hơn có thể làm giảm sản xuất Triglycerid ở ruột độc lâp với sự thay đổi cân nặng. Kết quả của một phân tích gộp thừa nhận tác động của ức chế DPP-4 trên nồng độ Cholerterol toàn phần và điều này góp phần giảm yếu tố nguy cơ tim mạch. Mặc dù có nhiều nghiên cứu và kéo dài (n=53), nhưng chỉ 17 nghiên cứu cung cấp số liệu về lipid máu (Cholesterol toàn phần, HDL, LDL và Triglycerid). Nồng độ Cholesterol toàn phần giảm có ý nghĩa giữa nhóm bệnh nhân điều trị với ức chế DPP-4 và nhóm chứng. Các số liệu đã cho thấy điều hòa incretin không chỉ trên chuyển hóa glucose mà còn trên chuyển hóa chylomicron và lipid máu sau ăn ở ruột. Tuy nhiên, chúng ta vẫn cần nhiều nghiên cứu hơn nữa để đánh giá hiệu quả điều trị rối loạn lipid máu bằng phương pháp dựa trên incretin.
5.Hiện tượng viêm:
Các nghiên cứu trên động vật cho thấy ức chế DPP-4 chống xơ vữa động mạch, làm giảm hiện tượng viêm bằng cách ức chế hoạt hóa bạch cầu đơn nhân (bảng 1), nhưng ở người vẫn cần được nghiên cứu thêm. Các nghiên cứu trong in vitro ở chuột cho thấy Aloglipitin ức chế quá trình điều hòa tăng toll-like receptor-4 và những cytokins tiền viêm khác bằng những tế bào đơn nhân.
Nồng độ CRP giảm như nhau ở nhóm bệnh nhân đái tháo đường typ 2 đang điều trị Sitagliptin hay Pioglitazone và Metformin.
Ở các bệnh nhân mà đường huyết chưa ổn định với Metformin, phối hợp ức chế DPP-4 làm giảm đường huyết cùng với giảm các chất đánh dấu viêm hệ thống. Tác động này rõ ràng hơn ở Vildagliptin (100mg/ngày) so với Sitagliptin (100mg/ngày). Vildagliptin (phối hợp Metformin) làm giảm chất chỉ điểm xơ vữa động mạch và adipokines (bao gồm adiponectin, CRP, IL-1β, IL-6, matrix metalloproteinase 9, và platelet reactivity) và điều này sẽ được kiểm tra trong thời gian tới ở bệnh nhân đái tháo đường typ 2I có xơ vữa động mạch.
6.Stress oxy hóa:
Trong bữa ăn, đường huyết và nồng độ 8-iso-prostaglandin F2αvà nitrotyrosine không thay đổi ở nhóm chứng, chất chỉ điểm stress oxy hóa tăng ở bệnh nhân đái tháo đường typ 2, mặc dù GLP-1 tăng ở cả 2 nhóm. Vildaglipitin làm giảm sự biến thiên đường huyết hàng ngày và tương quan có ý nghĩa với việc giảm nitrotyrosine. Tuy nhiên ở một nghiên cứu khác lại cho thấy không thay đổi stress oxy hóa ở bệnh nhân đang điều trị Metformin và được phối hợp thêm Sitagliptin hay Glibenclamide trong 3 tháng. Tương tự vậy, thay đổi không có ý nghĩa sự xơ cứng động mạch, huyết áp hoặc tình trạng viêm mặc dù vẫn kiểm soát được đường huyết, giảm Triglycerid và giảm cân.
7.Chức năng nội mô:
Rối loạn chức năng nội mô thường gặp ở bệnh nhân đái tháo đường typ 2 và được xem như là yếu tố nguy cơ tim mạch độc lập. Trong bữa ăn, GLP-1 đồng thời kích thích tiết insulin và kiểm soát stress oxy hóa (hiệu quả bảo vệ chức năng nội mô), nhưng dường như việc bảo vệ chức năng nội mô độc lập với lượng đường trong máu.
GLP-1 và chất tương tự GLP-1 có cải thiện chức năng nội mô và bảo vệ trực tiếp mạch máu. Truyền tĩnh mạch GLP-1 cải thiện chức năng nội mô ở bệnh nhân đái tháo đường typ 2 có bệnh mạch vành. Nồng độ GLP-1 do ức chế DPP-4 đủ để duy trì hiệu quả trên chức năng nội mô. Hơn nữa, một phát hiện thú vị ở động vật cho thấy GLP-1, các chất chuyển hóa của GLP-1 có đặc tính dãn mạch thông qua NO và GMP vòng chứ không thông qua thụ thể GLP-1. Mà ức chế DPP-4 làm giảm nồng độ GLP-1 nên đặc tính dãn mạch cần phải nghiên cứu thêm nhất là ở bệnh nhân đái tháo đường typ 2.
Ức chế DPP-4 làm tăng số lượng tế bào tiền nội mô thông qua cơ chế độc lập với thụ thể GLP-1 nên có lợi ích trên mạch máu. Trong một nghiên cứu ở bệnh nhân đái tháo đường typ 2 được điều trị với Vildagliptin trong 4 tuần cho thấy dãn mạch (không liên quan đến nội mô) tốt hơn ở bệnh nhân điều trị với acarbose (thuộc nhóm α-glucosidase làm giảm đường huyết sau ăn).
8.Hoạt hóa tiểu cầu:
Sitagliptin đã được chứng minh là chống kết tập tiểu cầu ở người bình thường và cả bệnh nhân đái tháo đường typ 2. Khả năng chống kết tập tiểu cầu là do tác động vào Calci tự do trong nội bào và tyrosin phospholyration. Quan sát này cần được nghiên cứu sâu hơn, và thử nghiệm với các ức chế DPP-4 khác trước khi suy đoán tương quan lâm sàng.
HIỆU QUẢ TRÊN CHỨC NĂNG TIM NGƯỜI:
Bệnh tim thiếu máu cục bộ:các bằng chứng thực nghiệm ở động vật và vài nghiên cứu thí điểm ở bệnh nhân bệnh tim thiếu máu cục bộ cho thấy kích thích thụ thể GLP-1 và ức chế DPP-4 bảo vệ tế bào cơ tim và cải thiện chức năng cơ tim do thiếu máu cục bộ, độc lập với hiệu quả hạ đường huyết. Tuy nhiên các nghiên cứu trong thời gian ngắn chưa cho thấy hiệu quả của GLP-1 trên chức năng tim ở bệnh nhân thiếu máu cơ tim cục bộ.
Sau nhồi máu cơ tim, bệnh nhân được điều trị bằng tế bào gốc thông qua sự tương tác giữa SDF-1αvà thụ thể C–X–C chemokine receptor type 4. Các nghiên cứu tiền lâm sàng cho thấy việc điều trị bằng tế bào gốc dựa trên yếu tố kích thích bạch cầu hạt cùng với ức chế DPP-4 nội sinh hoặc ngoại sinh sau nhồi máu cơ tim cải thiện tình trạng phát triển tự nhiên của tế bào gốc, chức năng tim, và tăng sự sống còn của bệnh nhân. Các kết quả ban đầu ở bệnh nhân nhồi máu cơ tim cho thấy kích thích DPP-4 làm giảm sự di chuyển của tế bào đơn nhân đến SDF-1 và không ảnh hưởng chức năng tim sau nhồi máu cơ tim.
Suy tim
Điều trị dựa trên incretin có thể là một chiến lược điều trị mới cho bệnh nhân đái tháo đường typ 2 có suy tim bởi vì tính chất bảo vệ tim mạch hoàn toàn độc lập với hiệu quả kiểm soát đường huyết. Các nghiên cứu lâm sàng nhỏ cho thấy GLP-1 cải thiện phân suất tống máu, giảm nồng độ BNP máu, và cải thiện chức năng tim thông qua test đi bộ ở bệnh nhân suy tim mạn. Các nghiên cứu ngẫu nhiên có kiểm soát đang xác định các lợi điểm của hệ thống incretin ở bệnh nhân đái tháo đường typ 2 có suy tim. Tuy nhiên dữ liệu cho thấy ức chế DPP-4 thay đổi chức năng thất ở bệnh nhân suy tim vẫn còn giới hạn. Vì vậy, ức chế DPP-4 ảnh hưởng trực tiếp đến tình trạng suy tim hoặc làm giảm kích thước vùng nhồi máu vẫn cần nghiên cứu thêm.
DPP-4 cắt hai N-terminal amino acids khỏi BNP (1-32) tạo thành BNP (3-32), chất hiện diện trong máu bệnh nhân suy tim sung huyết. Tác dụng sinh học (lợi tiểu, lợi niệu và dãn mạch) của BNP (3-32) yếu hơn so với BNP (1-32). Các nghiên cứu về cần sau xem xét ức chế DPP-4 làm tăng hiệu quả sinh học của BNP (1-32) như trì hoãn sự tiến triển của suy tim và việc truyền BNP ngoại sinh là cần thiết hay không.
HIỆU QUẢ TRÊN TIM MẠCH:
Phân tích hồi cứu ở các thử nghiệm pha II-III:
FDA bắt buộc tất cả các thuốc hạ đường huyết phải đánh giá độ an toàn tim mạch trước khi đưa ra thị trường. Các hướng dẫn điều trị mới như điều trị dựa trên incretin, đặc biệt là điều trị ức chế DPP-4, nhằm mục tiêu tim mạch hơn là kiểm soát đường huyết. Độ an toàn tim mạch được thẩm định thông qua các báo cáo chính thức về tác dụng phụ ở các thử nghiệm pha II-III.
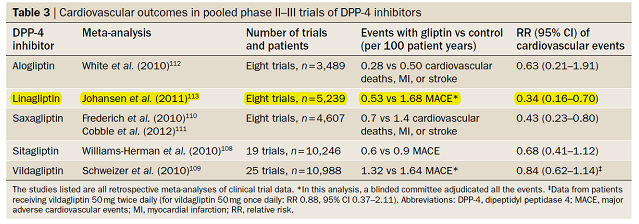
Trong một phân tích tổng hợp 41 nghiên cứu ngẫu nhiên có kiểm soát, Mantel–Haenszel odds ratio của các biến cố tim mạch và tử vong chung của ức chế DPP-4 là 0.76 (95% CI 0.46–1.28) and 0.78 (95% CI 0.40–1.51). Trong một phân tích tổng hợp tiếp theo, 53 thử nghiệm ngẫu nhiên ở bệnh nhân đái tháo đường typ 2(n=20312) được điều trị ức chế DPP-4 so sánh với giả dược hoặc nhóm chứng khác (n=13560) trong 24 tuần cho thấy ức chế DPP-4 giảm 31% các biến cố tim mạch (OR 0.69, 95% CI 0.53–0.90, P = 0.006). Ở một thử nghiệm theo dõi trong 2 năm cho thấy Linagliptin giảm đáng kể các biến cố tim mạch (nguy cơ tương đối 0.46, 95% CI 0.23–0.91, P = 0.0213) so với Glymepiride.
Các thử nghiệm tiền cứu về tim mạch:
Cần phải thiết kết đặc biệt các nghiên cứu ngẫu nhiên, có đối chứng với giả dược với cỡ mẫu lớn để xem Gliptin có thật sự làm giảm các biến cố tim mạch. Một vài nghiên cứu tiền cứu vẫn còn đang tiếp tục để chứng minh sự an toàn tim mạch, giảm các biến cố tim mạch của ức chế DPP-4 ở bệnh nhân đái tháo đường typ 2 có nguy cơ tim mạch cao (bảng 4). Trong tất cả các thử nghiệm, ức chế DPP-4 đều được so sánh với giả dược ngoại trừ nghiên cứu CAROLINA là so sánh Linagliptin với Glimepiride. Hơn nữa, tất cả các thử nghiệm đều ở bệnh nhân đái tháo đường typ 2 ổn định có nguy cơ tim mạch cao, ngoại trừ nghiên cứu EXAMINE là nghiên cứu Aloglipitin ở bệnh nhân có hội chứng mạch vành cấp.
BẢNG 4: Các thử nghiệm lâm sàng tiền cứu đang tiến hành
|
Ức chế DPP-4 |
Nghiên cứu |
Thiết kế nghiên cứu |
Tiêu chuẩn chọn mẫu |
Tiêu chí chính |
|
Alogliptin |
EXAMINE |
n = 5400 6,25-12,5-25mg với giả dược |
HbA1c = 6,5-11% Hội chứng mạch vành cấp ngày 15-90 trước khi phân ngẫu nhiên |
Thời gian đến khi xuất hiện Biến cố tim mạch chính: nhồi máu, đột quị không tử vong hoặc tử vong do tim mạch. |
|
Linagliptin |
CAROLINE |
n =6000 5mg với Glimepiride 1-4mg |
HbA1c = 6,5%-8,5% Nguy cơ tim mạch cao |
Thời gian đến khi xuất hiện Biến cố tim mạch chính: nhồi máu, đột quị không tử vong, đau thắt ngực không ổn định hoặc tử vong do tim mạch |
|
Saxagliptin |
SAVOR-TIMI 53 |
n = 16500 2,5-5mg với giả dược |
HbA1c > 6,5% Nguy cơ tim mạch cao |
Thời gian đến khi xuất hiện Biến cố tim mạch chính: nhồi máu, đột quị không tử vong hoặc tử vong do tim mạch |
|
Sitagliptin |
TECOS |
n = 14000 50-100mg với giả dược |
HbA1c = 6,5%-8% Tiền sử bệnh tim mạch |
Thời gian đến khi xuất hiện Biến cố tim mạch chính: nhồi máu, đột quị không tử vong, hoặc đau thắt ngực không ổn định |
KẾT LUẬN:
Ứng dụng điều trị incretin trong thực hành lâm sàng đem lại hiệu quả cho bệnh nhân đái tháo đường typ 2, thậm chí làm giảm các biến chứng tim mạch. Vài nghiên cứu đã chứng minh tính hiệu quả của ức chế DPP-4 trong kiểm soát đường huyết mà không gây tụt đường huyết quá mức và tăng cân. Ức chế DPP-4 không chỉ chống thoái hóa GIP và GLP-1 mà còn tạo các peptids có khả năng bảo vệ tim và hoạt hóa mạch. Những hiệu quả khác trên tim mạch: hạ huyết áp, chống oxy hóa, phản ứng viêm thầm lặng, và rối loạn chức năng nội mô cũng được ghi nhận ở bệnh nhân đái tháo đường typ 2. Phân tích Post hoc ở pha II-III, các thử nghiệm có đối chứng thừa nhận hiệu quả bảo vệ tim mạch của Gliptins so với giả dược, hoặc các nhóm chứng khác. Cũng như các nhóm khác, hiệu quả và tác dụng phụ của Gliptins cũng được ghi nhận cho tới khi hoàn thành các nghiên cứu lâm sàng. Các thử nghiệm tiền cứu lớn của ức chế DPP-4 so với giả dược (hoặc Glimepiride) ở bệnh nhân đái tháo đường typ 2 có nguy cơ tim mạch cao vẫn đang tiếp tục. Tóm lại, các thử nghiệm giúp góp phần nâng cao sự hiểu biết của cộng đồng y khoa về các lợi ích và nguy cơ tim mạch và không tim mạch của loại thuốc hạ đường huyết này.
KEY POINTS:
Ức chế DPP-4 có vai trò kiểm soát đường huyết ở bệnh nhân đái tháo đường typ 2 nhưng không làm tụt đường huyết quá mức và/hoặc tăng cân.
Gliptins không chỉ làm tăng lượng GLP-1 mà còn làm tăng các peptids khác nên có hiệu quả bảo vệ tim mạch.
Với đa tác động ở bệnh nhân đái tháo đường typ 2, Gliptins tạo những hiệu quả trên đường huyết sau ăn, mỡ trong máu, áp lực máu, phản ứng viêm thầm lặng, stress oxy hóa và chức năng nội mô.
Phân tích Post-hoc ở pha II-III, thử nghiệm có đối chứng Glipstins không những không gây tổn thương tim mạch so với giả dược hoặc các thuốc hạ đường huyết khác, mà còn được chỉ định để bảo vệ tim mạch.
Các thử nghiệm tiền cứu trên 40000 bệnh nhân đái tháo đường nguy cơ cao vẫn đang được tiếp tục nhằm kiểm tra tính ưu việt của gliptins trong việc bảo vệ tim mạch.
Tài liệu tham khảo:
1.Seshasai, S. R. et al. Diabetes mellitus, fasting glucose, and risk of cause-specific death. N. Engl. J. Med. 364, 829–841 (2011).
2. Hemmingsen, B. et al. Intensive glycaemic control for patients with type 2 diabetes: systematic review with meta-analysis and trial sequential analysis of randomised clinical trials. BMJ 343, d6898 (2011).
3. Scheen, A. J. Current management strategies for coexisting diabetes mellitus and obesity. Drugs 63, 1165–1184 (2003).
4. Niswender, K. Diabetes and obesity: therapeutic targeting and risk reduction—a complex interplay. Diabetes Obes. Metab. 12, 267–287 (2010).
5. Ovalle, F. Cardiovascular implications of antihyperglycemic therapies for type 2 diabetes. Clin. Ther. 33, 393–407 (2011).
6. Scheen, A. J. A review of gliptins in 2011. Expert Opin. Pharmacother. 13, 81–99 (2012).
7. Scott, L. J. Alogliptin: a review of its use in the management of type 2 diabetes mellitus. Drugs 70, 2051–2072 (2010).
8. Scott, L. J. Linagliptin: in type 2 diabetes mellitus. Drugs 71, 611–624 (2011).
9. Yang, L. P. Saxagliptin: a review of its use as combination therapy in the management of type 2 diabetes mellitus in the EU. Drugs 72, 229–248 (2012).
10. Dhillon, S. Sitagliptin: a review of its use in the management of type 2 diabetes mellitus. Drugs 70, 489–512 (2010).
11. Keating, G. M. Vildagliptin: a review of its use in type 2 diabetes mellitus. Drugs 70, 2089–2112 (2010).
12. Scheen, A. J. DPP-4 inhibitors in the management of type 2 diabetes: a critical review of head-to-head trials. Diabetes Metab. 38, 89–101 (2012).
13. Phung, O. J., Scholle, J. M., Talwar, M. & Coleman, C. I. Effect of noninsulin antidiabetic drugs added to metformin therapy on glycemic control, weight gain, and hypoglycemia in type 2 diabetes. JAMA 303, 1410–1418 (2010).
14. Gooßen, K. & Gräber, S. Longer term safety of dipeptidyl peptidase-4 inhibitors in patients with type 2 diabetes mellitus: systematic review and meta-analysis. Diabetes Obes. Metab. 14, 1061–1072 (2012).
15. Liu, S. C., Tu, Y. K., Chien, M. N. & Chien, K. L. Effect of antidiabetic agents added to metformin on glycaemic control, hypoglycaemia and weight change in patients with type 2 diabetes: a network meta-analysis. Diabetes Obes. Metab. 14, 810–820 (2012).
16. Amiel, S. A., Dixon, T., Mann, R. & Jameson, K. Hypoglycaemia in type 2 diabetes. Diabet. Med. 25, 245–254 (2008).
17. Karagiannis, T., Paschos, P., Paletas, K., Matthews, D. R. & Tsapas, A. Dipeptidyl peptidase-4 inhibitors for treatment of type 2 diabetes mellitus in the clinical setting: systematic review and meta-analysis. BMJ 344, e1369 (2012).
18. Hermansen, K. & Mortensen, L. S. Bodyweight changes associated with antihyperglycaemic agents in type 2 diabetes mellitus. Drug Saf. 30, 1127–1142 (2007).
19. Inzucchi, S. E. et al. Management of hyperglycaemia in type 2 diabetes: a patientcentered approach. Position statement of the American Diabetes Association (ADA) and the
European Association for the Study of Diabetes (EASD). Diabetologia 55, 1577–1596 (2012).
20. Ussher, J. R. & Drucker, D. J. Cardiovascular biology of the incretin system. Endocr. Rev. 33, 187–215 (2012).
21. Grieve, D. J., Cassidy, R. S. & Green, B. D. Emerging cardiovascular actions of the incretin hormone glucagon-like peptide-1: potential therapeutic benefits beyond glycaemic control?
Br. J. Pharmacol. 157, 1340–1351 (2009).
22. Ban, K., Hui, S., Drucker, D. J. & Husain, M. Cardiovascular consequences of drugs used for the treatment of diabetes: potential promise of incretin-based therapies. J. Am. Soc. Hypertens. 3, 245–259 (2009).
23. Chrysant, S. G. & Chrysant, G. S. Clinical implications of cardiovascular preventing pleiotropic effects of dipeptidyl peptidase-4 inhibitors. Am. J. Cardiol. 109, 1681–1685 (2012).
24. Drucker, D. J. & Nauck, M. A. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes. Lancet 368, 1696–1705 (2006).
25. Sivertsen, J., Rosenmeier, J., Holst, J. J. & Vilsbøll, T. The effect of glucagon-like peptide 1 on cardiovascular risk. Nat. Rev. Cardiol. 9, 209–222 (2012).
26. Monami, M. et al. Glucagon-like peptide-1 receptor agonists and cardiovascular events: a meta-analysis of randomized clinical trials. Exp. Diabetes Res. 2011, 215764 (2011).
27. Mundil, D., Cameron-Vendrig, A. & Husain, M. GLP-1 receptor agonists: a clinical perspective on cardiovascular effects. Diab. Vasc. Dis. Res. 9, 95–108 (2012).
28. Jose, T. & Inzucchi, S. E. Cardiovascular effects of the DPP-4 inhibitors. Diab. Vasc. Dis. Res. 9, 109–116 (2012).
29. Richter, B., Bandeira-Echtler, E., Bergerhoff, K. & Lerch, C. L. Dipeptidyl peptidase-4 (DPP-4) inhibitors for type 2 diabetes mellitus. Cochrane Database of Systematic Reviews, Issue 1. Art. No.: CD006739 doi:10.1002/ 14651858.CD006739.pub2 (2008).
30. Murohara, T. Dipeptidyl peptidase-4 inhibitor: another player for cardiovascular protection. J. Am. Coll. Cardiol. 59, 277–279 (2012).
31. Palmieri, F. E. & Ward, P. E. Dipeptidyl(amino) peptidase IV and post proline cleaving enzyme in cultured endothelial and smooth muscle cells. Adv. Exp. Med. Biol. 247A, 305–311 (1989).
32. Kirby, M., Yu, D. M., OConnor, S. & Gorrell, M. D. Inhibitor selectivity in the clinical application of dipeptidyl peptidase-4 inhibition. Clin. Sci. (Lond.)
118, 31–41 (2010).
33. Brandt, I. et al. Dipeptidyl-peptidase IV converts intact B-type natriuretic peptide into its des-SerPro form. Clin. Chem. 52, 82–87 (2006).
34. Mentlein, R., Gallwitz, B. & Schmidt, W. E. Dipeptidyl-peptidase IV hydrolyses gastric inhibitory polypeptide, glucagon-like peptide-1(7–36)amide, peptide histidine methionine and is responsible for their degradation in human serum. Eur. J. Biochem. 214, 829–835 (1993).
35. Mentlein, R., Dahms, P., Grandt, D. & Kruger, R. Proteolytic processing of neuropeptide Y and peptide YY by dipeptidyl peptidase IV. Regul. Pept. 49, 133–144 (1993).
36. Zaruba, M. M. et al. Synergy between CD26/ DPP-IV inhibition and G-CSF improves cardiac function after acute myocardial infarction. Cell Stem Cell 4, 313–323 (2009).
37. Wang, L. H. et al. Differential processing of substance P and neurokinin A by plasma dipeptidyl(amino)peptidase IV, aminopeptidase M and angiotensin converting enzyme. Peptides 12, 1357–1364 (1991).
38. Ban, K. et al. Cardioprotective and vasodilatory actions of glucagon-like peptide 1 receptor are mediated through both glucagon-like peptide 1 receptor-dependent and -independent pathways. Circulation 117, 2340–2350 (2008).
39. Fadini, G. P. et al. The oral dipeptidyl peptidase-4 inhibitor sitagliptin increases circulating endothelial progenitor cells in patients with type 2 diabetes: possible role of stromal-derived
factor-1á. Diabetes Care 33, 1607–1609 (2010).
40. Huang, C. Y. et al. Dipeptidyl peptidase-4 inhibitor improves neovascularization by increasing circulating endothelial progenitor cells. Br. J. Pharmacol. 167, 1506–1519 (2012).
41. Sauve, M. et al. Genetic deletion or pharmacological inhibition of dipeptidyl peptidase-4 improves cardiovascular outcomes after myocardial infarction in mice. Diabetes 59, 1063–1073 (2010).
42. Glorie, L. L. et al. DPP4 inhibition improves functional outcome after renal ischemia reperfusion injury. Am. J. Physiol. Renal Physiol. 303, F681–F688 (2012).
43. Ye, Y. et al. The myocardial infarct size-limiting effect of sitagliptin is PKA-dependent, whereas the protective effect of pioglitazone is partially dependent on PKA. Am. J. Physiol. Heart
Circ. Physiol. 298, H1454–H1465 (2010).
44. Ye, Y., Perez-Polo, J. R., Aguilar, D. & Birnbaum, Y. The potential effects of anti-diabetic medications on myocardial ischemia-reperfusion injury. Basic Res. Cardiol. 106, 925–952 (2011).
45. Rizzo, M., Rizvi, A. A., Spinas, G. A., Rini, G. B. & Berneis, K. Glucose lowering and antiatherogenic effects of incretin-based therapies: GLP-1 analogues and DPP-4-inhibitors. Expert Opin. Investig. Drugs 18, 1495–1503 (2009).
46. Monami, M., Iacomelli, I., Marchionni, N. & Mannucci, E. Dipeptidyl peptidase-4 inhibitors in type 2 diabetes: a meta-analysis of randomized clinical trials. Nutr. Metab. Cardiovasc. Dis. 20, 224–235 (2010).
47. Monami, M., Cremasco, F., Lamanna, C., Marchionni, N. & Mannucci, E. Predictors of response to dipeptidyl peptidase-4 inhibitors: evidence from randomized clinical trials. Diabetes Metab. Res. Rev. 27, 362–372 (2011).
48. Esposito, K. et al. Dipeptidyl peptidase-4 inhibitors and HbA1c target of <7% in type 2 diabetes: meta-analysis of randomized controlled trials. Diabetes Obes. Metab. 13, 594–603 (2011).
49. Fakhoury, W. K., Lereun, C. & Wright, D. A metaanalysis of placebo-controlled clinical trials assessing the efficacy and safety of incretinbased medications in patients with type 2
diabetes. Pharmacology 86, 44–57 (2010).
50. Scheen, A. J., Charpentier, G., Ostgren, C. J., Hellqvist, A. & Gause-Nilsson, I. Efficacy and safety of saxagliptin in combination with metformin compared with sitagliptin in combination with metformin in adult patients with type 2 diabetes mellitus. Diabetes Metab. Res. Rev. 26, 540–549 (2010).
51. Kim, W. & Egan, J. M. The role of incretins in glucose homeostasis and diabetes treatment. Pharmacol. Rev. 60, 470–512 (2008).
52. Pratley, R. E. et al. Robust improvements in fasting and prandial measures of â-cell function with vildagliptin in drug-naive patients: analysis of pooled vildagliptin monotherapy database. Diabetes Obes. Metab. 10, 931–938 (2008).
53. Baetta, R. & Corsini, A. Pharmacology of dipeptidyl peptidase-4 inhibitors: similarities and differences. Drugs 71, 1441–1467 (2011).
54. OKeefe, J. H. & Bell, D. S. Postprandial hyperglycemia/hyperlipidemia (postprandial dysmetabolism) is a cardiovascular risk factor. Am. J. Cardiol. 100, 899–904 (2007).
55. Bonora, E. Antidiabetic medications in overweight/obese patients with type 2 diabetes: drawbacks of current drugs and potential advantages of incretin-based treatment
on body weight. Int. J. Clin. Pract. Suppl. 154, 19–28 (2007).
56. Mitri, J. & Hamdy, O. Diabetes medications and body weight. Expert Opin. Drug Saf. 8, 573–584 (2009).
57. Tahrani, A. A., Bailey, C. J., Del Prato, S. & Barnett, A. H. Management of type 2 diabetes: new and future developments in treatment. Lancet 378, 182–197 (2011).
58. Barnett, A., Allsworth, J., Jameson, K. & Mann, R. A review of the effects of antihyperglycaemic agents on body weight: the potential of incretin targeted therapies. Curr. Med. Res. Opin. 23, 1493–1507 (2007).
59. Waters, S. B., Topp, B. G., Siler, S. Q. & Alexander, C. M. Treatment with sitagliptin or metformin does not increase body weight despite predicted reductions in urinary glucose
excretion. J. Diabetes Sci. Technol. 3, 68–82 (2009).
60. Foley, J. E. & Jordan, J. Weight neutrality with the DPP-4 inhibitor, vildagliptin: mechanistic basis and clinical experience. Vasc. Health Risk Manag. 6, 541–548 (2010).
61. Russell-Jones, D. et al. Efficacy and safety of exenatide once weekly versus metformin, pioglitazone, and sitagliptin used as monotherapy in drug-naive patients with type 2
diabetes (DURATION-4): a 26-week double-blind study. Diabetes Care 35, 252–258 (2012).
62. Bergenstal, R. M. et al. Efficacy and safety of exenatide once weekly versus sitagliptin or pioglitazone as an adjunct to metformin for treatment of type 2 diabetes (DURATION-2):
a randomised trial. Lancet 376, 431–439 (2010).
63. Horton, E. S., Silberman, C., Davis, K. L. & Berria, R. Weight loss, glycemic control, and changes in cardiovascular biomarkers in patients with type 2 diabetes receiving incretin
therapies or insulin in a large cohort database. Diabetes Care 33, 1759–1765 (2010).







