ThS. BS. TRẦN TIẾN ANH
Trung tâm Tim mạch BV Đại học Y Hà Nội
Tóm tắt
Thiếu máu cục bộ cơ tim có liên quan đến sự suy giảm dòng ATP và giảm nguồn cung cấp năng lượng, dẫn đến rối loạn cân bằng ion nội bào trong tế bào cơ tim. Trong những năm gần đây, sự gia tăng dòng natri muộn (late sodium current) được cho là có vai trò trong việc làm mất cân bằng ion bằng cách làm tăng nồng độ natri nội bào, kéo theo sự gia tăng nồng độ canxi nội bào.
Ranolazine, một loại thuốc chống thiếu máu cục bộ mới với cơ chế ức chế đặc hiệu dòng natri muộn, giúp giảm tình trạng quá tải natri và cải thiện sự cân bằng ion nội bào. Điều này có liên quan đến việc cải thiện triệu chứng đau thắt ngực ở bệnh nhân. Ngoài ra, Ranolazine còn cho thấy tác dụng chống loạn nhịp tim.
Trong bài báo này, chúng tôi sẽ phân tích các khái niệm sinh lý bệnh liên quan đến vai trò của việc ức chế dòng natri muộn và tóm lược các dữ liệu mới nhất từ các nghiên cứu cơ bản cũng như lâm sàng.
Phác đồ điều trị hiện tại
Theo hướng dẫn năm 2006 của Hiệp hội Tim mạch Châu Âu (ESC) [16], mục tiêu điều trị bệnh động mạch vành được chia thành: (1) giảm triệu chứng ngay lập tức trong ngắn hạn, (2) kiểm soát triệu chứng trong thời gian dài, và (3) cải thiện tiên lượng bệnh. Điều đáng chú ý là không có sự trùng lặp giữa các thuốc cải thiện tiên lượng và các thuốc giảm triệu chứng, ngoại trừ thuốc chẹn beta (β-blockers) sau nhồi máu cơ tim. Điều này cho thấy rằng thiếu máu cục bộ gây ra triệu chứng có thể không phải là cơ chế chính ảnh hưởng đến tiên lượng bệnh, trong khi các cơ chế tác động lên chức năng tiểu cầu, chống viêm hoặc các phản ứng cytokine-thần kinh-hormone có thể mang lại lợi ích cho sự sống còn của bệnh nhân.
Các phác đồ hiện tại nhằm giảm triệu chứng bằng thuốc tập trung vào việc cải thiện sự mất cân bằng giữa cung cấp oxy cho tim và nhu cầu oxy của cơ tim, yếu tố có liên quan trực tiếp đến thiếu máu cơ tim và đau thắt ngực [16]. Các nhóm thuốc trong danh mục này bao gồm: thuốc chẹn beta, thuốc chẹn kênh calci, nitrat, thuốc mở kênh kali, và thuốc ức chế nút xoang, tất cả đều giúp giảm nhu cầu oxy của cơ tim. Điều này có thể đạt được thông qua tác động trực tiếp lên cơ tim hoặc gián tiếp qua các ảnh hưởng phức tạp đến yếu tố huyết động [13]. Ngoài ra, các thuốc chẹn kênh calci, nitrat và thuốc mở kênh kali còn có khả năng cải thiện lưu lượng máu, từ đó tăng cường cung cấp oxy cho tim.
Ranolazine (Hình 1), một dẫn xuất của piperazine, là một thuốc chống thiếu máu cục bộ mới dùng để điều trị đau thắt ngực, có cơ chế tác dụng khác biệt so với các nguyên lý dược lý đã đề cập ở trên [3].
Sinh lý bệnh của thiếu máu cơ tim liên quan đến tác dụng của Ranolazine
Thiếu máu cơ tim ngay lập tức dẫn đến giảm lưu lượng ATP và nguồn cung cấp năng lượng đến các protein quan trọng trong chu kỳ co giãn của từng tế bào cơ tim. Các protein này bao gồm các yếu tố kiểm soát cân bằng ion nội bào trong tế bào cơ tim. Hệ quả là nồng độ ion natri và canxi nội bào bị rối loạn, góp phần gây tổn thương cơ tim sau thiếu máu.
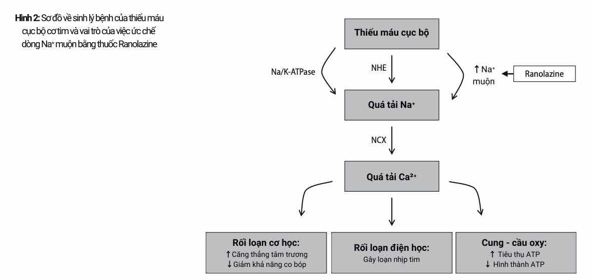
Có nhiều cơ chế khiến sự thiếu hụt năng lượng làm gia tăng nồng độ natri nội bào (Hình 2). Một lượng lớn natri xâm nhập vào tế bào qua kênh natri của tim trong giai đoạn khử cực ban đầu của điện thế hoạt động. Sự xâm nhập natri này làm tăng tốc quá trình khử cực, dẫn đến kích hoạt các kênh canxi điện áp loại L, gây ra dòng ion canxi đi vào tế bào. Các kênh natri sẽ tự động bất hoạt nhanh chóng trong vòng một đến ba mili-giây và tái chế để có thể được kích hoạt trở lại trong lần khử cực tiếp theo. Tuy nhiên, trong một số điều kiện bệnh lý như thiếu oxy, tiếp xúc với các chất chuyển hóa thiếu máu cục bộ và các gốc oxy phản ứng, kênh natri có thể duy trì trạng thái mở muộn trong vài trăm mili-giây sau khử cực, được gọi là dòng natri muộn (late INa, Hình 3). Dòng Natri muộn có thể là nguồn chính dẫn đến gia tăng nồng độ natri nội bào trong tình trạng thiếu máu cục bộ. Ngoài ra, sự mất cân bằng natri còn có thể do dòng natri đi vào thông qua bơm natri-proton hoặc do sự suy giảm hoạt động của bơm natri-kali ATPase.
Sự thiếu hụt năng lượng và giảm tiềm năng phosphoryl hóa làm suy giảm năng lượng tự do sẵn có để vận chuyển canxi vào lưới nội cơ tương, dẫn đến tích tụ canxi trong bào tương. Hệ quả là nồng độ canxi nội bào trong thì tâm trương tăng cao, kích hoạt các protein co bóp ngay cả khi tim đang trong giai đoạn giãn, gây ra rối loạn chức năng tâm trương. Sự tích tụ canxi trong lưới nội cơ tương bị trầm trọng hơn do nồng độ natri nội bào tăng cao, chủ yếu thông qua bộ trao đổi natri-canxi màng tế bào. Bộ trao đổi này hoạt động theo hai chiều: ở chế độ thuận, nó loại bỏ canxi ra khỏi tế bào để giúp giãn cơ tim trong thì tâm trương (bên cạnh cơ chế tái thu nhận canxi vào lưới nội cơ tương); ở chế độ nghịch (thường xảy ra trong điện thế hoạt động), nó đưa canxi vào tế bào để trao đổi với natri đi ra ngoài màng tế bào. Hoạt động và hướng vận chuyển này phụ thuộc vào mật độ protein, điện thế màng, nồng độ natri và canxi nội bào.
Tích lũy natri do thiếu oxy cơ tim (tức là qua kênh natri muộn) thúc đẩy chế độ nghịch của bộ trao đổi natri-canxi, làm giảm khả năng loại bỏ canxi khỏi bào tương. Điều này góp phần làm tăng nồng độ canxi nội bào trong thì tâm trương do suy giảm hoạt động của bơm canxi lưới nội cơ tương, từ đó làm trầm trọng hơn tình trạng rối loạn chức năng tâm trương do kích hoạt protein co bóp. Sự kích hoạt này còn tiêu tốn thêm năng lượng. Hơn nữa, tăng trương lực tâm trương làm tăng sức cản vi tuần hoàn và làm suy giảm hơn nữa sự cân bằng năng lượng của cơ tim bị thiếu máu cục bộ. Do đó, rối loạn chức năng tâm trương do thiếu máu cơ tim làm tăng tiêu hao năng lượng và làm trầm trọng hơn tình trạng mất cân bằng năng lượng theo một vòng xoắn bệnh lý.
Ranolazine đã được chứng minh là chất ức chế mạnh dòng natri muộn, do đó làm gián đoạn một bước quan trọng trong sinh lý bệnh của thiếu máu cơ tim.
Cơ chế hoạt động của Ranolazine
Trong tế bào cơ tim từ tim chó và tim chuột lang, Ranolazine được chứng minh có khả năng ức chế dòng natri muộn bằng cách phụ thuộc vào nồng độ, điện áp và tần số [1]. Ranolazine cũng đã được chứng minh có thể ngăn chặn sự gia tăng dòng natri muộn do H2O2 gây ra [25]. Đặc biệt, Ranolazine có tác dụng đảo ngược sự gia tăng kéo dài của nồng độ calci trong thì tâm trương và tâm thu do một chất kích thích late INa đã biết, độc tố hải quỳ ATX-II, gây ra [10, 26]. Tổng hợp lại, cơ chế chính của Ranolazine là ức chế dòng natri muộn, từ đó ngăn ngừa tình trạng quá tải natri trong tế bào. Kết quả là Ranolazine ngăn chặn quá trình trao đổi ngược natri-calci, qua đó hạn chế sự tích lũy calci trong thì tâm trương, có thể dẫn đến cải thiện độ giãn tâm trương [12, 27] và cải thiện lưu lượng máu mạch vành [10]. Theo đó, Ranolazine được chứng minh có tác dụng giảm co cứng cơ tim sau thiếu máu cục bộ ở tim thỏ khi được tưới máu cô lập và trải qua quá trình thiếu máu – tái tưới máu [11].
Là một chất ức chế dòng natri muộn, Ranolazine cũng được chứng minh có khả năng kéo dài thời gian điện thế hoạt động và do đó làm kéo dài khoảng QT một cách nhẹ nhàng từ 2–5 ms [5, 6]. Tuy nhiên, tác dụng này không phụ thuộc vào nhịp tim và không bị khuếch đại khi xảy ra nhịp chậm [2, 19, 32]. Hơn nữa, Ranolazine không gây khử cực sớm sau điện thế hoạt động và không làm tăng sự phân tán tái cực giữa các vùng của thành thất trái [2]. Dựa trên tác dụng này, Ranolazine không làm tăng nguy cơ nhịp nhanh xoắn đỉnh (Torsade de Pointes) như nhiều thuốc kéo dài khoảng QT khác.
Ảnh hưởng lâm sàng của Ranolazine
Ranolazine đã được nghiên cứu trong một số thử nghiệm lâm sàng. Ba thử nghiệm ban đầu đã đánh giá hiệu quả của Ranolazine giải phóng tức thì. Hai nghiên cứu giai đoạn ba có quy mô lớn hơn đã xem xét hiệu quả của Ranolazine giải phóng kéo dài ở bệnh nhân đau thắt ngực ổn định mạn tính.
MARISA (Monotherapy Assessment of Ranolazine In Stable Angina) đã phân ngẫu nhiên 191 bệnh nhân vào nhóm dùng giả dược hoặc Ranolazine theo thiết kế bắt chéo, với thời gian điều trị trong một tuần. CARISA (Combination Assessment of Ranolazine in Stable Angina) phân ngẫu nhiên bệnh nhân vào nhóm dùng giả dược hoặc Ranolazine kết hợp với liệu pháp điều trị đau thắt ngực trước đó, với thời gian điều trị duy trì trong 12 tuần.
Nghiên cứu MARISA cho thấy Ranolazine đơn trị liệu giúp cải thiện đáng kể khả năng gắng sức ở bệnh nhân đau thắt ngực ổn định. Cụ thể, thời gian gắng sức, thời gian xuất hiện cơn đau thắt ngực và thời gian đến khi xuất hiện đoạn ST chênh xuống 1mm đều được cải thiện. Đáng chú ý, 70% bệnh nhân trong nhóm giả dược phải dừng bài kiểm tra gắng sức do đau thắt ngực, trong khi tỷ lệ này ở nhóm Ranolazine (1,5g hai lần/ngày) chỉ là 52%.
Nghiên cứu CARISA cho thấy Ranolazine cải thiện thời gian gắng sức tối đa và tối thiểu, thời gian xuất hiện cơn đau thắt ngực và thời gian đến khi xuất hiện đoạn ST chênh xuống 1 mm. Những hiệu quả này được duy trì trong suốt 12 tuần điều trị. Ngoài ra, Ranolazine làm giảm số cơn đau thắt ngực từ mức trung bình 4,5 cơn/tuần xuống còn 2,1 cơn/tuần (với Ranolazine 1g hai lần/ngày), so với 3,3 cơn/tuần ở nhóm giả dược. Quan trọng nhất, tác dụng chống đau thắt ngực của Ranolazine trong cả hai nghiên cứu MARISA và CARISA không gây ra sự thay đổi đáng kể về mặt lâm sàng đối với nhịp tim hoặc huyết áp.
Trong nghiên cứu MERLIN (Metabolic Efficiency with Ranolazine for Less Ischemia in Non-ST Elevation Acute Coronary Syndrome) TIMI-36, tác động của Ranolazine đối với kết cục lâm sàng đã được nghiên cứu trên bệnh nhân hội chứng mạch vành cấp. MERLIN là một thử nghiệm lâm sàng đa quốc gia, mù đôi, có đối chứng với giả dược, thiết kế song song nhằm đánh giá hiệu quả và độ an toàn của Ranolazine trong điều trị cấp tính và dài hạn ở 6.560 bệnh nhân mắc hội chứng mạch vành cấp không ST chênh lên (NSTE-ACS) được điều trị bằng liệu pháp tiêu chuẩn. Trong vòng 48 giờ kể từ khi xuất hiện cơn đau thắt ngực do hội chứng mạch vành cấp, các bệnh nhân đủ điều kiện nhập viện đã được đưa vào nghiên cứu và phân ngẫu nhiên vào nhóm sử dụng Ranolazine đường tĩnh mạch hoặc giả dược, sau đó tiếp tục điều trị dài hạn bằng Ranolazine đường uống hoặc giả dược.
Mặc dù Ranolazine không ảnh hưởng đáng kể đến tiêu chí đánh giá chính (bao gồm tử vong do tim mạch, nhồi máu cơ tim hoặc thiếu máu cục bộ tái phát), các phân tích bổ sung cho thấy nguy cơ thiếu máu cục bộ tái phát giảm tương đối 13%. Hơn nữa, Ranolazine có hồ sơ an toàn tốt, đặc biệt là tiềm năng tác dụng chống loạn nhịp. Những phát hiện này củng cố dữ liệu thực nghiệm trước đó, cho thấy rằng việc ức chế dòng natri muộn (late INa) bằng Ranolazine là an toàn, đặc biệt là đối với các khía cạnh điện sinh lý tim.
Mặc dù kết quả từ nghiên cứu MERLIN không ủng hộ việc sử dụng Ranolazine trong điều trị hội chứng mạch vành cấp, nhưng chúng vẫn xác nhận tính an toàn và lợi ích của Ranolazine như một liệu pháp chống đau thắt ngực, đồng thời gợi ý rằng Ranolazine có thể mang lại lợi ích trong điều trị đau thắt ngực trên một nhóm bệnh nhân rộng hơn mắc bệnh tim thiếu máu cục bộ đã được xác định.
Triển vọng ứng dụng lâm sàng của Ranolazine
Việc ức chế dòng natri muộn tăng cường bằng Ranolazine có thể đại diện cho một phương pháp điều trị mới đối với các bệnh tim liên quan đến rối loạn cân bằng ion của cơ tim. Sự gia tăng nồng độ natri nội bào đã được quan sát thấy trong suy tim ở người và trong nhiều mô hình suy tim trên động vật. Gần đây, các nghiên cứu cho thấy rằng sự gia tăng natri nội bào trong suy tim có thể phần nào bắt nguồn từ quá trình phosphoryl hóa kênh natri phụ thuộc CaMKII, dẫn đến sự gia tăng dòng natri muộn. Do đó, Ranolazine có thể là một phương pháp tiếp cận tiềm năng để điều trị suy tim tâm thu bằng cách cải thiện sự mất cân bằng natri.
Hơn nữa, tình trạng quá tải calci thứ phát do rối loạn cân bằng natri có thể là một yếu tố bệnh sinh quan trọng trong suy tim tâm trương. Vì vậy, chúng tôi đưa ra giả thuyết rằng trong suy tim tâm trương liên quan đến rối loạn cân bằng natri/calci, Ranolazine có thể là một lựa chọn điều trị đầy hứa hẹn. Do đó, các nghiên cứu trên bệnh nhân suy tim có rối loạn chức năng tâm thu và tâm trương là cần thiết để đánh giá lợi ích điều trị tiềm năng của Ranolazine.
Tài liệu tham khảo
- Antzelevitch C, Belardinelli L, Zygmunt AC et al (2004) Electrophysiological effects of ranolazine, a novel antianginal agent with antiarrhythmic properties.Circulation 110:904–910
- Antzelevitch C, Belardinelli L, Zygmunt AC et al (2004) Electrophysiological effects of ranolazine, a novel antianginal agent with antiarrhythmic properties. Circulation 110:904–910
- Belardinelli L, Antzelevitch C, Fraser H (2004) Inhibition of late (sustained/ persistent) sodium current: a potential drug target to reduce intracellular sodium-dependent calcium overload and its detrimental effects on cardiomyocyte function. Europ Heart J 6(SupplI):13–17
- Burashnikov A, Di Diego JM, Zygmunt AC, Belardinelli L, Antzelevitch C (2007) Atrium-selective sodium channel block as a strategy for suppression of atrial fibrillation: differences in sodium channel inactivation between atria and ventricles and the role of ranolazine. Circulation. 116:1449–1457
- Chaitman BR, Pepine CJ, Parker JO et al (2004) Effects of ranolazine with atenolol, alodipine, or diltiazem on exercise tolerance and angina frequency in patients with severe chronic angina: a randomized controlled trial. J Am Med Assoc 291:309–316
- Chaitman BR, Skettino SL, Parker JO et al (2004) Anti-ischemic effects and long-term survivial during ranolazine monotherapy in patients with chronic severe angina. J Am Coll Cardiol 43:1375–1382
- Clanachan AS (2004) Assessment of Ranolazine’s Effects on Mechanical Function and [Ca2+]i Accumulation in Ejecting Rat Hearts (CVT Technical Report Number CVT303.093-P)
- Clancy CE, Kass RS (2002) Defective cardiac ion channels: from mutations to clinical syndromes. J Clin Invest 110:1075–1077
- Cocco G, Rousseau MF, Bouvy T et al (1992) Effects of a new mebatolic modulator, ranolazine on exercise tolerance in angina pectoris patients treated with beta-blocker or diltiazem. J Cardiovasc Pharmacol 20:131–138
- Fraser H, Belardinelli L, Wang L, Light PE, McVeigh JJ, Clanachan ASD (2006) Ranolazine decreases diastolic calcium accumulation caused by ATX-II or ischemia in rat hearts. J Mol Cell Cardiol 41:1031–1038
- Gralinski MR, Black SC, Kilgore KS et al (1994) Cardioprotective effects of ranolazine (RS-43285) in the isolated perfused rabbit heart. Cardiovasc Res 28:1231–1237
- Hayashida W, van Eyll C, Rousseau MF, Pouleur H (1994) Effects of ranolazine on left ventricular regional diastolic function in patients with ischemic heart disease. Cardiovasc Drugs Ther 8:741–747
- Heusch G, Schulz R (2001) Perfusioncontraction match and mismatch. Basic Res Cardiol 96:1–10
- Ju YK, Saint DA, Gage PW. (1996) Hypoxia increases persistent sodium current in rat ventricular myocytes. J Physiol 497(Pt2):337–347
- Maier LS, Hasenfuss G (2006) Role of [Na+]i and the emerging involvement of the late Na current (INa,late) in the pathophysiology of cardiovascular disease. Europ Heart J 8(Suppl A):A6–A9
- Messerli FH, Mancia G, Conti CR, Pepine CJ (2006) Eur Heart J 27(23):2902–2903
- Meyer M, Keweloh B, Guth K, Holmes JW, Pieske B, Lehnart SE, Just H, Hasenfuss G (1998) Frequency-dependence of myocardial energetics in failing human myocardium as quantified by a new method for the measurement of oxygen consumption in muscle strip preparations. J Mol Cell Cardiol 30(8):1459–1470 G. Hasenfuss and L.S. Maier 225 Late INa inhibition with ranolazine
- Morrow DA, Scirica BM, Karwatoswska-Prokopczuk E, Murphy SA, Budaj A, Varshavsky S, Wolff A, Skene A, McCabes CH, Braunwald E (2007) Effects of Ranolazine on recurrent
cardiovascular events in patients with non-ST-elevation acute coronary syndromes. The MERLIN-TIMI 36 Randomized Trial. JAMA 297(16):1775–1783
- Okada Y, Ogawa S, Sadanaga T et al (1996) Assessment of reverse usedependent
blocking actions of class III antiarrhythmic drugs by 24-h Holter electrocardiography. J Am Coll Cardiol 27:84–89
- Pepine CJ, Wolff AA (1999) A controlled trial with a novel anti-ischemic agent, ranolazine, in chronic stable angina pectoris that is responsive to conventional antianginal agents. Am J
Cardiol 84:46–50
- Pieske B, Maier LS, Piacentino V III, Weisser J, Hasenfuss G, Houser S (2002) Rate dependence of [Na+]i and contractility in nonfailing and failing human myocardium. Circulation 106:447–453
- Roden DM (2001) Cardiac membrane and action potentials. In: Spooner PM, Rosen MR et al. (eds) foundations of cardiac arrhythmias: basic concepts and clinical approaches. Marcel Dekker, New York, p. 21
- Rousseau MF, Visser FG, Bax JJ (1994) Ranolazine: antianginal therapy with a novel mechanism: placebor controlled comparison versus atenolol. Eur Heart J 15(Suppl):95
- Scirica BM, Morrow DA, Hod H, Murphy SA, Belardinelli L, Hedgepeth CM, Molhoek P, Verheugt FW, Gersh BJ, McCabe CH, Braunwald E (2007) Effect of Ranolazine, an Antianginal Agent With Novel Electrophysiological Properties, on the Incidence of Arrhythmias
in Patients With Non ST-Segment Elevation Acute Coronary Syndrome: Results From the Metabolic Efficiency With Ranolazine for Less Ischemia in Non ST-Elevation Acute Coronary
Syndrome Thrombolysis in Myocardial Infarction 36 (MERLIN-TIMI 36) Randomized Controlled Trial. Circulation 116(15):1647–1652
- Song Y, Shryock JC, Wagner S, Maier LS, Belardinelli L (2006) Blocking late sodium current reduces hydrogen peroxide-induced arrhythmogenic activity and contractile dysfunction. J Pharmacol Exp Ther 318:214–222
- Song Y, Shryock JC, Wu L et al (2004) Antagonism by ranolazine of the proarrhythmic effects of increasing late INa in guinea pig ventricular myocytes. J Cardiovasc Pharmacol 44:192–199
- Sossalla S, Rasenack ECL, Wagner S, Ruff H, Tenderich G, Hasenfuss G, Belardinelli L, Maier LS (2007) Inhibition of late sodium current by ranolazine improves diastolic dysfunction in human heart failure. Z Kardiol 96(Suppl 1):P837
- Undrovians AI, Fleidervish IA, Makielski JC (1992) Inward sodium current at resting potentials in single cardiac myocytes induced by the ischemic metabolite lysophosphatidylcholine. Circ Res 71:1231–1241
- Wagner S, Dybkova N, Rasenack ECL, Jacobshagen C, Fabritz L, Kirchhof P, Maier SKG, Zhang T, Hasenfuss G, Heller Brown J, Bers DM, Maier LS (2006) Ca/calmodulin-dependent protein kinase II regulates cardiac Na channels. J Clin Invest. 116:3127–3138
- Ward CA, Giles WR.(1997) Ionic mechanism of the effects of hydrogen peroxide in rat ventricular myocytes. J Physiol 500(Pt 3):631–642
- Wu J, Corr PB. (1994) Palmitoyl caritine modifies sodium currents and induces transient inward current in ventricular myocytes. Am J Physiol 266:H1034–H1046
- Wu L, Shryock JC, Song Y et al (2004) Antiarrhythmic effects of ranolazine in a guinea pig in vitro model of long-QT syndrome. J Pharmacol Exp Ther 310:599–605







