BS. NGUYỄN XUÂN VINH
BS. NGUYỄN THANH HIỀN
1. Mở đầu
Bệnh mạch vành (CAD – coronary artery disease) là bệnh tim mạch phổ biến nhất, gây tử vong lên đến 380,000 người trên thế giới năm 2020 [1]. Điều trị CAD bao gồm thay đổi lối sống, điều chỉnh các yếu tố nguy cơ, thuốc và các phương thức xâm lấn (phẫu thuật hay qua da), tùy thuộc vào triệu chứng, mức độ, hoặc biểu hiện lâm sàng của bệnh (cấp hay mạn). Gần đây đã có nhiều tiến bộ trong kỹ thuật chẩn đoán và điều trị bệnh mạch vành. Những kỹ thuật này bao gồm các đánh giá về mặt sinh lý của CAD, bổ sung vào các đánh giá về giải phẫu; các dấu ấn sinh học; và microRNAs giúp phát hiện CAD. Các loại thuốc mới giúp giảm biến cố tim mạch và những tiến bộ trong điều trị xâm lấn. Bên cạnh đó, sự hỗ trợ của robot, kỹ thuật nano, tế bào gốc, và in 3D cũng có ích trong quan sát rõ mức độ hẹp mạch vành. Bài trước chúng tôi đã đề cập đến những tiến bộ trong chẩn đoán CAD. Trong bài này, chúng tôi sẽ tóm lược y văn về những tiến bộ gần đây trong chiến lược điều trị CAD.
2. Điều trị truyền thống bệnh mạch vành mạn tính
Nền tảng trong điều trị những bệnh nhân CAD mạn tính là các liệu pháp kháng huyết khối dựa trên bằng chứng. Nếu bệnh nhân vẫn còn các triệu chứng đau thắt ngực hoặc tương đương đau thắt ngực (như khó thở hoặc đau cánh tay khi gắng sức) dù đã điều trị thích hợp, thì khuyến cáo nên được tiến hành hình ảnh học gắng sức hoặc chụp mạch vành xâm lấn. Nghiên cứu ISCHEMIA[2] phân ngẫu nhiên 5.179 bệnh nhân thiếu máu cục bộ trung bình – nặng trên hình ảnh học gắng sức vào nhóm điều trị nội khoa đơn độc hoặc điều trị nội khoa kèm điều trị xâm lấn (chụp mạch vành ± can thiệp nếu có thể). Kết quả nghiên cứu không ghi nhận khác biệt về kết cục tim mạch chính vào thời điểm 6 tháng và 5 năm. Những người được phân vào nhóm điều trị xâm lấn có tỉ lệ tử vong do tim mạch sau 7 năm thấp hơn (6,4% so với 8,6%; HR, 0,78; 95% CI, 0,63 – 0,96) nhưng có tỉ lệ tử vong không do tim mạch cao hơn (5,6% so với 4,4%; HR, 1,44; 95% CI, 1,08 – 1,91).
Phẫu thuật bắc cầu động mạch vành thêm vào điều trị nội khoa với mục tiêu cải thiện tỉ lệ tử vong được khuyến cáo mạnh ở nhóm bệnh nhân có bệnh lý thân chung hẹp ≥ 50% và những người có bệnh nhiều nhánh mạch vành với suy chức năng thất trái nặng (≤ 35%) [3,4].
Chế độ ăn Mediterranea, bao gồm trái cây, rau, đậu, hạt, ngũ cốc nguyên hạt, và protein ít béo (như cá) cũng được khuyến cáo để giảm biến cố tim mạch chính. Trong một nghiên cứu lâm sàng ngẫu nhiên gồm 1.002 bệnh nhân CAD, chế độ ăn Mediterranea vượt trội hơn chế độ ăn ít béo trong phòng ngừa biến cố tim mạch chính [5].
Statin cường độ cao cũng được khuyến cáo để giảm ít nhất 50% LDL-C ở những bệnh nhân CAD mạn. Ở những người có LDL-C > 70 mg/dL và đang dùng statin liều tối đa có thể dung nạp được, thì việc thêm ezetimibe có thể giảm biến cố tim mạch chính hơn nữa. Nếu LDL-C vẫn còn cao trên mục tiêu dù đã dùng statin liều tối đa và ezetimibe, thì nên cân nhắc thêm thuốc ức chế PCSK9, dựa trên nghiên cứu với evolocumab (dân số bệnh tim mạch do xơ vữa, khác biệt nguy cơ so với nhóm chứng là 1,5%) và alirocumab (dân số bệnh nhân hội chứng vành cấp gần đây, khác biệt nguy cơ so với nhóm chứng là 1,6%) [3]. Thuốc ức chế PCSK9 nên được cân nhắc ở những bệnh nhân có tiền sử có nhiều biến cố tim mạch do xơ vữa, hoặc ít nhất hai tình trạng nguy cơ cao (hội chứng vành cấp gần đây, tiền sử nhồi máu cơ tim hoặc nhồi máu não, bệnh động mạch ngoại biên) với một biến cố tim mạch do xơ vữa chính. Bempedoic acid và inclisiran cũng có thể được xem xét là thuốc thêm vào điều trị nền với statin.
Những bệnh nhân CAD mạn và đái tháo đường típ 2 nên được dùng hoặc ức chế SGLT2 hoặc đồng vận GLP1. Ở những bệnh nhân CAD mạn và hoặc đái tháo đường típ 2 hoặc suy tim, một phân tích ngẫu nhiên gồm 5 RCT (tổng 21.947 bệnh nhân) ghi nhận việc dùng ức chế SGLT2 làm giảm nguy cơ tử vong do CAD hoặc nhập viện vì suy tim (với NNT là 25; 95% CI: 20 – 31) và tử vong do mọi nguyên nhân (NNT là 92; 95% CI: 52 – 733) [6]. Trong một phân tích gộp gồm 8 RCT (tổng 60.080 bệnh nhân CAD và đái tháo đường típ 2), việc dùng đồng vận GLP1 so với nhóm chứng giúp làm giảm 14% nguy cơ biến cố tim mạch chính (HR, 0,86; 95% CI: 0,80 – 0,93) và giảm 12% nguy cơ tử vong do mọi nguyên nhân (HR, 0,88; 95% CI: 0,82 – 0,94) [7].
Những bệnh nhân CAD mạn có chỉ định phù hợp nên được tư vấn các chương trình phục hồi chức năng tim mạch, tại nhà hoặc tại các cơ sở phục hồi chức năng[8]. Tất cả những bệnh nhân bệnh tim mạch (Cardiovascular disease-CVD) nên giảm thời gian ngồi tại chỗ hàng ngày. Hiện khuyến cáo cho các bệnh nhân CVD là tập luyện thể lực trung bình ít nhất 150 phút/tuần hoặc tập thể dục nặng ít nhất 75 phút/tuần, kèm thêm ít nhất 2 lần tập kháng lực mỗi tuần. Những khuyến cáo này có thể làm giảm tử vong và biến chứng do tim mạch, cũng như giúp kiểm soát chặt chẽ triệu chứng hơn.
Hướng dẫn gần đây cũng khuyến cáo không dùng chẹn thụ beta dài hạn nếu bệnh nhân không có nhồi máu cơ tim trong năm vừa qua, phân suất tống máu thất trái không ≤ 50%, hoặc không có chỉ định nào khác để dùng chẹn beta như đau thắt ngực, tăng huyết áp không kiểm soát, hoặc rối loạn nhịp nhanh, vì việc dùng chẹn beta không làm giảm biến cố tim mạch so với nhóm bệnh nhân không dùng (HR, 0,96; 95% CI: 0,79 – 1,16) [9].
3. Các tiến bộ trong điều trị bằng thuốc ở bệnh mạch vành
Mục tiêu chính của điều trị CAD là làm giảm triệu chứng và ngăn ngừa biến chứng ở những bệnh nhân CAD ổn định và để cải thiện dòng máu cũng như hồi phục chức năng tim nhanh nhất có thể ở những bệnh nhân ACS [10], [11]. Thông thường, các mục tiêu này sẽ đạt được thông qua điều trị nội khoa tối ưu và cân nhắc tái tưới máu bằng PCI hoặc CABG. Điều trị nội khoa tối ưu bao gồm thuốc chẹn thụ thể beta, chẹn kênh calci, nitrate, ức chế men chuyển (ACEi) và statin cho bệnh nhân CAD ổn định, cũng như kháng kết tập tiểu cầu và tiêu sợi huyết ở bệnh nhân ACS.
Trong những năm gần đây, các chiến lược điều trị kháng tiểu cầu mới đã làm thay đổi cách quản lý CAD. Chiến lược kháng tiểu cầu kép với aspirin và một loại kháng P2Y12, gồm clopidogrel, prasugrel và ticagrelor, đã trở thành cách tiếp cận chính trong điều trị bệnh nhân sau PCI [12]. Những loại thuốc kháng tiểu cầu mạnh, đặc biệt là ticagrelor, đã cho thấy hiệu quả nổi trội trong cải thiện kết cục tim mạch chính cũng như hiệu quả sau đặt stent so với các liệu pháp điều trị truyền thống. Bên cạnh đó, chúng ta cũng có những tiến bộ trong điều trị giảm lipid máu. Việc phát triển thuốc ức chế proprotein convertase subtilisin/kexin kind 9 (PCSK9) là một bước đột phá, cung cấp thêm một lựa chọn hiệu quả để điều trị tăng cholesterol máu, đặc biệt ở những người đề kháng với statin hoặc có bệnh lý tăng cholesterol máu gia đình. Khi được thêm vào cùng với statin, ức chế PCSK9 sẽ làm giảm thêm nữa nồng độ LDL-C và biến cố tim mạch [13].
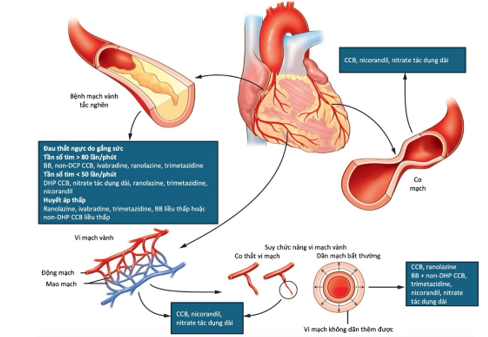
Hình 1. Các liệu pháp điều trị nhắm đến mục tiêu giảm đau thắt ngực do thiếu máu cục bộ cơ tim [14]
Với mục đích giảm đau thắt ngực, một số loại thuốc mới đã được đưa vào lâm sàng (Hình 1), trong đó có ranolazine. Với cơ chế tác dụng đặc trưng liên quan đến ức chế kênh natri muộn, ranolazine đã chứng minh được lợi ích trong làm giảm đau thắt ngực khi gắng sức và cải thiện được vận động thể lực. Chính lợi ích này đã giúp ranolazine trở thành một lựa chọn hợp lý để thêm vào các điều trị đau thắt ngực truyền thống. Bên cạnh đó, y học chính xác cũng đã có những bước tiến trong quản lý CAD, đưa vào lâm sàng việc cá thể hóa thuốc điều trị dựa trên thử nghiệm gen và phân nhóm nguy cơ. Việc điều chỉnh điều trị dùng thuốc dựa trên bản đồ gen và các yếu tố nguy cơ liên quan có thể cải thiện hiệu quả điều trị và làm giảm tối đa tác dụng phụ. Thành công của những hướng tiếp cận này đã đưa đến một thời đại mới trong cá thể hóa điều trị CAD [15,16].
Gần đây, đã có một số điều trị mới cho CAD được nghiên cứu trong các thử nghiệm lâm sàng ngẫu nhiên. Trong phần này, chúng tôi sẽ chỉ tập trung vào các điều trị mới này.
3.1. Đảo ngược vận chuyển cholesterol
Đảo ngược vận chuyển cholesterol là một thuật ngữ mô tả sự trào ra của choleterol nội bào quá mức ở các mô ngoại vi và trở về gan để tiết vào mật. Thúc đẩy sự thoát bào của cholesterol tại tế bào bọt bằng các phân tử HDL-C là bước đầu tiên của đảo ngược vận chuyển cholesterol. Đây là một tiến trình chống xơ vữa đầy tiềm năng [11].
Đến nay, các loại thuốc làm tăng nồng độ HDL-C, như niacin và thuốc ức chế protein vận chuyển cholesterol ester chưa chứng minh được là làm giảm biến cố tim mạch, nhưng tác động của chúng trên sự xuất bào của HDL-C là đa dạng, phức tạp và có vẻ chịu ảnh hưởng bởi việc điều trị bằng statin kèm theo [17].
3.2. Yếu tố tăng trưởng nội mô mạch máu
Yếu tố tăng trưởng nội mô mạch máu (VEGF) là một glycoprotein nhị phân điều hòa sự hình thành các mạch máu mới thông qua việc kích hoạt thụ thể VEGF. Nó có thể đóng vai trò trong tiến trình xuất hiện mảng xơ vữa mạch vành ở người cũng như tiến trình tạo hang trong bệnh mạch vành tắc nghẽn [18].
Nghiên cứu đưa liệu pháp gen XC001 vào trong điều trị đau thắt ngực kháng trị (EXACT) được thiết kế để đánh giá liệu XC001, một loại vector mang thuốc kháng virus adeno với các đồng đẳng của VEGF có hiệu quả tái tạo mạch máu tại chỗ ở những bệnh nhân đau thắt ngực kháng trị hay không [19].
3.3. Selatogrel
Việc dùng một thuốc ức chế thụ thể P2Y12 là một phần không thể thiếu trong điều trị kháng tiểu cầu kép ở bệnh nhân hội chứng vành cấp.
Selatogrel là một loại 2-phenylprimdine-4-carboxamide mới, có tính chọn lọc, đảo ngược được và dùng qua đường tiêm dưới da. Kết quả từ các nghiên cứu tiền lâm sàng, pha 1 và pha 2 đã xác nhận thuốc này có tác dụng ức chế P2Y12 kéo dài và đảo ngược được với kết cục an toàn cháp nhận được và cửa sổ trị liệu rộng hơn so với các loại ức chế P2Y12 uống [20], [21].
Ở những bệnh nhân nhồi máu cơ tim, việc dùng một liều 8 hoặc 16mg selatogrel là an toàn và tạo được một đáp ứng kháng tiểu cầu mạnh, nhanh và liên quan với liều [22]. Ở những bệnh nhân bệnh mạch vành mạn, selatogrel cho hiệu quả kháng tiểu cầu đầy đủ, kéo dài ≥ 8 giờ, và đảo ngược tác dụng trong 24 giờ [23].
Nghiên cứu SOS-AMI (Selatogrel Outcome Study in Suspected Acute Myocardial Infarction) sẽ cho kết quả về hiệu quả lâm sàng của selatogrel ở những bệnh nhân nhồi máu cơ tim cấp (NCT04957719).
3.4. Revacept
Revacept là một loại đối vận cạnh tranh với glycoprotein VI (GPVI) và dùng đường tĩnh mạch. Thuốc này gắn với collagen và sao chép con đường GPVI và chặn quá trình kết tập tiểu cầu.
Kết quả của các nghiên cứu trên động vật cho thấy revacept có hiệu quả trong ngăn ngừa kết tập tiểu cầu và hình thành huyết khối ở các sang thương động mạch ở mạch cảnh mà không ảnh hưởng lên thời gian chảy máu [24], [25], và làm giảm tăng sản nội mạc cùng dấu ấn sinh học của tăng sinh tế bào và thâm nhiễm đại thực bào [25]. Các nghiên cứu tiền lâm sàng tiếp theo cho thấy revacept ức chế mạnh huyết khối do mảng xơ vữa gây ra trong các mô hình ngoài cơ thể sử dụng máu người và mảng xơ vữa từ các phẫu thuật mạch cảnh [26].
Trong một nghiên cứu lâm sàng pha II, revacept làm giảm kết cục gộp an toàn và hiệu quả (đột quỵ hoặc tử vong, thoáng thiếu máu não, nhồi máu cơ tim, can thiệp mạch vành, và biến cố chảy máu) ở những bệnh nhân bệnh mạch cảnh trong có triệu chứng sau 11,2 ± 2,3 tháng theo dõi [27]. Tuy vậy nghiên cứu pha 2 ISAR-PLASTER (Intracoronary Stenting and Antithrombotic Regimen: Lesion Platelet Adhesion as Selective Target of Endovenous Revacept in Patients With Chronic Coronary Syndromes Undergoing Percutaneous Coronary Intervention) cho thấy việc thêm revacept vào liệu pháp kháng huyết khối được khuyến cáo hiện tại trong bối cảnh PCI bệnh nhân CAD ổn định không giúp làm giảm tổn thương cơ tim [28]. Cần thêm những nghiên cứu lâm sàng mới để đánh giá vai trò của revacept trong giảm biến cố tim mạch chính.
3.5. Inclisiran
Inclisiran là một acid ribonucleic nhỏ (siRNA) ngăn ngừa sự hình thành PCSK9 tại gan [29].
Ray và cộng sự ghi nhận inclisiran làm giảm PCSK9 và LDL-C ở những bệnh nhân nguy cơ tim mạch cao có nồng độ LDL-C cao [30]. Trong một phân tích gồm 1561 và 1617 bệnh nhân từ nghiên cứu ORION-10 và ORION-11, các nhà nghiên cứu ghi nhận LDL-C giảm 50% với inclisiran khi được tiêm dưới da mỗi 6 tháng [31]. Inclisiran khi dùng lâu dài cũng có hiệu quả giảm LDL-C và PCSK9 kéo dài và dung nạp tốt trong hơn 4 năm sử dụng [20].
Các nghiên cứu ngẫu nhiên đang được tiến hành sẽ đánh giá hiệu quả của inclisiran trên kết cục lâm sàng ở những bệnh nhân bệnh tim mạch (ORION-4) và sẽ cho những bằng chứng rõ ràng hơn cả về hiệu quả và tính an toàn của inclisiran trên MACEs (NCT03705234).
3.6. AZD5718
5-lipooxygenase activating protein (FLAP) là một protein cần thiết cho quá trình sản sinh leukotriene qua con đường 5-LO. Việc ức chế con đường này được giả định là sẽ làm giảm tử suất, bệnh suất, và nhập viện vì tim mạch ở những bệnh nhân CAD thông qua làm chậm tiến trình xơ vữa mạch máu, để củng cố chức năng vi mạch vành, và để cải thiện co bóp cơ tim sau nhồi máu cơ tim [32].
AZD5718 là một loại đối vận FLAP mới hoạt động như bước đầu tiên để chặn sự tổng hợp các leukotriene [33]. Nghiên cứu FLAVOUR (Study to Evaluate Efficacy, Safety and Tolerability of Oral AZD5718 in Patients with Coronary Artery Disease) đang tiến hành sẽ đánh giá hiệu quả và an toàn của AZD5718 ở bệnh nhân nhồi máu cơ tim [34].
3.7. Rivaroxaban
Rivaroxaban là một kháng đông ức chế yếu tố Xa có tác dụng ức chế sự hình thành thrombin và đóng vai trò quan trọng trong quá trình đông máu và kết tập tiểu cầu.
Nghiên cứu ATLAS ACS 2-TIMI 51 (Anti-Xa Therapy to Lower Cardiovascular Events in Addition to Standard Therapy in Subjects with Acute Coronary Syndrome-Thrombolysis in Myocardial Infarction 51) so sánh rivaroxaban 2,5 mg 2 lần mỗi ngày kèm aspirin; so với rivaroxaban 5 mg 2 lần mỗi ngày đơn trị; hoặc aspirin đơn trị [35]. So với nhóm aspirin đơn trị, những bệnh nhân nhóm rivaroxaban + aspirin có giảm đáng kể 22% tử vong tim mạch và giảm 49% đột quỵ thiếu máu não. Những người nhóm kết hợp cũng ghi nhận tăng đáng kể 70% số biến cố chảy máu chính, với chủ yếu là chảy máu đường tiêu hóa.
Kết quả của phân tích hậu nghiệm nghiên cứu AFIRE (Atrial Fibrillation and Ischemic Events with Rivaroxaban in Patients with Stable Coronary Artery Disease) với 2215 bệnh nhân cho kết quả rivaroxaban đơn trị có liên quan với giảm nguy cơ tổng biến cố huyết khối và/hoặc chảy máu ở bệnh nhân rung nhĩ và bệnh mạch vành mạn so với nhóm rivaroxaban + kháng tiểu cầu [36].
3.8. Colchicine
Ngày càng có nhiều bằng chứng cho thấy đáp ứng viêm đóng vai trò quan trọng cơ chế sinh bệnh của xơ vữa mạch máu. Các nghiên cứu nhắm đến cải thiện kết cục ở những bệnh nhân bệnh mạch vành gần đây cho thấy vai trò đáng hứa hẹn của colchicine, một loại thuốc có đặc tính kháng viêm [37], [38], [39]. Cùng với lý thuyết kháng viêm này, những loại thuốc truyền thống có đặc tính này cũng được nghiên cứu. Thuốc kháng viêm không steoid làm tăng nguy cơ nhồi máu cơ tim [40], trong khi đó corticosteroid được ghi nhận không hiệu quả hoặc làm tăng nguy cơ vỡ tim [41], [42].
Nghiên cứu LoDoCo (Low-Dose Colchicine) thu nhận 532 bệnh nhân cho thấy colchicine liều thấp (0,5 mg hàng ngày) thêm vào điều trị chuẩn sẽ làm giảm biến cố tim mạch ở những bệnh nhân bệnh mạch vành mạn [43].
Nghiên cứu LoDoCo 2 [44] thu nhận 5522 bệnh nhân cho kết quả tương tự. Việc tiếp tục dùng colchicine liều thấp lâu dài cũng có kết quả giảm kéo dài biến cố tim mạch chính qua từng năm trong 5 năm theo dõi [45].
Nghiên cứu COLCOT (Colchicine Cardiovascular Outcomes Trial) cũng cho thấy lợi ích về kết cục thiếu máu cục bộ khi sử dụng colchicine ở những bệnh nhân có nhồi máu cơ tim gần đây [46]. Kết quả của nghiên cứu COLCOT bổ trợ cho nghiên cứu LoDoCo2. Tuy vậy, nghiên cứu COPS (Colchicine in Patients with Acute Coronary Syndrome) lại cho thấy colchicine không có hiệu quả ở những bệnh nhân ACS về kết cục biến cố tim mạch so với nhóm chứng (6,1% so với 9,5%, p = 0,09) [47]. Hình 2 thể hiện kết quả chính ở các nghiên cứu có sử dụng colchicine hoặc các liệu pháp khác thêm vào điều trị statin nền tảng.
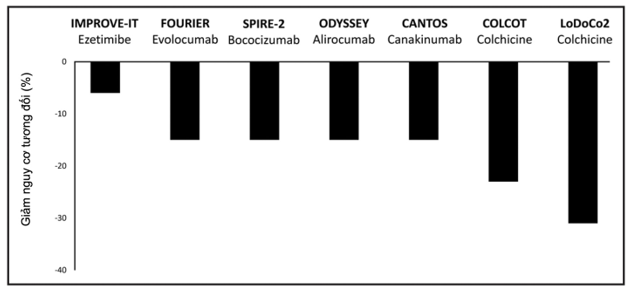
Hình 2. Kết quả giảm nguy cơ tương đối từ các nghiên cứu ngẫu nhiên, mù đôi, có nhóm chứng của ezetimibe, ức chế PCSK9, canakinumab, và colchicine liều thấp trên tỉ lệ biến cố tim mạch chính khi được dùng kèm với điều trị statin nền tảng [48]
Dù có những kết quả trái chiều, colchicine hiện vẫn là thuốc có tiềm năng trong phòng ngừa biến cố tim mạch ở bệnh nhân bệnh mạch vành, dù là cấp hay mạn, chủ yếu do tính an toàn chấp nhận được và chi phí thấp. Việc ức chế quá trình viêm gần như sẽ trở thành mục tiêu chính thứ 4 trong điều trị CAD, cùng với giảm LDL-C, ức chế kết tập tiểu cầu và kiểm soát các yếu tố nguy cơ.
3.9. Ức chế SGLT2
Một nhóm thuốc bảo vệ tim thận mới là ức chế SGLT2. SGLT2 đã được nghiên cứu ở nhóm bệnh nhân đái tháo đường típ 2, suy tim (HF), và bệnh thận [39], [49]. Những nghiên cứu này tập trung vào những bệnh nhân ngoại trú có hoặc không có CAD đi kèm và đã chứng minh được lợi ích trường diễn trong ngăn ngừa nhập viện do HF và giảm suy yếu chức năng thận cũng như giả kết cục liên quan xơ vữa mạch máu hoặc tử vong tim mạch [49]. Tuy vậy, vẫn còn khoảng trống y văn về việc sử dụng các thuốc này trong CAD, dù là cấp hay mạn [50].
Nghiên cứu EMMY (EMpagliflozin in acute MYocardial infarction) ghi nhận empaglyflozin làm giảm đáng kể NT-proBNP trong 26 tuần, cùng với đó là cải thiện đáng kể các chỉ số trên siêu âm tim về cấu trúc và chức năng ở những bệnh nhân nhồi máu cơ tim [51].
Nghiên cứu EMPACT-MI (Empagliflozin in Patients Postmyocardial Infarction) mới cong bố cuối năm 2024 cho thấy hiệu quả và an toàn của empaglyflozin so với nhóm chứng ở những bệnh nhân nhập viện vì nhồi máu cơ tim có nguy cơ cao khởi phát suy tim mới (làm giảm thời gian tới nhập viện do suy tim đầu tiên sau nhồi máu cơ tim và giảm giảm nguy cơ nhập viện do suy tim toàn bộ có ý nghĩa [50].
3.10. Thuốc ức chế PCSK9
PCSK9 là enzyme gắn vào yếu tố tăng trưởng bề mặt của domain A trong thụ thể LDL (LDL-R), gây kích hoạt sự phân rã của thụ thể này. Enzyme này gây ra tình trạng giảm nồng độ LDL-R, từ đó làm giảm chuyển hóa LDL-C, và có thể đưa đến tăng cholesterol máu. Ức chế chức năng PCSK9 bằng kháng thể đơn dòng được ghi nhận là có hiệu quả trong giảm nồng độ cholesterol [52]. Khi kết hợp với statin liều cao nhất có thể dung nạp được, alirocumab và evolocumab làm giảm LDL-C 46-73% so với nhóm chứng và giảm 30% so với ezetimibe [53], [54]. Hơn nữa, các thuốc này còn làm giảm thêm biến cố tim mạch tương lai. Khi statin không dung nạp được hoặc không dùng được, ức chế PCSK9 sẽ là lựa chọn làm giảm LDL-C khi dùng kết hợp với ezetimibe [55].
Một phân tích trở lại gần đây của nghiên cứu FOURNIER so sánh dữ liệu tử vong trong kết quả công bố chính với kết quả từ Clinical Study Report (CSR) ghi nhận tử vong do nguyên nhân từ tim là cao hơn ở nhóm evolocumab so với nhóm chứng. Điều này gợi ý có thể có tác dụng có hại trên tim. Nghiên cứu đã được dừng sớm khi nguy cơ tử vong do tim mạch cao hơn không ý nghĩa được quan sát ở nhóm evolocumab .
4. Các tiến bộ trong điều trị xâm lấn
Mặc dù đã có những cải thiện đáng kể trong các điều trị xâm lấn CAD, đặc biệt là trong sự phát triển của stent mạch vành, thì các kỹ thuật mới vẫn có thể có thêm lợi ích về làm lành nội mạc và cơ tim cũng như làm giảm biến cố tim mạch ở những sang thương cụ thể. Hơn nữa, các phương thức điều trị mới cũng sẽ cải thiện sức khỏe tinh thần của nhân viên y tế và làm giảm rủi ro công việc.
Bản thân PCI cũng đã có những tiến bộ vượt trội trong những năm gần đây. Việc đưa vào thực hành các thế hệ mới của stent phủ thuốc đã làm thay đổi chiến lược tái thông mạch vành trên toàn cầu. Những loại stent mới sử dụng các loại thuốc có khả năng chống tái hẹp, từ đó làm giảm rõ rệt tần suất tái hẹp trong stent và kết cục tái thông trở lại [56]. Bên cạnh đó, các khung stent tự tiêu cũng trở thành một lựa chọn nữa sau khi chứng minh được sự ưu việt của tiêu khung stent theo thời gian và trả lại cấu trúc mạch máu ban đầu. Các phương tiện đánh giá hình ảnh học cũng trở nên quan trọng hơn trong các chiến lược PCI. Siêu âm trong lòng mạch (IVUS) và chụp cắt lớp quang học (OCT) đã đưa đến những hình ảnh mạch vành có độ phân giải cao, thời gian thực, và giúp nâng cao việc phân tích hình ảnh, cũng như hỗ trợ thủ thuật, từ đó mang đến việc đặt stent tối ưu hơn. Khả năng phân tích mảng xơ vữa và tiến triển của stent cũng góp phần vào thành công của điều trị và đưa đến những hiệu quả về lâu dài. Các phương pháp tiếp cận ít xâm lấn nhất có thể cũng được ưu tiên hơn trong quản lý CAD. Trong đó, can thiệp mạch vành qua da qua đường động mạch quay được chứng minh là ít dẫn đến biến cố chảy máu hơn và đưa đến sự dễ chịu cho bệnh nhân hơn là phương pháp tiếp cận truyền thống qua đường động mạch đùi. Tiếp cận qua đường động mạch quay cũng đã trở thành phương thức được khuyến cáo trong các hướng dẫn hiện hành [2].
Gần đây, PCI với sự hỗ trợ của robot là một nỗ lực mới nhất trong quản lý CAD. PCI với robot mang lại lợi điểm về tính chính xác cũng như hạn chế tối đa phơi nhiễm tia xạ trong quá trình thủ thuật. Cùng với các sự phát triển về nhiều phương diện của PCI, phẫu thuật bắc cầu mạch vành (CABG) cũng có thể là một lựa chọn ưu tiên trong một số bệnh nhân nhất định. Các tiến bộ trong kỹ thuật phẫu thuật, như CABF off-pump và tái thông mạch vành hoàn toàn, đã làm giảm được biến chứng quanh thủ thuật và cải thiện được chức năng của mảnh ghép [57].
Trong phần này, chúng tôi sẽ mô tả vai trò của các kỹ thuật mới trong quản lý bệnh mạch vành.
4.1. PCI dựa trên robot
Mặc dù những tiến bộ kỹ thuật trong PCI gần đây đã giúp việc điều trị các sang thương mạch vành phức tạp có ít biến chứng do tái hẹp trong stent và huyết khối trong stent hơn thì sự phơi nhiễm nghề nghiệp và rủi ro về xương khớp ở các thủ thuật viên vẫn là vấn đề cần quan tâm [58], [59]. Do đó, các hệ thống công cụ thủ thuật tim mạch từ xa đã được phát triển để làm giảm những rủi ro nghề nghiệp và có tiềm năng cải thiện việc chọn lựa kích thước stent [60]. Hệ thống CorPath 200 là loại được sử dụng nhiều nhất (Hình 3). Hệ thống này gồm một bàn (có cánh tay điều khiển, hệ thống robot, và dụng cụ), một bảng điều khiển từ xa với tấm chắn tia và đơn vị điều khiển trung tâm, hệ thống theo dõi huyết động, và bàn đạp tia X. Tuy vậy, việc tiếp cận mạch máu, chụp mạch vành chẩn đoán và đi dây dẫn vẫn phải được thực hiện trực tiếp bằng tay.
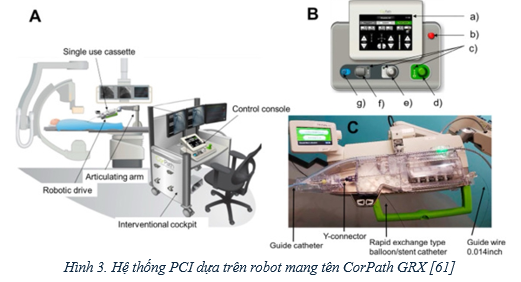
Hình 3. Hệ thống PCI dựa trên robot mang tên CorPath GRX [61]
Tính an toàn và khả dụng của PCI dựa trên CorPath được thử nghiệm trong nhiều nghiên cứu tiến cứu không ngẫu nhiên [60], [62]. Nghiên cứu PRECISE (Percutaneous Robotically Enhanced Coronary Intervention) thu nhận tổng cộng 164 bệnh nhân có mạch vành hẹp ít nhất 50% mà có thể điều trị bằng 1 stent và PCI có thể chương trình hoặc sớm [63]. Thành công về mặt thủ thuật ghi nhận được là 98,8%; không trường hợp tử vong, đột quỵ, nhồi máu cơ tim có sóng Q, hoặc tái thông nào xảy ra trong 30 ngày sau thủ thuật. Phơi nhiễm với tia ở thủ thuật viên chính giảm 95,2% so với phương pháp truyền thống. Tuy vậy, các sang thương mạch vành trong nghiên cứu chủ yếu là không phức tạp. Nghiên cứu CORA-PCI (Complex Robotically Assisted Percutaneous Coronary Intervention) thu nhận 315 bệnh nhận (20% ACS) với 334 thủ thuật PCI với tỉ lệ sang thương phức tạp cao (78,3% type B2/C trong nhóm robot (R-PCI) so với 68,3% nhóm PCI thông thường) [64]. Thành công về thủ thuật ở nhóm R-PCI là 91,7%. Kết cục lâm sàng là tương đương giữa 2 nhóm, với không có biến cố phụ nào về việc sử dụng stent hoặc thời gian chiếu tia được ghi nhận giữa 2 nhóm.
Những cải thiện về kỹ thuật ở nhóm R-PCI có thể mở ra những hướng đi mới về độ khả dụng và an toàn của việc đặt stent hoàn toàn từ xa qua việc sử dụng kết hợp robot và công nghệ giao tiếp từ xa [65], [66].
4.2. Hệ thống xạ hình nội mạch vành bằng sóng xung kích (Shockwave Coronary Intravascular Lithotripsy System)
PCI các sang thương vôi hóa nặng (CAC) là một thách thức vì những mảng vôi nặng là yếu tố nguy cơ của bóc tách, thủng mạch vành, nhồi máu cơ tim, tái hẹp trong stent, và huyết khối [67], [68], [69], [70]. Hơn nữa, các sang thương này còn đi kèm nguy cơ stent không nở hết, không áp sát vào tổn thương mạch máu [67], [68], [69], [70]. Các thiết bị khoan cắt mảng xơ vữa hiện tại có thể bị giới hạn trong sử dụng dây dẫn, và có thể liên quan với hiện tượng chậm dòng, không dòng, và bóc tách mạch vành [71], [72], [73]. Gần đây, một kỹ thuật mới dựa trên nguyên tắc điều trị sỏi thận, thông qua hệ thống xung kích nội mạch (S-IVL) đã được phát triển. Các sóng xung kích được đưa vào qua một hệ thống bóng dây dẫn, tương tự với hệ thống bóng mạch vành, và làm vỡ mảng xơ vữa mà không ảnh hưởng đến mô mềm [74], [75]. Hiệu quả và tính an toàn của kỹ thuật mới này đã được ghi nhận trong các nghiên cứu tiến cứu không ngẫu nhiên trên các sang thương ổn định cũng như cấp tính với biến cố gây ra bởi các mảng xơ vữa vôi hóa [76], [75], [77]. Một phân tích gộp gồm 4 nghiên cứu thu nhận 628 bệh nhân cho thấy tỉ lệ thành công thủ thuật là 92,4% với tỉ lệ MACE thấp (tử vong do tim, nhồi máu cơ tim và tái thông mạch đích) là 7,3% [78]. Tiền sử nhồi máu cơ tim, sang thương phân nhánh, và sang thương dài là các dấu hiệu độc lập dự báo MACE và thất bại thủ thuật. Biến chứng sau IVL xảy ra trong chỉ 2,1% số thủ thuật. Do vậy, S-IVL là một kỹ thuật an toàn và có tiềm năng trong điều trị các sang thương vôi hóa nặng.
4.3. Liệu pháp tế bào gốc trong bệnh tim thiếu máu cục bộ
Tế bào gốc có khả năng tự làm mới và tự phân lập; do vậy, chúng có thể có lợi trong phục hồi cấu trúc tim sau nhồi máu cơ tim và suy tim. Tế bào gốc bao gồm các tế bào gốc phôi (lấy từ phôi nang), tế bào gốc trung mô lấy từ tủy xương, và tế bào gốc vạn năng (iPS) lấy từ bất kỳ mô nào và biến đổi để hoạt động như một tế bào phôi thai [79], [80]. Mặc dù liệu pháp tế bào gốc tạo được sự hồi phục cơ tim sau nhồi máu cơ tim [81], thì lợi ích lâm sàng trên người vẫn còn là chủ đề tranh cãi.
Bài tổng quan về ứng dụng của tế bào gốc tủy xương trên bệnh nhân nhồi máu cơ tim cấp không cho thấy cải thiện về tử vong, chất lượng cuộc sống, hay chức năng thất trái [82]. Tuy vậy, một nghiên cứu nhỏ khác khi đánh giá tế bào gốc tim nội sinh cho thấy sự hồi phục cơ tim của vùng nhồi máu và sẹo nhồi máu giảm hơn [83]. Sức sống của tế bào gốc sau cấy ghép là ngắn, nhưng hiệu quả điều trị của những tế bào này có thể liên quan chủ yếu tới đặc tính cận tiết qua việc tiết ra cytokines và các yếu tố tăng trưởng của các quá trình chống apoptosis, tái tạo mạch máu, quá trình viêm, và tín hiệu thu nhận tế bào [83], [84], [85]. Do vậy, việc tiêm những túi nhỏ chứa các nguyên ủy tế bào, được tiết ra từ các tế bào gốc, bao gồm proteins, RNA và miRNA có tiềm năng bảo vệ tim tương tự như những liệu pháp điều trị tế bào gốc nhưng với độ ổn định dài hơn, và ít phản ứng miễn dịch hơn, cũng như không có nguy cơ tạo khối u [86]. Một số nghiên cứu khác còn gợi ý việc điều trị qua các exome như vậy có cải thiện chức năng thất trái sau tổn thương cơ tim [87], [88].
Những nghiên cứu và phát triển kỹ thuật trong chuẩn bị tế bào gốc, đường sử dụng, exome, và kỹ thuật sinh học tế bào là hướng tiềm năng trong những thập kỷ tới để cải thiện phục hồi cơ tim sau biến cố thiếu máu cục bộ cấp tính ở những bệnh nhân CAD cũng như để giảm gánh nặng suy tim.
4.4. Kỹ thuật nano
Các mảnh nano (NP) có đặc tính cho phép vận chuyển thuốc đến mục tiêu với thời gian di chuyển nhanh hơn và tính thấm cao hơn; do vậy NP có thể làm tăng hiệu quả thuốc với liều thấp hơn và tác dụng phụ ít hơn [89], [90], [91]. Công nghệ này có tiềm năng trong điều trị CAD, làm giảm tái hẹp trong stent và tấn công vào các mảng xơ vữa (Hình 4). Hệ thống NP thông minh được đưa vào qua các stent có thể giúp phòng thích thuốc tại chỗ lâu dài, và là một liệu pháp điều trị tiềm năng [90]. Nhiều hệ thống NP đã được phát triển để đưa các loạithuốc chống tái hẹp như liposomes [92], micelles [89], và NP polymeric [87]. Hơn nữa, việc dùng các loại NP dạng gel có chứa rapamycin trên mô hình chuột tổn thương mạch cảnh đã ghi nhận sự hồi phục nội mô và giảm tăng sản [93]. Liệu pháp gen cũng là một chiến lược nổi bật trong tái tạo thành mạch và ức chế tái hẹp [94], [95].
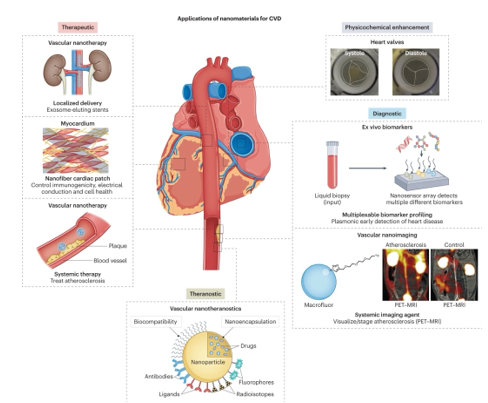
Hình 4. Mô phỏng ứng dụng công nghệ nano y học trong bệnh lý tim mạch [96]
Trong một nghiên cứu tiền lâm sàng tiến cứu ở mô hình động vật sử dụng hệ thống phủ nano chứa acid hyaluronic và plasmid DNA, các nhà nghiên cứu sử dụng các nanobiohybrid hydrogel chứa endosomolytic Tat peptide cùng với DNA tái tạo nội mạc [97], [98]. Công nghệ nano cũng được áp dụng để tạo ra lớp phủ polymer cấu trúc nano để điều hòa phóng thích thuốc từ stent. Nghiên cứu in-vitro của NPS polylactic-co-glycolic acid (PLGA), một loại polymer tương thích sinh học, cho kết quả phóng thích có kiểm soát paclitaxel mà không bị gián đoạn [99]. Một số con đường xơ vữa mạch máu trực tiếp cũng có thể được giải quyết bằng NP tại ngay mảng xơ vữa [88].
Trên mô hình động vật, những nhà nghiên cứu đã báo cáo giảm đáp ứng viêm thông qua tiến trình vận chuyển interleukin-10 qua NP [100]; NP phối hợp với siRNA ức chế kết tụ bạch cầu [101]; NP ức chế hình thành mạch máu phối hợp với statin tại chỗ chống mạch máu hóa mảng xơ vữa [102]. Chặn đại thực bào [102] và tiêu sợi huyết tại chỗ cũng như vận chuyển kháng đông bằng NP [103], [104], [105], [106] cũng cho những kết quả đáng khích lệ liên quan đến ổn định mảng xơ vữa.
4.5. In 3D
Kỹ thuật in 3D, được giới thiệu đầu tiên vào năm 1986 [107], là một kỹ thuật cho phép các vật thể 3D được tạo ra từ một mô hình hình học điện tử [108], [109]. In 3D có ứng dụng về mặt giáo dục và lâm sàng; kỹ thuật này có thể được dùng để giảng dạy y khoa cũng như cải thiện giao tiếp với bệnh nhân [110], [111].
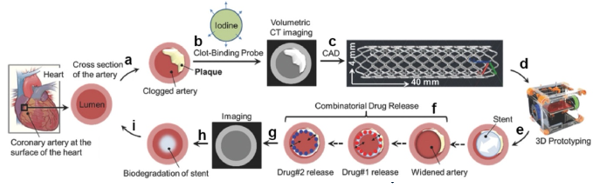
Hình 5. Mô phỏng quá trình tạo ra một stent mạch vành cá thể hóa cho từng bệnh nhân [112]
Trong CAD, mô hình 3D cho phép chúng ta có cái nhìn cụ thể về giường động mạch vành, đóng vai trò quan trọng trong đánh giá vị trí hẹp, chuẩn bị thủ thuật can thiệp [113], [111], để tiến hành các kiểm tra mô phỏng xâm lấn [114], và có thể dùng để đánh giá việc đặt stent tại vị trí giường mạch máu cụ thể [108] (Hình 5). Hơn nữa, in 3D kết hợp với các phương thức hình ảnh học khác cũng cho phép mô phỏng các đo lường chẩn đoán xâm lấn để thử nghiệm và xác định ngưỡng tham chiếu chuẩn của các công cụ chẩn đoán so với ngưỡng vàng in vitro [62]. Kỹ thuật in 3D được phát triển có thể là bước tiến trong việc cá thể hóa dụng cụ trên từng bệnh nhân.
5. Kết luận
Dù đã có các tiến bộ làm giảm tử vong thông qua điều trị bằng thuốc và kỹ thuật tái thông mạch máu thì CAD vẫn là một trong các nguyên nhân tử vong và bệnh tật hàng đầu trên thế giới. Từ đầu những năm 2010, một số kỹ thuật chẩn đoán và điều trị mới đã cải thiện sự hiểu biết và hướng trị liệu của bệnh mạch vành. Việc xác định các phương thức điều trị và mục tiêu chẩn đoán là cần thiết để phát triển các kỹ thuật điều trị mới và chiến lược chẩn đoán mới trong CAD. Tuy vậy, vẫn còn cần những bằng chứng lâm sàng rõ ràng hơn. Các nghiên cứu trong tương lai trong lĩnh vực này nên tập trung vào liệu pháp tế bào gốc, các phương thức trị liệu chống tăng sinh mạch máu mới, và các công cụ chẩn đoán mới.
Tài liệu tham khảo
- Tsao CW, Aday AW, Almarzooq ZI, Alonso A, Beaton AZ, Bittencourt MS, et al. Heart Disease and Stroke Statistics-2022 Update: A Report From the American Heart Association. Circulation. 2022;145(8):e153-e639. Epub 20220126.
- Maron DJ, Hochman JS, Reynolds HR, Bangalore S, O’Brien SM, Boden WE, et al. Initial Invasive or Conservative Strategy for Stable Coronary Disease. New England Journal of Medicine. 2020;382(15):1395-407.
- Virani SS, Newby LK, Arnold SV, Bittner V, Brewer LC, Demeter SH, et al. 2023 AHA/ACC/ACCP/ASPC/NLA/PCNA Guideline for the Management of Patients With Chronic Coronary Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2023;148(9):e9-e119.
- Lawton JS, Tamis-Holland JE, Bangalore S, Bates ER, Beckie TM, Bischoff JM, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145(3):e18-e114.
- Delgado-Lista J, Alcala-Diaz JF, Torres-Peña JD, Quintana-Navarro GM, Fuentes F, Garcia-Rios A, et al. Long-term secondary prevention of cardiovascular disease with a Mediterranean diet and a low-fat diet (CORDIOPREV): a randomised controlled trial. The Lancet. 2022;399(10338):1876-85.
- Vaduganathan M, Docherty KF, Claggett BL, Jhund PS, de Boer RA, Hernandez AF, et al. SGLT2 inhibitors in patients with heart failure: a comprehensive meta-analysis of five randomised controlled trials. The Lancet. 2022;400(10354):757-67.
- Sattar N, Lee MMY, Kristensen SL, Branch KRH, Del Prato S, Khurmi NS, et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials. The Lancet Diabetes & Endocrinology. 2021;9(10):653-62.
- Thomas RJ, Beatty AL, Beckie TM, Brewer LC, Brown TM, Forman DE, et al. Home-Based Cardiac Rehabilitation: A Scientific Statement From the American Association of Cardiovascular and Pulmonary Rehabilitation, the American Heart Association, and the American College of Cardiology. Circulation. 2019;140(1):e69-e89.
- Yndigegn T, Lindahl B, Mars K, Alfredsson J, Benatar J, Brandin L, et al. Beta-Blockers after Myocardial Infarction and Preserved Ejection Fraction. New England Journal of Medicine. 2024;390(15):1372-81.
- Ford TJ, Corcoran D, Berry C. Stable coronary syndromes: pathophysiology, diagnostic advances and therapeutic need. Heart. 2018;104(4):284-92. Epub 20171013.
- Rader DJ, Alexander ET, Weibel GL, Billheimer J, Rothblat GH. The role of reverse cholesterol transport in animals and humans and relationship to atherosclerosis. J Lipid Res. 2009;50 Suppl(Suppl):S189-94. Epub 20081208.
- Agrawal H, Aggarwal K, Littrell R, Velagapudi P, Turagam MK, Mittal M, Alpert MA. Pharmacological and non pharmacological strategies in the management of coronary artery disease and chronic kidney disease. Curr Cardiol Rev. 2015;11(3):261-9.
- Tang Z-H, Peng J, Ren Z, Yang J, Li T-T, Li T-H, et al. New role of PCSK9 in atherosclerotic inflammation promotion involving the TLR4/NF-κB pathway. Atherosclerosis. 2017;262:113-22.
- Boden WE, Marzilli M, Crea F, Mancini GBJ, Weintraub WS, Taqueti VR, et al. Evolving Management Paradigm for Stable Ischemic Heart Disease Patients: JACC Review Topic of the Week. J Am Coll Cardiol. 2023;81(5):505-14.
- Bhatt AB, Stone PH. Current strategies for the prevention of angina in patients with stable coronary artery disease. Current Opinion in Cardiology. 2006;21(5):492-502.
- Bansal A, Hiwale K. Updates in the Management of Coronary Artery Disease: A Review Article. Cureus. 2023;15(12):e50644. Epub 20231216.
- Brownell N, Rohatgi A. Modulating cholesterol efflux capacity to improve cardiovascular disease. Current Opinion in Lipidology. 2016;27(4).
- Inoue M, Itoh H, Ueda M, Naruko T, Kojima A, Komatsu R, et al. Vascular Endothelial Growth Factor (VEGF) Expression in Human Coronary Atherosclerotic Lesions. Circulation. 1998;98(20):2108-16.
- Povsic TJ, Henry TD, Ohman EM, Pepine CJ, Crystal RG, Rosengart TK, et al. Epicardial delivery of XC001 gene therapy for refractory angina coronary treatment (The EXACT Trial): Rationale, design, and clinical considerations. American Heart Journal. 2021;241:38-49.
- Milluzzo RP, Franchina GA, Capodanno D, Angiolillo DJ. Selatogrel, a novel P2Y12 inhibitor: a review of the pharmacology and clinical development. Expert opinion on investigational drugs. 2020;29(6):537-46.
- Beavers CJ, Effoe SA, Dobesh PP. Selatogrel: A Novel Subcutaneous P2Y12 Inhibitor. Journal of Cardiovascular Pharmacology. 2022;79(2).
- Sinnaeve P, Fahrni G, Schelfaut D, Spirito A, Mueller C, Frenoux J-M, et al. Subcutaneous Selatogrel Inhibits Platelet Aggregation in Patients With Acute Myocardial Infarction. Journal of the American College of Cardiology. 2020;75(20):2588-97.
- Storey RF, Gurbel PA, Ten Berg J, Bernaud C, Dangas GD, Frenoux JM, et al. Pharmacodynamics, pharmacokinetics, and safety of single-dose subcutaneous administration of selatogrel, a novel P2Y12 receptor antagonist, in patients with chronic coronary syndromes. Eur Heart J. 2020;41(33):3132-40.
- Schönberger T, Ziegler M, Borst O, Konrad I, Nieswandt B, Massberg S, et al. The dimeric platelet collagen receptor GPVI-Fc reduces platelet adhesion to activated endothelium and preserves myocardial function after transient ischemia in mice. Am J Physiol Cell Physiol. 2012;303(7):C757-66. Epub 20120718.
- Alberti S, Zhang Q, D’Agostino I, Bruno A, Tacconelli S, Contursi A, et al. The antiplatelet agent revacept prevents the increase of systemic thromboxane A2 biosynthesis and neointima hyperplasia. Scientific Reports. 2020;10(1):21420.
- Jamasbi J, Megens RTA, Bianchini M, Münch G, Ungerer M, Faussner A, et al. Differential Inhibition of Human Atherosclerotic Plaque–Induced Platelet Activation by Dimeric GPVI-Fc and Anti-GPVI Antibodies: Functional and Imaging Studies. Journal of the American College of Cardiology. 2015;65(22):2404-15.
- Uphaus T, Richards T, Weimar C, Neugebauer H, Poli S, Weissenborn K, et al. Revacept, an Inhibitor of Platelet Adhesion in Symptomatic Carotid Stenosis: A Multicenter Randomized Phase II Trial. Stroke. 2022;53(9):2718-29.
- Mayer K, Hein-Rothweiler R, Schüpke S, Janisch M, Bernlochner I, Ndrepepa G, et al. Efficacy and safety of revacept, a novel lesion-directed competitive antagonist to platelet glycoprotein VI, in patients undergoing elective percutaneous coronary intervention for stable ischemic heart disease: the randomized, double-blind, placebo-controlled ISAR-PLASTER phase 2 trial. Jama Cardiology. 2021;6(7):753-61.
- Macchi C, Sirtori CR, Corsini A, Santos RD, Watts GF, Ruscica M. A new dawn for managing dyslipidemias: The era of rna-based therapies. Pharmacological Research. 2019;150:104413.
- Ray Kausik K, Wright RS, Kallend D, Koenig W, Leiter Lawrence A, Raal Frederick J, et al. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol. New England Journal of Medicine. 2020;382(16):1507-19.
- Ray KK, Troquay RPT, Visseren FLJ, Leiter LA, Scott Wright R, Vikarunnessa S, et al. Long-term efficacy and safety of inclisiran in patients with high cardiovascular risk and elevated LDL cholesterol (ORION-3): results from the 4-year open-label extension of the ORION-1 trial. The Lancet Diabetes & Endocrinology. 2023;11(2):109-19.
- Pettersen D, Davidsson Ö, Whatling C. Recent advances for FLAP inhibitors. Bioorganic & Medicinal Chemistry Letters. 2015;25(13):2607-12.
- Ericsson H, Nelander K, Lagerstrom-Fermer M, Balendran C, Bhat M, Chialda L, et al. Initial Clinical Experience with AZD5718, a Novel Once Daily Oral 5-Lipoxygenase Activating Protein Inhibitor. Clinical and Translational Science. 2018;11(3):330-8.
- Prescott E, Pernow J, Saraste A, Åkerblom A, Angerås O, Erlinge D, et al. Design and rationale of FLAVOUR: A phase IIa efficacy study of the 5-lipoxygenase activating protein antagonist AZD5718 in patients with recent myocardial infarction. Contemporary Clinical Trials Communications. 2020;19:100629.
- Mega Jessica L, Braunwald E, Wiviott Stephen D, Bassand J-P, Bhatt Deepak L, Bode C, et al. Rivaroxaban in Patients with a Recent Acute Coronary Syndrome. New England Journal of Medicine.366(1):9-19.
- Naito R, Miyauchi K, Yasuda S, Kaikita K, Akao M, Ako J, et al. Rivaroxaban Monotherapy vs Combination Therapy With Antiplatelets on Total Thrombotic and Bleeding Events in Atrial Fibrillation With Stable Coronary Artery Disease: A Post Hoc Secondary Analysis of the AFIRE Trial. JAMA Cardiology. 2022;7(8):787-94.
- Dasgeb B, Kornreich D, McGuinn K, Okon L, Brownell I, Sackett DL. Colchicine: an ancient drug with novel applications. British Journal of Dermatology. 2018;178(2):350-6.
- Chen K, Schenone AL, Borges N, Militello M, Menon V. Teaching an Old Dog New Tricks: Colchicine in Cardiovascular Medicine. American Journal of Cardiovascular Drugs. 2017;17(5):347-60.
- Imazio M, Gaita F. Colchicine for cardiovascular medicine. Future Cardiol. 2016;12(1):9-16. Epub 20151203.
- Olsen AM, Fosbøl EL, Lindhardsen J, Folke F, Charlot M, Selmer C, et al. Long-term cardiovascular risk of nonsteroidal anti-inflammatory drug use according to time passed after first-time myocardial infarction: a nationwide cohort study. Circulation. 2012;126(16):1955-63. Epub 20120910.
- Vogel RA, Forrester JS. Cooling off hot hearts: a specific therapy for vulnerable plaque? J Am Coll Cardiol. 2013;61(4):411-2. Epub 20121219.
- Giugliano GR, Giugliano RP, Gibson CM, Kuntz RE. Meta-analysis of corticosteroid treatment in acute myocardial infarction. American Journal of Cardiology. 2003;91(9):1055-9.
- Nidorf SM, Eikelboom JW, Budgeon CA, Thompson PL. Low-Dose Colchicine for Secondary Prevention of Cardiovascular Disease. Journal of the American College of Cardiology. 2013;61(4):404-10.
- Nidorf Stefan M, Fiolet Aernoud TL, Mosterd A, Eikelboom John W, Schut A, Opstal Tjerk SJ, et al. Colchicine in Patients with Chronic Coronary Disease. New England Journal of Medicine. 2020;383(19):1838-47.
- Opstal TSJ, van Broekhoven A, Fiolet ATL, Mosterd A, Eikelboom JW, Nidorf SM, et al. Long-Term Efficacy of Colchicine in Patients With Chronic Coronary Disease: Insights From LoDoCo2. Circulation. 2022;145(8):626-8.
- Tardif J-C, Kouz S, Waters David D, Bertrand Olivier F, Diaz R, Maggioni Aldo P, et al. Efficacy and Safety of Low-Dose Colchicine after Myocardial Infarction. New England Journal of Medicine. 2019;381(26):2497-505.
- Tong DC, Quinn S, Nasis A, Hiew C, Roberts-Thomson P, Adams H, et al. Colchicine in Patients With Acute Coronary Syndrome. Circulation. 2020;142(20):1890-900.
- Ridker PM. The Time to Initiate Anti-Inflammatory Therapy for Patients With Chronic Coronary Atherosclerosis Has Arrived. Circulation. 2023;148(14):1071-3. Epub 20231002.
- Anker Stefan D, Butler J, Filippatos G, Ferreira João P, Bocchi E, Böhm M, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. New England Journal of Medicine. 2021;385(16):1451-61.
- J. Butler et al. Empagliflozin after Acute Myocardial Infartion. NEJM. DOI: 10.1056/NEJMoa2314051
- von Lewinski D, Kolesnik E, Tripolt NJ, Pferschy PN, Benedikt M, Wallner M, et al. Empagliflozin in acute myocardial infarction: the EMMY trial. Eur Heart J. 2022;43(41):4421-32.
- Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies With the special contribution of the European Association of Preventive Cardiology (EAPC). European Heart Journal. 2021;42(34):3227-337.
- Marston NA, Kamanu FK, Nordio F, Gurmu Y, Roselli C, Sever PS, et al. Predicting Benefit From Evolocumab Therapy in Patients With Atherosclerotic Disease Using a Genetic Risk Score. Circulation. 2020;141(8):616-23.
- Damask A, Steg PG, Schwartz GG, Szarek M, Hagström E, Badimon L, et al. Patients With High Genome-Wide Polygenic Risk Scores for Coronary Artery Disease May Receive Greater Clinical Benefit From Alirocumab Treatment in the ODYSSEY OUTCOMES Trial. Circulation. 2020;141(8):624-36. Epub 20191111.
- Cho L, Rocco M, Colquhoun D, Sullivan D, Rosenson RS, Dent R, et al. Clinical Profile of Statin Intolerance in the Phase 3 GAUSS-2 Study. Cardiovascular Drugs and Therapy. 2016;30(3):297-304.
- Praet KMV, Kofler M, Shafti TZN, Al aAE, Kampen Av, Amabile A, et al. Minimally Invasive Coronary Revascularisation Surgery: A Focused Review of the Available Literature. Interventional Cardiology Review 2021;16:e08. 2021.
- Kentenich H, Müller D, Wein B, Stock S, Seleznova Y. Methods for assessing guideline adherence for invasive procedures in the care of chronic coronary artery disease: a scoping review. BMJ Open. 2023;13(3):e069832.
- Goldstein JA, Balter S, Cowley M, Hodgson J, Klein LW. Occupational hazards of interventional cardiologists: Prevalence of orthopedic health problems in contemporary practice. Catheterization and Cardiovascular Interventions. 2004;63(4):407-11.
- Chakravartti J, Rao SV. Robotic Assisted Percutaneous Coronary Intervention: Hype or Hope? Journal of the American Heart Association. 2019;8(13):e012743.
- Maor E, Eleid MF, Gulati R, Lerman A, Sandhu GS. Current and Future Use of Robotic Devices to Perform Percutaneous Coronary Interventions: A Review. Journal of the American Heart Association.6(7):e006239.
- Stevenson A, Kirresh A, Ahmad M, Candilio L. Robotic-Assisted PCI: The Future of Coronary Intervention? Cardiovascular Revascularization Medicine. 2022;35:161-8.
- Kolli KK, Min JK, Ha S, Soohoo H, Xiong G. Effect of Varying Hemodynamic and Vascular Conditions on Fractional Flow Reserve: An In Vitro Study. Journal of the American Heart Association.5(7):e003634.
- Madder RD, VanOosterhout SM, Jacoby ME, Collins JS, Borgman AS, Mulder AN, et al. Percutaneous coronary intervention using a combination of robotics and telecommunications by an operator in a separate physical location from the patient: an early exploration into the feasibility of telestenting (the REMOTE-PCI study). EuroIntervention. 2017;12(13):1569-76.
- Madder RD, VanOosterhout S, Mulder A, Bush J, Martin S, Rash A, et al. Feasibility of robotic telestenting over long geographic distances: a pre-clinical ex vivo and in vivo study. EuroIntervention. 2019;15(6):e510-e2.
- Mori S, Yasuda S, Kataoka Y, Morii I, Kawamura A, Miyazaki S. Significant association of coronary artery calcification in stent delivery route with restenosis after sirolimus-eluting stent implantation. Circulation Journal. 2009;73(10):1856-63.
- Wiemer M, Butz T, Schmidt W, Schmitz K-P, Horstkotte D, Langer C. Scanning electron microscopic analysis of different drug eluting stents after failed implantation: From nearly undamaged to major damaged polymers. Catheterization and Cardiovascular Interventions. 2010;75(6):905-11.
- Tzafriri AR, Garcia-Polite F, Zani B, Stanley J, Muraj B, Knutson J, et al. Calcified plaque modification alters local drug delivery in the treatment of peripheral atherosclerosis. Journal of Controlled Release. 2017;264:203-10.
- Kobayashi Y, Okura H, Kume T, Yamada R, Kobayashi Y, Fukuhara K, et al. Impact of Target Lesion Coronary Calcification on Stent Expansion
– An Optical Coherence Tomography Study –. Circulation Journal. 2014;78(9):2209-14.
- Chambers JW, Feldman RL, Himmelstein SI, Bhatheja R, Villa AE, Strickman NE, et al. Pivotal Trial to Evaluate the Safety and Efficacy of the Orbital Atherectomy System in Treating De Novo, Severely Calcified Coronary Lesions (ORBIT II). JACC: Cardiovascular Interventions. 2014;7(5):510-8.
- Généreux P, Lee AC, Kim CY, Lee M, Shlofmitz R, Moses JW, et al. Orbital atherectomy for treating de novo severely calcified coronary narrowing (1-year results from the pivotal ORBIT II trial). The American journal of cardiology. 2015;115(12):1685-90.
- Yamamoto MH, Maehara A, Karimi Galougahi K, Mintz GS, Parviz Y, Kim SS, et al. Mechanisms of Orbital Versus Rotational Atherectomy Plaque Modification in Severely Calcified Lesions Assessed by Optical Coherence Tomography. JACC: Cardiovascular Interventions. 2017;10(24):2584-6.
- de Waha S, Allali A, Büttner HJ, Toelg R, Geist V, Neumann FJ, et al. Rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: Two-year clinical outcome of the randomized ROTAXUS trial. Catheter Cardiovasc Interv. 2016;87(4):691-700. Epub 20151103.
- Abdel-Wahab M, Richardt G, Joachim Büttner H, Toelg R, Geist V, Meinertz T, et al. High-speed rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: the randomized ROTAXUS (Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease) trial. JACC Cardiovasc Interv. 2013;6(1):10-9. Epub 20121219.
- Brinton TJ, Ali ZA, Hill JM, Meredith IT, Maehara A, Illindala U, et al. Feasibility of Shockwave Coronary Intravascular Lithotripsy for the Treatment of Calcified Coronary Stenoses. Circulation. 2019;139(6):834-6.
- Kereiakes DJ, Di Mario C, Riley RF, Fajadet J, Shlofmitz RA, Saito S, et al. Intravascular Lithotripsy for Treatment of Calcified Coronary Lesions: Patient-Level Pooled Analysis of the Disrupt CAD Studies. JACC: Cardiovascular Interventions. 2021;14(12):1337-48.
- Saito S, Yamazaki S, Takahashi A, Namiki A, Kawasaki T, Otsuji S, et al. Intravascular Lithotripsy for Vessel Preparation in Severely Calcified Coronary Arteries Prior to Stent Placement ― Primary Outcomes From the Japanese Disrupt CAD IV Study ―. Circulation Journal. 2021;85(6):826-33.
- Terashvili M, Bosnjak ZJ. Stem Cell Therapies in Cardiovascular Disease. Journal of Cardiothoracic and Vascular Anesthesia. 2019;33(1):209-22.
- Yu H, Lu K, Zhu J, Wang Ja. Stem cell therapy for ischemic heart diseases. British Medical Bulletin. 2017;121(1):135-54.
- Fernandes S, Chong JJH, Paige SL, Iwata M, Torok-Storb B, Keller G, et al. Comparison of Human Embryonic Stem Cell-Derived Cardiomyocytes, Cardiovascular Progenitors, and Bone Marrow Mononuclear Cells for Cardiac Repair. Stem Cell Reports. 2015;5(5):753-62.
- Fisher SA, Zhang H, Doree C, Mathur A, Martin‐Rendon E. Stem cell treatment for acute myocardial infarction. Cochrane Database of Systematic Reviews. 2015(9).
- Malliaras K, Makkar RR, Smith RR, Cheng K, Wu E, Bonow RO, et al. Intracoronary Cardiosphere-Derived Cells After Myocardial Infarction: Evidence of Therapeutic Regeneration in the Final 1-Year Results of the CADUCEUS Trial (CArdiosphere-Derived aUtologous stem CElls to reverse ventricUlar dySfunction). Journal of the American College of Cardiology. 2014;63(2):110-22.
- Maguire G. Stem cell therapy without the cells. Communicative & integrative biology. 2013;6(6):e26631.
- Patschan D, Plotkin M, Goligorsky MS. Therapeutic use of stem and endothelial progenitor cells in acute renal injury: ça ira. Current Opinion in Pharmacology. 2006;6(2):176-83.
- Tögel F, Hu Z, Weiss K, Isaac J, Lange C, Westenfelder C. Administered mesenchymal stem cells protect against ischemic acute renal failure through differentiation-independent mechanisms. American Journal of Physiology-Renal Physiology. 2005;289(1):F31-F42.
- Gnecchi M, Zhang Z, Ni A, Dzau VJ. Paracrine mechanisms in adult stem cell signaling and therapy. Circ Res. 2008;103(11):1204-19.
- Gray WD, French KM, Ghosh-Choudhary S, Maxwell JT, Brown ME, Platt MO, et al. Identification of Therapeutic Covariant MicroRNA Clusters in Hypoxia-Treated Cardiac Progenitor Cell Exosomes Using Systems Biology. Circulation Research. 2015;116(2):255-63.
- Karimi M, Zare H, Bakhshian Nik A, Yazdani N, Hamrang M, Mohamed E, et al. Nanotechnology in diagnosis and treatment of coronary artery disease. Nanomedicine. 2016;11(5):513-30.
- Lewis DR, Kamisoglu K, York AW, Moghe PV. Polymer-based therapeutics: nanoassemblies and nanoparticles for management of atherosclerosis. WIREs Nanomedicine and Nanobiotechnology. 2011;3(4):400-20.
- Flores AM, Ye J, Jarr K-U, Hosseini-Nassab N, Smith BR, Leeper NJ. Nanoparticle Therapy for Vascular Diseases. Arteriosclerosis, Thrombosis, and Vascular Biology. 2019;39(4):635-46.
- Doshi N, Prabhakarpandian B, Rea-Ramsey A, Pant K, Sundaram S, Mitragotri S. Flow and adhesion of drug carriers in blood vessels depend on their shape: A study using model synthetic microvascular networks. Journal of Controlled Release. 2010;146(2):196-200.
- Gupta AS. Nanomedicine approaches in vascular disease: a review. Nanomedicine: Nanotechnology, Biology and Medicine. 2011;7(6):763-79.
- Srinivasan R, Marchant RE, Gupta AS. In vitro and in vivo platelet targeting by cyclic RGD‐modified liposomes. Journal of Biomedical Materials Research Part A: An Official Journal of The Society for Biomaterials, The Japanese Society for Biomaterials, and The Australian Society for Biomaterials and the Korean Society for Biomaterials. 2010;93(3):1004-15.
- Reddy MK, Vasir JK, Sahoo SK, Jain TK, Yallapu MM, Labhasetwar V. Inhibition of Apoptosis Through Localized Delivery of Rapamycin-Loaded Nanoparticles Prevented Neointimal Hyperplasia and Reendothelialized Injured Artery. Circulation: Cardiovascular Interventions. 2008;1(3):209-16.
- Masuda S, Nakano K, Funakoshi K, Zhao G, Meng W, Kimura S, et al. Imatinib Mesylate-Incorporated Nanoparticle-Eluting Stent Attenuates In-Stent Neointimal Formation in Porcine Coronary Arteries. Journal of Atherosclerosis and Thrombosis. 2011;18(12):1043-53.
- Bozsak F, Gonzalez-Rodriguez D, Sternberger Z, Belitz P, Bewley T, Chomaz J-M, Barakat AI. Optimization of Drug Delivery by Drug-Eluting Stents. PLOS ONE. 2015;10(6):e0130182.
- Smith BR, Edelman ER. Nanomedicines for cardiovascular disease. Nature Cardiovascular Research. 2023;2(4):351-67.
- Kim TG, Lee Y, Park TG. Controlled gene-eluting metal stent fabricated by bio-inspired surface modification with hyaluronic acid and deposition of DNA/PEI polyplexes. International Journal of Pharmaceutics. 2010;384(1):181-8.
- Paul A, Shao W, Shum-Tim D, Prakash S. The attenuation of restenosis following arterial gene transfer using carbon nanotube coated stent incorporating TAT/DNAAng1+Vegf nanoparticles. Biomaterials. 2012;33(30):7655-64.
- Joo J-r, Nam H-Y, Nam S-H, Baek I-S, Park J-S. Thermal process for enhancing mechanical strength of PLGA nanoparticle layers on coronary stents. Bulletin of the Korean Chemical Society. 2009;30(9):1985-8.
- Kamaly N, Fredman G, Fojas JJR, Subramanian M, Choi W, II, Zepeda K, et al. Targeted Interleukin-10 Nanotherapeutics Developed with a Microfluidic Chip Enhance Resolution of Inflammation in Advanced Atherosclerosis. ACS Nano. 2016;10(5):5280-92.
- Sager HB, Dutta P, Dahlman JE, Hulsmans M, Courties G, Sun Y, et al. RNAi targeting multiple cell adhesion molecules reduces immune cell recruitment and vascular inflammation after myocardial infarction. Science Translational Medicine. 2016;8(342):342ra80-ra80.
- Winter PM, Caruthers SD, Zhang H, Williams TA, Wickline SA, Lanza GM. Antiangiogenic synergism of integrin-targeted fumagillin nanoparticles and atorvastatin in atherosclerosis. JACC Cardiovasc Imaging. 2008;1(5):624-34.
- Kawata H, Uesugi Y, Soeda T, Takemoto Y, Sung J-H, Umaki K, et al. A New Drug Delivery System for Intravenous Coronary Thrombolysis With Thrombus Targeting and Stealth Activity Recoverable by Ultrasound. Journal of the American College of Cardiology. 2012;60(24):2550-7.
- Pawlowski CL, Li W, Sun M, Ravichandran K, Hickman D, Kos C, et al. Platelet microparticle-inspired clot-responsive nanomedicine for targeted fibrinolysis. Biomaterials. 2017;128:94-108.
- Bi F, Zhang J, Su Y, Tang Y-C, Liu J-N. Chemical conjugation of urokinase to magnetic nanoparticles for targeted thrombolysis. Biomaterials. 2009;30(28):5125-30.
- Palekar RU, Jallouk AP, Myerson JW, Pan H, Wickline SA. Inhibition of Thrombin With PPACK-Nanoparticles Restores Disrupted Endothelial Barriers and Attenuates Thrombotic Risk in Experimental Atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 2016;36(3):446-55.
- Farooqi KM, Sengupta PP. Echocardiography and Three-Dimensional Printing: Sound Ideas to Touch a Heart. Journal of the American Society of Echocardiography. 2015;28(4):398-403.
- Vukicevic M, Mosadegh B, Min JK, Little SH. Cardiac 3D Printing and its Future Directions. JACC: Cardiovascular Imaging. 2017;10(2):171-84.
- Lindquist EM, Gosnell JM, Khan SK, Byl JL, Zhou W, Jiang J, Vettukattil JJ. 3D printing in cardiology: A review of applications and roles for advanced cardiac imaging. Annals of 3D Printed Medicine. 2021;4:100034.
- Byrne N, Velasco Forte M, Tandon A, Valverde I, Hussain T. A systematic review of image segmentation methodology, used in the additive manufacture of patient-specific 3D printed models of the cardiovascular system. JRSM cardiovascular disease. 2016;5:2048004016645467.
- Garekar S, Bharati A, Chokhandre M, Mali S, Trivedi B, Changela VP, et al. Clinical Application and Multidisciplinary Assessment of Three Dimensional Printing in Double Outlet Right Ventricle With Remote Ventricular Septal Defect. World Journal for Pediatric and Congenital Heart Surgery. 2016;7(3):344-50.
- Shen Y, Cui J, Yu X, Song J, Cai P, Guo W, et al. Recent advances in three-dimensional printing in cardiovascular devices: Bench and bedside applications. Smart Materials in Medicine. 2024;5(1):36-51.
- Javan R, Herrin D, Tangestanipoor A. Understanding Spatially Complex Segmental and Branch Anatomy Using 3D Printing: Liver, Lung, Prostate, Coronary Arteries, and Circle of Willis. Academic Radiology. 2016;23(9):1183-9.
- Russ M, O’Hara R, Nagesh SS, Mokin M, Jimenez C, Siddiqui A, et al., editors. Treatment planning for image-guided neuro-vascular interventions using patient-specific 3D printed phantoms. Medical Imaging 2015: Biomedical Applications in Molecular, Structural, and Functional Imaging; 2015: SPIE.







