2024 – năm của Tim mạch học:
10 nghiên cứu hàng đầu trong lĩnh vực tim mạch – ung thư
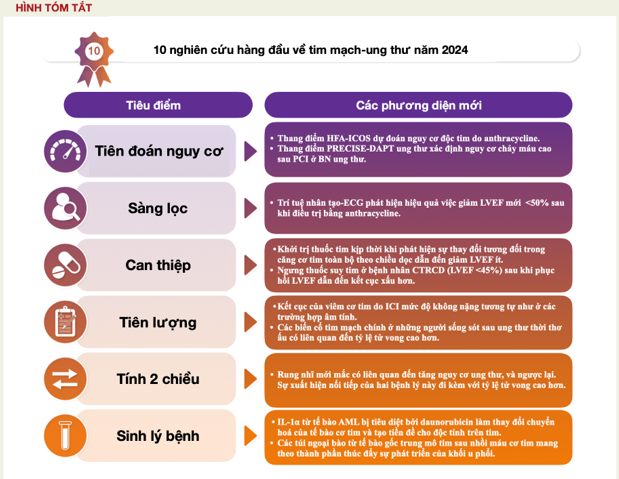
Một trong những công trình nền tảng trong lĩnh vực tim mạch–ung thư năm 2024 là nghiên cứu của Rivero-Santana và cộng sự về giá trị dự báo và tiên lượng của bảng điểm nguy cơ HFA-ICOS đối với độc tính tim do anthracycline. Phân tầng nguy cơ độc tính tim ngay từ ban đầu là một thành tố then chốt trong Hướng dẫn Tim mạch–Ung thư của Hội Tim mạch châu Âu năm 2022, giúp định hướng mức độ và tần suất giám sát, đồng thời có thể ảnh hưởng tới khuyến nghị về các chiến lược dự phòng.Trong phân tích trên 1066 bệnh nhân trong cơ sở dữ liệu CardioTox registry, nhóm nghiên cứu nhận thấy: 53.6% bệnh nhân thuộc nhóm nguy cơ thấp, 31.2% nguy cơ trung bình, 15.2% nguy cơ cao đến rất cao. Nguy cơ mắc rối loạn chức năng tim liên quan điều trị ung thư (CTRCD) có triệu chứng hoặc mức độ vừa/nặng tăng theo phân tầng HFA-ICOS với tỉ số nguy cơ (HR, KTC 95%):
- Thấp: 1 (tham chiếu)
- Trung bình: 3.2 (1.6–6.4)
- Cao: 10.3 (5.4–19.8)
- Rất cao: 28,7 (9.3–88.5) (p < 0.001).
Tương tự, nguy cơ tử vong toàn bộ cũng tăng theo mức nguy cơ:
- Thấp: 1 (tham chiếu),
- Trung bình: 2.1 (1.5–2.9),
- Cao: 4.4 (3.0–6.1),
- Rất cao: 7.3 (3.2–17.2) (p < 0.001).
Như vậy, bảng điểm HFA-ICOS có khả năng phân tầng hiệu quả cả nguy cơ CTRCD lẫn nguy cơ tử vong toàn bộ ở bệnh nhân điều trị anthracycline, ủng hộ việc áp dụng trong thực hành lâm sàng.
Trong một nghiên cứu khác, Zhou và cộng sự chỉ ra rằng nguy cơ độc tim do anthracycline còn bị ảnh hưởng bởi tác động của điều trị ung thư lên khối u. Ở bệnh nhân bạch cầu cấp dòng tủy (AML), suy tim có thể xuất hiện sớm ngay cả khi dùng liều anthracycline thấp. Phù hợp với quan sát lâm sàng này, chuột hoang dã không xuất hiện độc tính tim với daunorubicin liều thấp, nhưng chuột mang AML lại có. Lời giải thích cho quan sát này rằng tế bào AML khi bị daunorubicin tiêu diệt sẽ giải phóng IL-1α. IL-1α gắn vào thụ thể IL-1R1 trên tế bào cơ tim, gây hoạt hóa NFkB và ức chế biểu hiện PGC-1α của tế bào cơ tim dẫn đến giảm sử dụng acid béo và sản xuất ATP ty thể. Điều trị bằng kháng thể kháng IL-1α chứng minh có hiệu quả cản trở chuỗi cơ chế này và giảm rối loạn chức năng tim do daunorubicin trong mẫu hình AML. Tổng hợp lại, nghiên cứu chỉ ra tẩm quan trọng trong tương tác qua lại giữa khối u và tim trong việc biểu lộ độc tính tim.
Kế thừa các báo cáo trước, Caller và cộng sự phát hiện rằng chuột bị rối loạn chức năng thất trái sau gây nhồi máu cơ tim (NMCT), khối u phổi tại chỗ và di căn phát triển lớn hơn so với chuột chứng (sham-MI) sau 28 ngày. Ngay sau NMCT, tế bào gốc trung mô tim (cMSCs) sản xuất số lượng thể tiết ngoại bào (EVs) gấp hơn 2 lần so với nhóm chứng. Các EVs này mang nhiều miRs và cytokine thúc đẩy u tương tự như các chất trong sinh bệnh ung thư, đồng thời “huấn luyện” đại thực bào thành kiểu hình tiết cytokine hoạt hóa ung thư. Tuy nhiên, tác động của các EVs do cMSCs tiết ra sau nhồi máu cơ tim không đồng nhất trên tất cả các dòng tế bào ung thư: chúng thúc đẩy mạnh sự tăng sinh và di căn của tế bào ung thư phổi và đại tràng, nhưng chỉ có ảnh hưởng khiêm tốn hoặc hầu như không có đối với tế bào ung thư vú và melanoma. Về quan điểm điều trị, spironolactone làm giảm sản xuất EVs, từ đó ức chế tăng trưởng khối u sau NMCT. Tổng thể, nghiên cứu này cung cấp cái nhìn mới về cơ chế quan trọng về tương tác tim mạch-ung thư ngược chiều.
Chỉ số sức căng cơ tim (strain) đã được chứng minh nhạy hơn phân suất tống máu trong phát hiện sớm thay đổi chức năng tim ở bệnh nhân ung thư trải qua các liệu pháp độc tim. Câu hỏi đặt ra: việc khởi trị sớm chẹn beta và ức chế men chuyển (ACEI) có cải thiện tiên lượng không?
Nghiên cứu SUCCOUR-MRI đã đánh giá lại vấn đề này bằng cách dùng CMR (MRI tim) thay cho siêu âm tim để đo phân suất tống máu thất trái (LVEF) ở thời điểm ban đầu và sau 1 năm. Trong thử nghiệm gốc, các nhà nghiên cứu dùng siêu âm tim và dẫn đến các kết quả không rõ ràng. Siêu âm tim vẫn được sử dụng để theo dõi định kỳ bệnh nhân và thuốc tim mạch được khởi trị khi ghi nhận sự thay đổi tương đối 12% đơn độc của căng cơ tim toàn bộ theo chiều dọc (GLS). Dấu hiệu này xuất hiện ở 105 trong số 333 bệnh nhân đang điều trị bằng anthracycline. 105 bệnh nhân này được phân ngẫu nhiên vào nhóm dùng thuốc chẹn beta (bisoprolol hoặc metoprolol) kết hợp với ức chế men chuyển (ramipril, hoặc nếu không dung nạp thì dùng thuốc chẹn thụ thể angiotensin) hoặc không can thiệp. Khi đánh giá bằng cộng hưởng từ tim mạch (CMR), sự khác biệt có ý nghĩa về thay đổi LVEF từ ban đầu đến sau 1 năm được ghi nhận giữa nhóm can thiệp và nhóm chứng [−2.5 ± 5.4% so với −5.6 ± 5.9%, P = 0.009; chênh lệch LVEF giữa hai nhóm −3.6% (−1.8% – −5.5%), P < 0.001]. Với việc đạt tiêu chí chính, các dữ liệu này chính thức củng cố khái niệm nên khởi trị liệu pháp điều hòa thần kinh–nội tiết ngay khi có dấu hiệu sớm của độc tính tim.
Việc sàng lọc và phát hiện sớm độc tính tim là rất quan trọng, tuy nhiên các phương tiện chẩn đoán hình ảnh thường tốn kém và phức tạp về mặt logistics, do đó thường không được chỉ định thường quy, đặc biệt là không thực hiện nối tiếp trong thời gian dài. Sự phát triển của trí tuệ nhân tạo (AI) có thể mở ra những chiến lược thay thế, chẳng hạn như áp dụng AI trên điện tâm đồ 12 chuyển đạo (AI-ECG) để phát hiện tình trạng LVEF giảm.
Trong một nghiên cứu, Jacobs và cộng sự áp dụng thuật toán AI-ECG (phát triển trên quần thể chung) cho 703 bệnh nhân ung thư vú sau điều trị anthracycline và phát hiện nó có hiệu quả tương đương trong việc nhận diện giảm LVEF mới dưới 50% (diện tích dưới đường cong – AUC: 0.93). Giá trị tiên đoán âm (NPV) đặc biệt cao (98%), trong khi giá trị tiên đoán dương vẫn gần 50%. Điều này cho thấy cơ hội ứng dụng kỹ thuật này trong giám sát dài hạn, đặc biệt khi dữ liệu ECG có thể thu được từ các thiết bị đeo, mở ra mô hình sàng lọc độc tính tim lâu dài, tiết kiệm chi phí và thuận tiện.
Một câu hỏi thường gặp là liệu có thể ngừng thuốc điều trị bệnh cơ tim/suy tim ở những bệnh nhân đã được bắt đầu điều trị vì rối loạn chức năng tim liên quan điều trị ung thư (CTRCD) sau khi chức năng tim đã hồi phục và quá trình điều trị ung thư đã hoàn tất hay không? Park và cộng sự đã nghiên cứu 277 bệnh nhân được chẩn đoán mới CTRCD, được định nghĩa là giảm phân suất tống máu thất trái (LVEF) >10% so với ban đầu, hoặc LVEF< 55% sau điều trị. Trong số này, 134 bệnh nhân (48.3%) – trong đó 72% mắc ung thư vú và 51% có liên quan anthracycline – cho thấy cải thiện chức năng tâm thu thất trái, được định nghĩa là tăng LVEF ít nhất 10% so với thời điểm chẩn đoán CTRCD. Trong số 134 bệnh nhân này, 44 người ngừng điều trị tim mạch và phải đối mặt với nguy cơ nhập viện vì suy tim hoặc giảm LVEF ≥10% trong vòng 2 năm cao gấp 3 lần so với những người tiếp tục dùng thuốc. Mức giảm LVEF tại thời điểm chẩn đoán CTRCD cho phép phân tầng nguy cơ: ở bệnh nhân có LVEF từ 45%–55%, LVEF trở về bình thường và không có khác biệt giữa nhóm tiếp tục và ngừng thuốc. Ngược lại, ở bệnh nhân có LVEF <45%, LVEF thấp hơn ở cả hai nhóm và đặc biệt thấp hơn rõ rệt ở nhóm ngừng so với nhóm tiếp tục điều trị (48 ± 7% so với 53 ± 6%, P < 0.001). Kết luận: việc ngừng thuốc tim mạch có thể được cân nhắc ở bệnh nhân CTRCD chỉ có suy giảm nhẹ LVEF, nhưng không được khuyến cáo ở những bệnh nhân có mức độ suy giảm chức năng tim nặng hơn
Viêm cơ tim do thuốc ức chế điểm kiểm soát miễn dịch (ICI myocarditis) có thể biểu hiện dưới dạng lâm sàng tối cấp (nặng) hoặc không tối cấp (không nặng). Itzhaki Ben Zadok và cộng sự đã mô tả sự khác biệt về kết cục giữa hai thể bệnh này trong một đoàn hệ liên tiếp gồm 160 bệnh nhân nghi ngờ viêm cơ tim do ICI. Tỷ lệ tử vong tim mạch cao gấp 6.5 lần ở 28 bệnh nhân viêm cơ tim nặng so với 96 bệnh nhân viêm cơ tim không nặng và cao gấp 3.7 lần so với 36 bệnh nhân không được xác nhận viêm cơ tim. Đáng chú ý, bệnh nhân viêm cơ tim không nặng không có tỷ lệ tử vong tim mạch cao hơn so với nhóm không viêm cơ tim và tỷ lệ tử vong toàn bộ cũng không khác biệt giữa ba nhóm. Tỷ lệ tái nhập viện vì tim mạch cũng không khác biệt đáng kể ở cả 3 nhóm. Quan trọng hơn, 12 bệnh nhân viêm cơ tim không nặng và 2 bệnh nhân viêm cơ tim nặng được tái đánh giá trong vòng 6 và 12 tháng, và không ai bị viêm cơ tim tái phát. Dù chưa đủ cơ sở để đưa ra khuyến cáo chung, các dữ liệu này có giá trị khi bàn về vấn đề có nên tái đánh giá sau viêm cơ tim do ICI và liên quan lâu dài của viêm cơ tim do ICI ở bệnh nhân ung thư có kết cục thuận lợi.
Tiếp nối hướng nghiên cứu về tác động tiên lượng của biến cố tim mạch lớn (MCEs) ở bệnh nhân ung thư, Bottinor và cộng sự đã phân tích nguy cơ tử vong toàn bộ và tử vong do tim mạch trên 25,658 người sống sót sau ung thư thời thơ ấu và 5,051 anh/chị em sau khi mắc suy tim (HF), bệnh động mạch vành (CAD – gây nhồi máu cơ tim hoặc cần tái thông mạch), hoặc đột quỵ. Tỷ lệ MCE cao hơn ở nhóm sống sót ung thư thời thơ ấu (6.9% so với 1.8%) và liên quan tiên lượng xấu hơn. So với anh/chị em, nguy cơ tử vong toàn bộ tăng 7.3 lần sau HF; 5.5 lần sau CAD; 3.6 lần sau đột quỵ. Nguy cơ tử vong chuyên biệt do CAD cao gấp 3.7 lần ở nhóm sống sót ung thư thời thơ ấu khi so với anh/chị em. Khi so sánh với quần thể CARDIA, người có tuổi trung bình > 26 khi bị biến cố tim mạch chính, nguy cơ tử vong là tương tự, ngoại trừ tử vong toàn bộ sau CAD cao hơn 1.9 lần ở người sống sót ung thư thời thơ ấu. Điều này cho thấy người sống sót ung thư thời thơ ấu kém khả năng hồi phục sau MCE và dễ tử vong hơn do chính biến cố tim mạch hoặc do các bệnh mạn tính khác như ung thư.
Bệnh nhân ung thư có nguy cơ cao hơn mắc rung nhĩ (AF), và bệnh nhân rung nhĩ cũng có nguy cơ cao hơn bị ung thư. Lần đầu tiên, Chen và cộng sự đã khai thác dữ liệu toàn quốc để phân tích mối liên hệ hai chiều này, ví dụ trong đoàn hệ AF: 320,000 bệnh nhân rung nhĩ mới mắc và đoàn hệ ung thư: 470,000 bệnh nhân ung thư mới mắc. Tỷ lệ hiện mắc ung thư ở nhóm AF: 12.6% so với 5.6% ở nhóm chứng. Nguy cơ mắc ung thư trong 1 năm: 2.5% ở bệnh nhân AF so với 1.8% ở chứng (HR hiệu chỉnh 1.52; KTC 95% 1.46–1.58), không phụ thuộc loại ung thư. Ngược lại, tỷ lệ hiện mắc AF ở nhóm ung thư: 7.5% so với 4.3% ở chứng. Nguy cơ mắc AF trong 1 năm: 2.8% ở bệnh nhân ung thư so với 1.2% ở chứng (HR hiệu chỉnh 2.78; KTC 95% 2.69–2.87). Một số loại ung thư (thực quản, dạ dày, phổi, tủy, lymphoma) có nguy cơ AF cao hơn rõ rệt. Quan trọng là phát triển ung thư sau AF, hoặc AF sau ung thư, đều làm tăng tử vong toàn bộ (HR hiệu chỉnh tương ứng 7.77 và 2.55).
Bản tổng quan năm nay mở đầu bằng dự báo nguy cơ và cũng kết thúc bằng dự báo nguy cơ. Thang điểm PRECISE-DAPT vốn dùng để lượng giá nguy cơ chảy máu ngoại trú ≥7 ngày sau can thiệp mạch vành qua da (PCI). Tuy nhiên, công cụ này có thể đánh giá thấp nguy cơ chảy máu ở bệnh nhân ung thư.
Dafaalla và cộng sự đã xây dựng phiên bản chuyên biệt cho bệnh nhân ung thư – Thang điểm mới bao gồm toàn bộ 4 biến số của phiên bản đơn giản trước đó, cộng thêm tiền sử hoặc chẩn đoán ung thư hiện tại– trên gần 220.000 bệnh nhân nhồi máu cơ tim ST chênh lên (tỷ lệ xây dựng/xác thực là 75%/25%). Thang điểm giúp xác định 94% bệnh nhân ung thư sau PCI thuộc nhóm nguy cơ chảy máu cao, so với 66% theo thang điểm gốc. Giá trị chính của thang điểm ung thư mới (cũng như thang điểm gốc) có thể nằm ở giá trị tiên đoán âm (NPV) cao, đạt 97%, tức là khả năng xác định những bệnh nhân ung thư thực sự không thuộc nhóm nguy cơ cao.
Lược dịch từ The year in cardiovascular medicine 2024: the top 10 papers in cardio-oncology
2024 – năm của Tim mạch học:
10 nghiên cứu hàng đầu về rối loạn lipid máu

Trong năm nay, những tiến bộ đáng chú ý trong lĩnh vực lipid đã bổ sung các liệu pháp mới vào “kho vũ khí” thuốc hạ lipid máu của chúng ta, đồng thời mang lại những hiểu biết mới về các chỉ dấu sinh học. Một nghiên cứu gần đây của UK Biobank trên 293,876 người trưởng thành không mắc bệnh tim mạch tại thời điểm ban đầu, đã đánh giá liệu việc đo LDL-C, non-HDL-C và triglycerid có cung cấp đủ thông tin cho chăm sóc lâm sàng hay không. Kết quả cho thấy ApoB là chỉ dấu chính xác hơn về nguy cơ tim mạch so với LDL-C hoặc non-HDL-C. Với một giá trị apoB nhất định, có thể tồn tại một khoảng rộng các giá trị LDL-C, non-HDL-C hoặc triglycerid; trong đó, apoB vẫn thừa thông tin quan trọng để dự đoán các biến cố bệnh tim mạch xơ vữa (ASCVD) mới khởi phát. Tuy nhiên, việc nhắm mục tiêu điều trị dựa trên apoB thay vì LDL-C có mang lại lợi ích vượt trội trong các thử nghiệm can thiệp hay không vẫn cần được tiếp tục làm rõ.
Thách thức cách tiếp cận hiện tại điều trị hạ cholesterol theo từng bước sau nhồi máu cơ tim, một nghiên cứu gần đây trên 56,262 bệnh nhân nhồi máu cơ tim từ cơ sở dữ liệu SWEDHEART cho thấy: những bệnh nhân đạt được mục tiêu non-HDL-C sớm và duy trì ổn định (< 2,2 mmol/L) có nguy cơ thấp nhất đối với tất cả các biến cố. Phân tích thứ cấp cho thấy những bệnh nhân thuộc nhóm tứ phân vị có mức giảm non-HDL-C lớn nhất sau 2 tháng cũng có tỷ lệ biến cố thấp nhất. Ở những bệnh nhân đạt mức giảm non-HDL-C ≥ 46% sau 1 năm, tỷ lệ sử dụng statin cường độ cao hoặc phối hợp statin cường độ cao với ezetimibe cao hơn. Những kết quả này khẳng định rằng việc sử dụng liệu pháp phối hợp làm tăng đáng kể khả năng đạt được mục tiêu lipid nhằm giảm nguy cơ tim mạch.
Nhờ hiệu quả mạnh mẽ trong việc hạ LDL-C, điều trị bằng kháng thể đơn dòng kháng PCSK9 đã trở thành một lựa chọn điều trị quan trọng. Lerodalcibep là một adnectin có miền gắn kết với PCSK9 với ái lực cao, được tiêm dưới da hàng tháng với liều 300 mg và không cần bảo quản lạnh. Một thử nghiệm lâm sàng pha 3, ngẫu nhiên, đối chứng giả dược đã đánh giá hiệu quả của lerodalcibep ở những bệnh nhân mắc bệnh tim mạch đang sử dụng liều tối đa statin dung nạp được kết hợp với các thuốc hạ lipid đường uống khác, có LDL-C ≥ 70 mg/dL (1.8 mmol/L) hoặc ≥ 100 mg/dL (2.58 mmol/L) nếu nguy cơ tim mạch cao và triglycerid ≤ 400 mg/dL (4.51 mmol/L). Trong nghiên cứu, 992 bệnh nhân được phân ngẫu nhiên nhận lerodalcibep 300 mg hoặc giả dược hàng tháng trong 48 tuần. Mức giảm LDL-C trung bình so với giả dược và mức trung bình ở tuần 50–52 lần lượt là 56.2% (±2.2%) và 62.7%. Tổng cộng 555 trong số 615 bệnh nhân (90%) đạt cả hai tiêu chí: giảm LDL-C ≥ 50% và đạt mục tiêu LDL-C khuyến cáo (≤ 55 mg/dL [1.42 mmol/L] đối với bệnh nhân có bệnh tim mạch và ≤ 70 mg/dL [1.81 mmol/L] đối với bệnh nhân nguy cơ tim mạch cao). Lerodalcibep cũng làm giảm đáng kể non-HDL-C, VLDL-C, apoB, Lp(a) và triglycerid (tất cả P < 0.001). Tác dụng phụ thường gặp là phản ứng tại chỗ tiêm mức độ nhẹ đến trung bình (6.9% ở nhóm dùng lerodalcibep so với 0.3% ở nhóm giả dược) và 0.4% số người tham gia (n = 22) xuất hiện kháng thể trung hòa trong ống nghiệm.
Mặc dù fibrate có tác dụng hạ triglycerid và lipoprotein giàu triglycerid, các nghiên cứu chưa chứng minh được lợi ích trong việc giảm các biến cố tim mạch mới, từ đó thúc đẩy sự phát triển của các thuốc vừa giảm phần dư lipoprotein vừa giảm nồng độ apoB. Angiopoietin-like 3 (ANGPTL3) ức chế hoạt tính của lipoprotein lipase và endothelial lipase; những cá thể mang dị hợp tử đột biến mất chức năng của ANGPTL3 có nồng độ hầu hết các lipoprotein lưu hành thấp hơn và nguy cơ ASCVD thấp hơn. Evinacumab, một kháng thể đơn dòng nhắm vào ANGPTL3, đã được chấp thuận để điều trị bệnh nhân tăng cholesterol máu có tính chất gia đình thể đồng hợp tử (HoFH). Một nghiên cứu dài hạn gần đây về hiệu quả và độ an toàn cho thấy evinacumab giúp giảm LDL-C khoảng 44% ở một nhóm lớn bệnh nhân HoFH (102 người lớn và 14 thanh thiếu niên) được điều trị với thời gian trung vị 104 tuần. Mức giảm LDL-C trung bình là 41.7% ở người lớn và 55.4% ở thanh thiếu niên. Evinacumab cũng làm giảm đáng kể apoB, non-HDL-C, cholesterol toàn phần, triglycerid khi đói và Lp(a). Nhìn chung, evinacumab dung nạp tốt, khẳng định hiệu quả và độ an toàn được duy trì trong dài hạn.
Zodasiran là một RNA can thiệp nhỏ làm giảm biểu hiện của ANGPTL3. Hiệu quả hạ lipid và độ an toàn của thuốc này ở người lớn bị rối loạn lipid máu hỗn hợp đã được khảo sát trong một thử nghiệm đa trung tâm, mù đôi, có đối chứng trên các bệnh nhân có triglycerid lúc đói từ 150–499 mg/dL (1.69–5.63 mmol/L) và đồng thời có mức LDL-C ≥ 70 mg/dL (1.81 mmol/L) hoặc non-HDL-C ≥ 100 mg/dL (2.59 mmol/L). Tổng cộng 204 bệnh nhân được phân ngẫu nhiên nhận zodasiran 50, 100 hoặc 200 mg hoặc giả dược vào Ngày 1 và Tuần 12, sau đó được theo dõi đến Tuần 36. Ở Tuần 24, kết quả cho thấy mức giảm triglycerid đáng kể phụ thuộc liều: −51%, −57% và −63% tương ứng với các liều 50, 100 và 200 mg, đồng thời mức ANGPTL3 cũng giảm phụ thuộc liều. Thay đổi apoB so với ban đầu lần lượt là −19%, −15% và −22% ở ba nhóm liều. Có sự tăng nhẹ HbA1c, chủ yếu ở bệnh nhân đái tháo đường sẵn có, trong khi chỉ số đề kháng insulin (HOMA-IR) không thay đổi.
Apolipoprotein C-III ức chế lipoprotein lipase, từ đó làm giảm quá trình ly giải lipid do lipoprotein lipase, thúc đẩy bài tiết VLDL ở gan, hình thành chylomicron, và ức chế quá trình thanh thải lipoprotein giàu triglycerid tại gan. Plozasiran, một siRNA gắn N-acetylgalactosamine có tác dụng giảm biểu hiện APOC3 ở gan, đã được đánh giá trong thử nghiệm ngẫu nhiên, mù đôi, có đối chứng giả dược pha 2b ở bệnh nhân có triglycerid từ 150–499 mg/dL và đồng thời LDL-C ≥ 70 mg/dL (1.81 mmol/L) hoặc non-HDL-C ≥ 100 mg/dL (2.59 mmol/L). Tổng cộng 353 bệnh nhân được phân ngẫu nhiên nhận plozasiran hoặc giả dược. Người tham gia được tiêm plozasiran 10, 25 hoặc 50 mg, hoặc giả dược vào Ngày 1 và Tuần 12 (liều quý); trong khi nhóm thứ tư nhận plozasiran 50 mg hoặc giả dược vào Ngày 1 và Tuần 24 (liều nửa năm). So với giả dược, mức thay đổi theo giá trị trung bình ước lượng theo phương pháp bình phương tối thiểu của triglycerid so với ban đầu là −49.8%, −56.0% và −62.4% đối với liều 10, 25, và 50 mg (mỗi quý), và −44.2% đối với liều 50 mg (nửa năm). Mức thay đổi apoB so với giả dược là −10.3%, −13.0% và −19.1% ở liều 10, 25, và 50 mg (mỗi quý), và −6.5% ở liều 50 mg (nửa năm). Tình trạng kiểm soát đường huyết xấu đi ghi nhận ở 10% bệnh nhân nhóm giả dược và lần lượt ở 12%, 7%, 20% và 21% ở nhóm plozasiran 10, 25, 50 mg (mỗi quý) và 50 mg (nửa năm), với tỷ lệ cao hơn ở liều cao nhất; tuy nhiên chỉ số đề kháng insulin (HOMA-IR) không thay đổi. Không ghi nhận thay đổi số lượng tiểu cầu trung bình. Hai nghiên cứu này cho thấy rằng các thuốc này cần được nghiên cứu thêm trong các thử nghiệm đánh giá biến cố tim mạch để xác định vai trò điều trị.
Mặc dù các liệu pháp làm tăng HDL-C chưa chứng minh được hiệu quả trong việc giảm nguy cơ ASCVD, vẫn còn nhiều quan tâm đến việc liệu các điều trị cải thiện khả năng vận chuyển ngược cholesterol có thể mang lại lợi ích hay không. CSL112 là một apolipoprotein A1 từ người có thể được truyền tĩnh mạch, làm tăng gấp đôi nồng độ apolipoprotein A1 và tăng gấp bốn lần khả năng vận chuyển ngược cholesterol. CSL112 đã được kiểm nghiệm trong một thử nghiệm ngẫu nhiên, mù đôi, có đối chứng giả dược nhằm đánh giá lợi ích lâm sàng tiềm năng sau nhồi máu cơ tim cấp type 1. Trong nghiên cứu, 88% bệnh nhân đã được can thiệp mạch vành qua da cho biến cố khởi phát, đồng thời đang dùng statin và liệu pháp kháng tiểu cầu kép, được phân ngẫu nhiên để nhận 4 lần/ tuần truyền tĩnh mạch CSL112 hoặc giả dược, với liều truyền đầu tiên được thực hiện trong vòng 5 ngày sau nhồi máu cơ tim. Kết quả cho thấy không có sự giảm đáng kể nguy cơ của tiêu chí chính gộp (nhồi máu cơ tim, đột quỵ hoặc tử vong tim mạch) trong vòng 90 ngày giữa nhóm CSL112 và nhóm giả dược (439 bệnh nhân ở nhóm CSL112 so với 472 ở nhóm giả dược; HR 0.93; KTC 95%: 0.81–1.05; P = 0.24). Như vậy, việc sử dụng CSL112 ở bệnh nhân vừa trải qua nhồi máu cơ tim tiếp tục cho thấy sự thất bại của các liệu pháp tăng HDL trong việc giảm các biến cố ASCVD.
Lp(a) là một yếu tố nguy cơ quan trọng của ASCVD và hẹp van động mạch chủ, có hoạt tính viêm cao chủ yếu do giàu phospholipid oxy hóa. Các nghiên cứu trước đây gợi ý rằng nồng độ CRP độ nhạy cao (hs-CRP) có thể làm thay đổi mức độ nguy cơ liên quan đến Lp(a) tăng cao. Để khảo sát liệu tình trạng viêm hệ thống mức độ thấp có thể điều hòa mối liên quan giữa Lp(a) và nguy cơ bệnh động mạch vành (CHD) hay không, dữ liệu từ 71,678 người trong dân số chung đã được phân tích. Trong số những người không có bệnh động mạch vành tại thời điểm ban đầu, mức Lp(a) có liên quan đến nguy cơ mắc CHD trong tương lai độc lập với mức hs-CRP: nguy cơ giống nhau ở những người có hs-CRP < 2 mg/dL (HR 1.45; P < 0.001, so sánh nhóm ngũ phân vị cao nhất so với thấp nhất của Lp(a)) và ở những người có hs-CRP ≥ 2 mg/dL (HR 1.48; P < 0.001, so sánh nhóm ngũ phân vị cao nhất so với thấp nhất). Ngược lại, ở những người đã có bệnh động mạch vành (CHD) tại thời điểm ban đầu, nồng độ Lp(a) cao chỉ liên quan đến các biến cố tim mạch tương lai ở nhóm có hs-CRP ≥ 2 mg/dL và chỉ có ý nghĩa cận biên ở nhóm có hs-CRP < 2 mg/dL. Những quan sát này cho thấy không có sự tương tác giữa Lp(a) và hs-CRP trong dự phòng tiên phát, trong khi ở những bệnh nhân đã có CHD, mối quan hệ giữa Lp(a) và tình trạng viêm phức tạp hơn, có thể ảnh hưởng đến hiệu quả của các liệu pháp hạ Lp(a) trong tương lai.
Hiện nay, các thử nghiệm kết cục ASCVD với liệu pháp hạ nồng độ lipoprotein(a) [Lp(a)] trong tuần hoàn đang được tiến hành. Zerlasiran là một thuốc siRNA gắn N-acetylgalactosamine có tác dụng triệt gene (gene silencing) với thời gian tác động kéo dài. Trong một thử nghiệm giai đoạn 2, ngẫu nhiên, mù đôi, có đối chứng giả dược, 178 bệnh nhân ASCVD ổn định và có Lp(a) ≥ 125 nmol/L được phân ngẫu nhiên theo tỷ lệ 1:1:2:2:2 vào 5 nhóm: Tiêm dưới da giả dược mỗi 16 tuần, tổng cộng 3 liều (N = 23), 2 liều giả dược mỗi 24 tuần (N = 24), 2 liều Zerlasiran 450 mg mỗi 24 tuần (N = 45), 3 liều Zerlasiran 300 mg mỗi 16 tuần (N = 42), 2 liều Zerlasiran 300 mg mỗi 24 tuần (N = 44).
Kết quả cho thấy mức thay đổi giá trị trung bình ước lượng theo phương pháp bình phương tối thiểu hiệu chỉnh theo thời gian (least-squares mean time-averaged) về nồng độ Lp(a) ở Tuần 36 dao động từ −81.3% (KTC 95%: −87.6% đến −76.0%) đến −85.6%. Thay đổi trung vị phần trăm nồng độ Lp(a) từ ban đầu đến Tuần 36 dao động từ −90% (KTC 95%: −97.3% đến −81.3%) đến −96.4%. Thuốc dung nạp tốt, với phản ứng nhẹ tại chỗ tiêm xảy ra ở 2.3%–7.1% bệnh nhân.
Muvalaplin, một phân tử nhỏ có tác dụng ngăn chặn sự hình thành hạt Lp(a) bằng cách phá vỡ tương tác giữa apolipoprotein(a) và apoB, là thuốc đường uống đầu tiên có khả năng hạ Lp(a). Một thử nghiệm pha 2, mù đôi, có đối chứng giả dược đã phân ngẫu nhiên 233 bệnh nhân mắc ASCVD, đái tháo đường, hoặc tăng cholesterol máu có tính chất gia đình, với nồng độ Lp(a) ≥ 175 mmol/L vào các nhóm dùng muvalaplin đường uống hàng ngày liều 10 mg (N = 34), 60 mg (N = 64), 240 mg (N = 68) hoặc giả dược (N = 67) trong 12 tuần. Tiêu chí chính là mức thay đổi phần trăm hiệu chỉnh so với giả dược từ ban đầu đến tuần 12 về nồng độ Lp(a). Điều trị bằng muvalaplin cho thấy:
- Với xét nghiệm Lp(a) nguyên vẹn: thay đổi trung bình hiệu chỉnh lần lượt là −47.6% (KTC 95%: 35.1%–57.7%), −81.7% (KTC 95%: −78.1 đến −84.6%) và −85.8% (KTC 95%: −83.1 đến −88.0%) ở các liều 10, 60 và 240 mg.
- Với xét nghiệm dựa trên apolipoprotein(a): thay đổi lần lượt là −40.4% (KTC 95%: −28.3 đến −50.5%), −70.0% (KTC 95%: −65.0 đến −74.2%), và −68.9% (KTC 95%: −63.8 đến −73.3%).
Không ghi nhận các vấn đề đáng kể về an toàn hoặc khả năng dung nạp. Tuy nhiên, việc liệu bất kỳ thuốc nào trong nhóm này có vai trò trong thực hành lâm sàng hay không sẽ phụ thuộc vào kết quả của các thử nghiệm kết cục ASCVD đang được dự kiến thực hiện.
Lược dịch từ The Year in Cardiovascular Medicine 2024: the top 10 papers in dyslipidaemias







