I. MỞ ĐẦU
Suy tim là một hội chứng lâm sàng phức tạp, hậu quả của các rối loạn về cấu trúc và chức năng tim làm suy giảm chức năng đổ dầy hoặc tống máu của các tâm thất do rất nhiều các nguyên nhân gây bệnh khác nhau, bao gồm bệnh tim thiếu máu cục bộ, tăng huyết áp, bệnh van tim, bệnh cơ tim tiên phát, viêm cơ tim, bệnh cơ tim do thâm nhiễm và bệnh lý màng ngoài tim.
TS. BS. NGUYỄN THỊ MỸ HẠNH
Bệnh viện Nhân dân 115
Chẩn đoán suy tim sớm và xác định nguyên nhân gây suy tim có ý nghĩa quan trọng quyết định trong định hướng chăm sóc và điều trị suy tim, do chúng ta có thể chặn được tiến triển suy tim bằng những biện pháp điều trị chuyên biệt trong một số căn nguyên. Các kỹ thuật chẩn đoán hình ảnh không xâm nhập đóng vai trò trung tâm trong chẩn đoán, tiên lượng và theo dõi điều trị suy tim. Trong suy tim, hình ảnh học cần cung cấp các thông tin trả lời được 3 câu hỏi chính: 1/ Phân suất tống máu thất trái bảo tồn hay giảm?; 2/ Cấu trúc thất trái bình thường hay bất thường?; 3/ Có các bất thường về van tim, màng ngoài tim, thất phải có thể giải thích cho bệnh cảnh lâm sàng của bệnh nhân hay không?
Siêu âm tim hiện nay cũng như trong tương lai vẫn là phương tiện thông thường nhất được sử dụng để trả lời cho các câu hỏi này. Tuy nhiên, siêu âm tim có một số hạn chế, như phụ thuộc cửa sổ siêu âm, sử dụng giả định về hình thái thất trái cho định lượng chức năng toàn bộ thất trái, thông tin về đặc tính mô cơ tim rất hạn chế. Cộng hưởng từ tim mạch (CMR: Cardiovascular Magnetic Resonance) là một kỹ thuật chẩn đoán hình ảnh đang phát triển rất nhanh và được sử dụng ngày càng nhiều cho các bệnh nhân suy tim. CMR có thể trả lời cả 3 câu hỏi nêu trên trong một lần khảo sát. Vì vậy CMR là một kỹ thuật đầy tiềm năng trong chẩn đoán suy tim. Bên cạnh đó, tính chính xác và tính lặp lại cao của các thông số đo lường trên CMR khiến kỹ thuật này rất lý tưởng cho theo dõi diễn tiến, đánh giá hiệu quả điều trị và tiên lượng bệnh.Trong bài tổng quan này, chúng tôi xin được tổng hợp từ một số tài liệu về vai trò của CMR trong khảo sát các đặc tính về hình ảnh của bệnh nhân suy tim, giúp ích cho chẩn đoán, phân tầng nguy cơ và định hướng điều trị các bệnh nhân suy tim.
II. MỘT SỐ NGUYÊN LÝ CMR TRONG SUY TIM [1, 2]
Các máy MR 1.5 Tesla, thường được sử dụng nhiều trên lâm sàng, có từ trường mạnh hơn từ trường trái đất khoảng 30,000 lần. Cơ thể con người chứa rất nhiều các nguyên tử hydrogen. Khi cơ thể được đặt trong một từ trường mạnh như vậy, các nguyên tử hydrogen trong các mô của cơ thể sẽ nằm dọc theo hướng của từ trường. Các mô khác nhau chứa hydrogen với mật độ khác nhau. Sau đó, các chuỗi xung radiofrequency (các chuỗi xung tạo cộng hưởng từ) sẽ được phát ra từng đợt ngắn kích thích các nguyên tử hydrogen lên mức năng lượng cao hơn. Khi ngưng phát xung, các nguyên tử hydrogen trở về mức năng lượng ban đầu sẽ phát ra các tín hiệu. Các tín hiệu này sẽ được thu nhận bởi các cuộn thu (receiver coils). Trên hình ảnh MR, tín hiệu của một loại mô (như cơ tim, mỡ…) tùy thuộc vào mật độ các nguyên tử hydrogen của loại mô đó, đặc trưng bằng các thông số cơ bản như thời gian thư dãn theo chiều dọc (longitudinal relaxation time – T1), thời gian thư dãn theo chiều ngang (transverse relaxation time) và mật độ proton (proton density). Các thông số này thay đổi đáng kể theo các mô khác nhau, sự khác biệt này tạo nên độ tương phản của các mô khác nhau trên hình ảnh MR. Tương phản về hình ảnh MR có thể thay đổi khi thay đổi các chuỗi xung radiofrequency, vì dụ trên hình T1-weighted, nước có màu tối hơn cơ tim, mỡ có màu trắng, trong khi đó trên hình T2-weighted nước có màu trắng hơn cơ tim, mỡ có màu tối…
Chuỗi xung để tạo ra cộng hưởng từ bao gồm một loạt các xung radiofrequency. Một số các chuỗi xung căn bản được sử dụng trong CMR như các chuỗi xung spin echo chủ yếu để khảo sát giải phẫu và các đặc tính của các mô; các chuỗi xung gradient echo dùng cho hình ảnh cine khảo sát vận động của các cấu trúc của tim, trong đó các chuỗi xung SSFP cho hình ảnh tương phản tốt nhất giữa máu trong buồng tim (màu trắng) và cơ tim (màu tối), hiện được sử dụng thường quy trong hình cine để đánh giá chức năng tim; các chuỗi xung xóa mỡ (sử dụng các tiền xung đặc trưng: special pre-pulses) cho phép xóa các tín hiệu từ mô mỡ… Hiện nay, nhiều chuỗi xung mới vẫn đang trong quá trình thử nghiệm phát triển không ngừng.
Để ngăn nhiễu tín hiệu từ vận động của tim, các chuỗi xung nhanh được phát ra đồng bộ với sóng R trên ECG. Nhiễu từ hô hấp được hạn chế bằng cách thu hình ở cuối thì thở ra khi bệnh nhân nín thở.
CMR có thể cung cấp các thông tin quan trọng về hình ảnh trong suy tim như mức độ rối loạn chức năng vùng và toàn bộ cũng như tình trạng dãn và phì đại của thất trái và thất phải, bệnh lý căn nguyên của suy tim và các thành phần có thể thay đổi được trong diễn tiến của suy tim.
Khác với siêu âm, CMR có thể khảo sát bất cứ mặt cắt mong muốn nào của tim với hình ảnh trong vùng khảo sát gần như không bị hạn chế, cho phép đánh giá linh hoạt các cấu trúc bất thường của tim và ngoài tim. Cine MRI đánh giá thể tích, khối cơ, chức năng vùng và toàn bộ của hai thất với bất cứ hình dạng thực nào mà không cần giả định như siêu âm, và do đó có thể áp dụng cho mọi dạng hình thái và kích thước của tâm thất, kể cả những trường hợp tái cấu trúc thất lan rộng. Quan trọng hơn, các thông số về thể tích, khối cơ và chức năng các thất trên hình cine không chỉ có tính chính xác cao mà còn có tính lặp lại rất cao. Thêm vào đó, bản chất 3D vốn có của CMR giúp nó thích hợp cho khảo sát thất phải với hình thái phức tạp và biến thiên, rất khó đánh giá trên siêu âm tim. Hình ảnh cine MRI với các chuỗi xung SSFP có khả năng phân biệt rất tốt ranh giới giữa máu trong buồng thất và thành thất, rất thuận lợi cho phát hiện bất thường vận động vùng, dù là những vùng nhỏ và khó thấy. Cũng có thể đánh giá cấu trúc van trên hình cine, tuy nhiên siêu âm tim nói chung đánh giá hình thái van tốt hơn CMR.
Chuỗi xung velocity-encoding có khả năng định lượng mức độ hẹp van (đo vận tốc đỉnh) và hở van (đo thể tích và tỉ lệ trào ngược). Khi có shunt, có thể xác định Qp/Qs bằng cách đo dòng máu qua thân động mạch phổi và động mạch chủ lên.
Dựa trên hình ảnh T1W, T2W hoặc T1 và T2 map, có thể biết đặc tính mô cơ tim dựa vào đặc tính thư dãn tín hiệu theo chiều dọc và ngang khác nhau của các mô khác nhau như mỡ, cơ, mô viêm…
Để phát hiện xơ hóa cũng như sẹo cơ tim trên CMR, chất tương phản từ gadolinium-chelated được sử dụng bằng đường tĩnh mạch. Thể tích và phân bố của gadolinium tăng ở những vùng xơ hóa hoặc sẹo, thải trừ gadolinium ở những vùng này kéo dài bất thường so với cơ tim bình thường do mật độ của các mao mạch còn chức năng ở đây giảm. Đây là nền tảng cho hình ảnh tăng tín hiệu muộn với gadolinium (late gadolinium enhancement: LGE) với hình ảnh tim được chụp hình khoảng 10 phút sau tiêm tĩnh mạch gadolinium. Vùng xơ – sẹo có phân bố gadolinium ngoại bào tăng sẽ có thời gian T1 bị rút ngắn và do đó tăng tín hiệu, tương ứng với màu trắng. Trên hình ảnh khảo sát xơ – sẹo cơ tim, cơ tim bình thường được xóa tín hiệu (nulling) nên sẽ có màu đen, tạo nên độ tương phản hình ảnh tối ưu để dễ nhận diện mô cơ tim bị xơ – sẹo có màu trắng. Kỹ thuật này giúp mở rộng khả năng của CMR trong chẩn đoán suy tim. Kiểu phân bố của tăng tín hiệu muộn, tương ứng với kiểu phân bố của xơ – sẹo cơ tim giúp phân biệt suy tim do nguyên nhân nhồi máu cơ tim hay do những nguyên nhân không do thiếu máu cục bộ. Các kiểu phân bố chuyên biệt của xơ – sẹo cơ tim trên hình ảnh tăng tín hiệu muộn LGE giúp phân biệt một số bệnh cơ tim không do thiếu máu cục bộ. Kỹ thuật này cũng được áp dụng trong đánh giá tính sống còn cơ tim sau nhồi máu cơ tim.
Gắng sức bằng thuốc dãn mạch adenosine để phát hiện vùng cơ tim bị thiếu máu cục bộ được thực hiện với kỹ thuật first-pass perfusion với chất tương phản từ gadolinium. Adenosine được sử dụng trong khảo sát stress tưới máu có khả năng gây dãn mạch vành làm tăng lưu lượng mạch vành 3 đến 5 lần. Vùng cơ tim được phân phối bởi mạch vành hẹp sẽ có tưới máu giảm, tương ứng với vùng giảm chất tương phản (tối hơn) so với vùng bình thường kế cận.
Huyết khối trong tim có thể xác định trên hình ảnh early gadolinium imaging sau tiêm gadolinium khoảng 1-3 phút, huyết khối có bản chất không có mạch máu sẽ có hình ảnh tối so với cơ tim và máu.
Gần 50% các trường hợp suy tim có phân suất tống máu thất trái bảo tồn. CMR có thể đánh giá chức năng tâm trương thất trái bằng một số kỹ thuật như velocity-encoding khảo sát flow qua van hai lá, MR tagging cho phép khảo sát định lượng chức năng tâm trương theo vùng, khảo sát được biến dạng và strain cơ tim (myocardial deformation và strain). Tuy nhiên kỹ thuật đánh giá chức năng tâm trương của CMR rất phức tạp và tốn thời gian và chưa được sử dụng phổ biến trong thực hành lâm sàng. Siêu âm vẫn là phương pháp chuẩn cho khảo sát chức năng tâm trương.
III. TÍNH AN TOÀN CỦA CMR [1]
1. Tính an toàn về từ trường:
Các dụng cụ cấy ghép có từ tính như máy tạo nhịp, máy đánh sốc ICD nói chung không được phép chụp MRI trừ các loại máy có tương hợp MRI. Các dụng cụ phẫu thuật thần kinh như clips ở các vị trí nguy cơ như trong mắt…vẫn còn là vấn đề. Nhưng nói chung, phần lớn các dụng cụ kim loại cấy ghép an toàn trong từ trường CMR, bao gồm hầu hết các van tim nhân tạo, stent mạch máu và mạch vành, dụng cụ cấy ghép chỉnh hình. Tuy nhiên, khi không chắc chắn về tính an toàn của các dụng cụ kim loại cấy ghép trong từ trường, cần kiểm tra các thông tin của nhà sản xuất.
2. Tính an toàn của thuốc tương phản từ gadolinium:
Thuốc tương phản từ có thể gây xơ hóa hệ thống (nephrogenic systemic fibrosis) cho các bệnh nhân suy giảm chức năng thận nặng (GFR <30ml/min/1.73 m2). Nhóm nguy cơ cao nhất là những bệnh nhân đang được lọc thận chu kỳ với tần suất bệnh 2.5 – 5% [3]. Tránh chụp CMR có gadolinium trên các bệnh nhân GFR <30ml/min/1.73 m2 hoặc phải được lọc thận ngay sau chụp. Nguy cơ NSF cao hơn với chất tương phản từ gadolinium có cấu trúc linear, non-ionic so với cấu trúc macrocyclic, ionic.
IV. CMR VÀ CÁC NGUYÊN NHÂN SUY TIM CHUYÊN BIỆT
1. BỆNH CƠ TIM THIẾU MÁU CỤC BỘ(bệnh cơ tim TMCB)
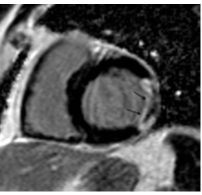
Bệnh cơ tim TMCB đặc trưng bởi kiểu phân bố sẹo cơ tim ở vùng dưới nội mạc, có thể lan tới lớp dưới thượng mạc hay xuyên thành (hình 1). CMR hiện nay đã trở thành tiêu chuẩn vàng không xâm lấn cho xác định tổn thương cơ tim không hồi phục và đánh giá mức độ xuyên thành của sẹo nhồi máu. Hình ảnh LGE với độ phân giải không gian cao, cho phép phát hiện sẹo dưới nội mạc dù là vùng sẹo nhỏ có thể bị bỏ qua nếu dùng các phương tiện chẩn đoán hình ảnh có độ phân giải không gian thấp hơn, như SPECT [4]. Khả năng của LGE trong tiên đoán hồi phục chức năng vùng sau điều trị tái thông mạch vành thực sự là một bước đột phá. Một số nghiên cứu đã cho thấy mối tương quan nghịch giữa mức độ nhồi máu cơ tim (NMCT) xuyên thành và sự hồi phục chức năng co bóp vùng sau tái thông mạch vành. Các nghiên cứu cũng đã xác nhận khả năng của LGE trong tiên đoán hồi phục co bóp sau tái thông mạch cả trong bệnh cảnh NMCT cấp và NMCT cũ [5, 6] mà không cần stress.
Hình 1.Hình ảnh một trường hợp bệnh nhân nam, 67 tuổi, NMCT dưới nội mạc vùng đáy thành dưới, đáy thành bên và nhồi máu xuyên thành đáy dưới vách (vùng tăng tín hiệu có màu trắng) trên hình LGE.
Sau điều trị tái thông mạch vành, LGE còn giúp xác định các vùng không được tái tưới máu, gọi là hiện tượng no-reflow hay hiện tượng tắc nghẽn vi mạch (microvascular obstruction = MVO) do một số nguyên nhân như tổn thương rộng của vi tuần hoàn, hoại tử cơ tim, phù khu trú gây chèn ép các mạch máu trong thành tim (intramural vessels). Hậu quả là lõi của vùng nhồi máu ngấm chất tương phản từ muộn, tạo nên hình ảnh một vùng màu đen ở trung tâm trong khi vùng xung quanh tăng tín hiệu (hình 2). Một số nghiên cứu cho thấy hình ảnh MVO trên CMR có liên quan đến gia tăng tái cấu trúc thất trái và các biến cố tim mạch sau NMCT cấp.
Hình 2.Bệnh nhân NMCT gần đây với hình ảnh tắc nghẽn vi mạch (MVO) trên hình LGE ở vị trí thành bên (mũi tên) [1]
Hình LGE và T2w của CMR có thể giúp phân biệt tổn thương của NMCT cấp với NMCT cũ. Trên hình T2w, NMCT cấp với mô cơ tim bị phù sẽ có hình ảnh tăng tín hiệu, khác với sẹo NMCT cũ không tăng tín hiệu. Thêm vào đó, phù cơ tim là tổn thương do TMCB cấp tính có thể đảo ngược được. T2w giúp xác định vùng cơ tim bị tổn thương TMCB trong vòng 3 ngày sau biến cố, ngay cả khi bệnh nhân đã được điều trị tái thông mạch vành.
CMR cũng phát hiện được các biến chứng của NMCT như huyết khối thành, phình vách. Mặc dù huyết khối nhỏ có thể thấy trên hình cine, khuyến cáo nên chẩn đoán xác định huyết khối bằng hình ảnh early Gadolinium enhancement (EGE). Huyết khối là cấu trúc không có mạch máu, trên hình EGE huyết khối có tín hiệu thấp bao bọc bởi vùng có tín hiệu cao như máu trong buồng tim và / hoặc mô sẹo cơ tim trên hình LGE (hình 3). CMR cũng có thể giúp phân biệt phình vách thật và giả phình vách, hở van hai lá liên quan rối loạn chức năng cơ trụ, thủng vách liên thất.
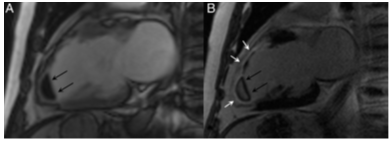
Hình 3.Huyết khối mỏm thất trái (mũi tên) trên bệnh nhân NMCT xuyên thành vùng trước rộng: hình ảnh sớm (hình A: 1 đến 3 phút) và muộn (hình B: 10 phút) sau tiêm gadolinium [1].
1.1.Phát hiện TMCB cơ tim do stress
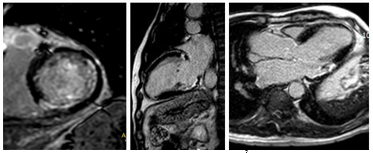
Nhiều nghiên cứu đã chứng minh tính khả khi, tính an toàn và độ chính xác cao của hình ảnh tưới máu first-pass perfusion CMR kết hợp với gắng sức bằng thuốc dãn mạch adenosine phát hiện vùng giảm tưới máu (hình 4) trong chẩn đoán BĐMV . Phân tích gộp từ 14 trung tâm (1183 bệnh nhân) cho thấy độ nhậy của kỹ thuật này là 91% và độ chuyên biệt là 81% so với chứng chụp mạch vành [7]. Dobutamine stress CMR cũng có tính an toàn và giá trị chẩn đoán cao theo một số nghiên cứu, tuy nhiên kỹ thuật này tốn nhiều thời gian hơn adenosine stress.
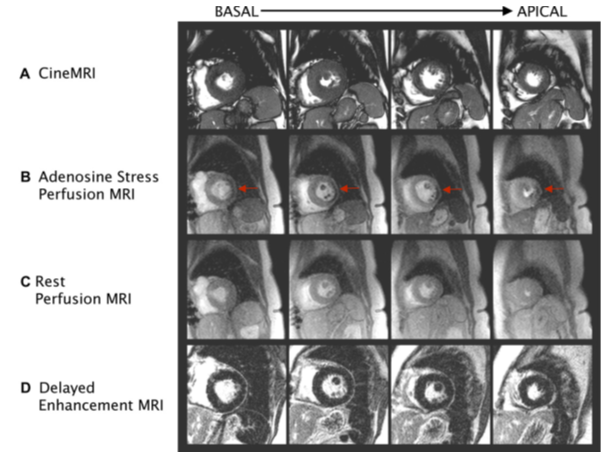
Hình 4. Các giai đoạn của CMR Adenosine stress. Hình cine MRI (A), adenosine stress (B), hình tưới máu khi nghỉ (C), hình DE –CMR (D). Các hình ảnh cắt ngang từ đáy (basal) đến mỏm tim (apical) được đánh giá, so sánh giữa các giai đoạn. Mũi tên đỏ hình B chỉ vùng giảm tưới máu thành bên khi tiêm adenosine, không thấy khi nghỉ, không tăng tín hiệu muộn trên DE-CMR, chứng tỏ thiếu máu cục bộ vùng này. [Nguồn: Cardiol Clin 25 (2007) 57–70].
1.2. Hình ảnh mạch vành
CMR không phải là phương tiện chuẩn đánh giá hình ảnh mạch vành trong thực hành lâm sàng. Mạch vành với đường kính nhỏ, đường đi ngoằn nghoèo, di chuyển nhanh theo co bóp của tim và vận động của hô hấp đòi hỏi phương tiện chẩn đoán hình ảnh phải có độ phân giải không gian và thời gian cao. Để có được hình ảnh mạch vành chất lượng đủ tốt để đánh giá hẹp mạch vành bằng CMR hiện vẫn còn là một thách thức, với độ nhạy và độ chuyên biệt thay đổi trong một khoảng khá rộng (độ nhạy 50% – 94%, độ chuyên biệt 50% – 100%) [8]. Chính vì vậy trong thực hành lâm sàng, CMR thường chỉ được ứng dụng trong khảo sát bất thường vị trí xuất phát và đường đi của mạch vành (hình 5) hoặc theo dõi dãn, phình mạch vành trong bệnh Kawasaki.
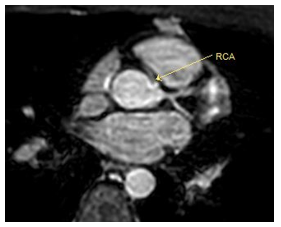
Hình 5.Trên hình khối 3D whole heart thấy RCA xuất phát từ xoang vành trái, có đoạn 1 chạy giữa động mạch chủ và động mạch phổi.
2. BỆNH CƠ TIM DÃN (DILATED CARDIOMYOPATHY – DCM)
CMR đã được xác nhận là phương tiện chẩn đoán mạnh giúp phân biệt bệnh cơ tim TMCB với bệnh cơ tim không do TMCB. Kiểu phân bố của hình ảnh tăng tín hiệu muộn trên LGE có thể giúp định hướng rối loạn chức năng thất trái do TMCB hay không do TMCB. Khoảng 13% các bệnh nhân được chẩn đoán DCM có phân bố LGE dưới nội mạc hoặc xuyên thành, gợi ý mạnh sau NMCT [9,10]. Chụp mạch vành nếu không thấy hẹp đáng kể trong những trường hợp này có thể do tái thông tự phát từ hẹp không hoàn toàn, hoặc do co thắt mạch vành, thuyên tắc, mảng xơ vữa không ổn định trên nền hẹp mạch vành nhẹ. CMR có độ nhạy 81 – 100% trong phát hiện suy giảm chức năng thất trái do BĐMV [9,11]. Trái lại, khoảng 10 – 28% các bệnh nhân bệnh cơ tim dãn không có các đặc điểm của NMCT, hình ảnh tăng tín hiệu muộn của cơ tim có dạng đốm hoặc dải phân bố ở vùng giữa thành (midwall) dọc theo thành thất, không theo kiểu phân bố của bệnh mạch vành [9,11] (Hình 6, 7). Dạng phân bố này tương ứng với những ổ xơ hóa khi sinh thiết. Nhờ đó, LGE có thể xác định vùng cơ tim có nguy cơ gây loạn nhịp, giúp lập bản đồ và lập kế hoạch triệt phá ổ loạn nhịp. Vùng tăng tín hiệu muộn còn có ý nghĩa tiên lượng trong DCM, bất kể dạng tăng tín hiệu muộn nào làm tăng gấp 8 lần nguy cơ nhập viện và tử vong do tim so với không có vùng tăng tín hiệu muộn [12]. Tuy nhiên cũng cần lưu ý, LGE âm tính không loại trừ được bệnh cơ tim TMCB với cơ tim ngủ đông toàn bộ, không có sẹo nhồi máu.
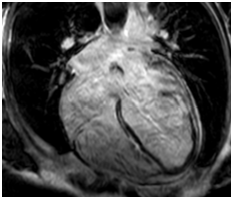
Hình 6. Hình LGE 4 buồng của một bệnh nhân nữ, 39 tuổi, phân bố tăng tín hiệu muộn điển hình của DCM ở giữa thành (midwall) của vách liên thất và thành bên.
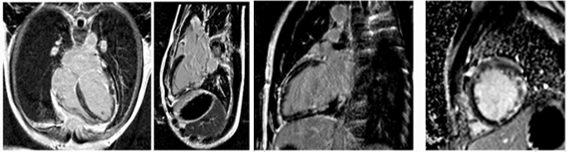
Hình 7.Hình LGE của một ca DCM nam, 29 tuổi, với kiểu phân bố LGE dưới thượng mạc thành bên, midwal các thành còn lại, khả năng do viêm cơ tim trước đây.
3. VIÊM CƠ TIM
Viêm cơ tim cấp có thể gây suy tim cấp. Tiêu chuẩn vàng cho chẩn đoán viêm cơ tim là sinh thiết nội mạc cơ tim (EMB: Endomyocardial biopsy), tuy nhiên bản chất dạng đốm rải rác (patchy nature) của bệnh làm tăng nguy cơ sinh thiết không đúng vị trí và làm hạn chế vai trò chẩn đoán của EMB. Friedrich và cs là người đầu tiên đề xuất chẩn đoán viêm cơ tim bằng CMR [13]. Dùng hình T1W, các tác giả này thấy vùng cơ tim bị viêm tăng tín hiệu khi so sánh với cơ xương (skeletal muscle). Gần đây hơn, Abdel-Aty và cs báo cáo dùng T2w phối hợp LGE làm tăng độ chính xác trong xác định viêm cơ tim cấp với độ nhạy 84% và độ chuyên biệt 74% [14]. Ảnh T2w chụp sớm sau khởi phát triệu chứng có thể thấy tăng tín hiệu phân bố ở vùng dưới thượng mạc và giữa thành chứng tỏ các vùng cơ tim bị phù nề khu trú, gặp trong 36 – 45% ca [14,15,16] (hình 8) . LGE làm tăng giá trị chẩn đoán của viêm cơ tim hoạt động, được xác nhận bởi mô học. Thường vùng viêm dưới thượng mạc tiến triển đến lớp giữa thành thất trái, nhưng bảo tồn vùng dưới nội mạc (hình 9). Tổn thương viêm thường liên quan đến thành bên và thành dưới bên, tuy nhiên vẫn có thể phân bố ở thành trước vách (hình 10) . Mặc dù dạng LGE điển hình gợi ý mạnh cho chẩn đoán viêm cơ tim, LGE âm tính không loại trừ hoàn toàn chẩn đoán viêm cơ tim. Sau vài ngày đến vài tuần, các ổ LGE lan rộng, sau đó thu nhỏ dần theo quá trình lành và có thể mất đi trong giai đoạn lành bệnh. LGE còn tồn tại nếu vùng viêm trở thành sẹo, với hình ảnh dải tăng tín hiệu muộn nằm giữa thành tương tự như trong bệnh cơ tim dãn. Cobelli và cs nghiên cứu trên 23 bệnh nhân viêm cơ tim mạn tính hoạt động cho thấy dấu hiệu tăng tín hiệu muộn nằm giữa thành hiện diện trong 84% các trường hợp [16]. Điều này cho thấy viêm cơ tim trước đây có thể là một trong những nguyên nhân đáng kể đưa đến DCM.
Với các đặc tính như nêu trên, CMR có thể là phương tiện hướng dẫn cho sinh thiết cơ tim chính xác hơn là sinh thiết thất phải thường quy.
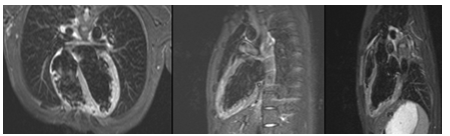
Hình 8. Hình ảnh T2STIR của một trường hợp nam, 24 tuổi, viêm cơ tim cấp huyết thanh chẩn đoán EBV (+), tín hiệu cơ tim ở thành bên và toàn bộ mỏm tim tăng gấp hơn 2 lần tín hiệu cơ xương lân cận, chứng tỏ có tình trạng viêm phù nề mô cơ tim.
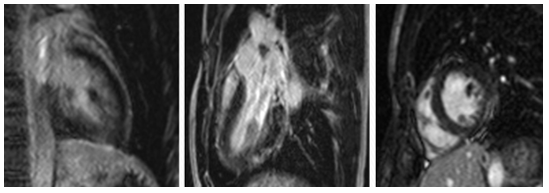
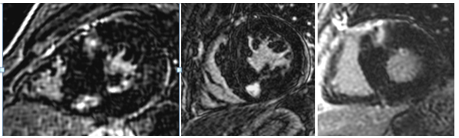
Hình 9.Hình LGE của một trường hợp nam, 17 tuổi, bị viêm cơ tim cấp với ổ tăng tín hiệu muộn phân bố dưới thượng mạc ở vùng mỏm thành dưới.
Hình 10. Hình LGE của một trường hợp viêm cơ tim cấp với hình ảnh tăng tín hiệu muộn nổi bật phân bố chủ yếu dưới thượng mạc thành bên và vách liên thất [2]
4. BỆNH CƠ TIM PHÌ ĐẠI (HYPERTROPHIC CARDIOMYOPATHY – HCM)
HCM là bệnh lý di truyền với nhiều kiểu hình khác nhau (phenotype). Kiểu hình thường gặp nhất là phì đại không đối xứng, phân bố ở vách liên thất. Tuy nhiên có thể gặp HCM với bất cứ dạng phân bố nào. Những kiểu hiếm gặp bao gồm phì đại đối xứng và phì đại mỏm (1%). Một số trường hợp HCM tiến triển đến giai đoạn cuối (end-stage form) gọi là burned-out HCM, với đặc điểm thành thất trái mỏng tiến triển và rối loạn chức năng tâm thu thất trái.
CMR có thể đánh giá các kiểu hình của HCM tốt hơn bất cứ phương tiện chẩn đoán hình ảnh nào do khả năng xác định chính xác vị trí phân bố của phì đại, bao gồm cả những vị trí khó đánh giá chính xác trên siêu âm tim như thành dưới bên hay vùng mỏm (hình 11), cũng như xác định mức độ phì đại. Siêu âm tim có khả năng đánh giá thấp hơn mức độ phì đại cơ tim so với CMR, có thể liên quan đến khó khăn có được hình ảnh tối ưu cho tất cả các vùng thất trái. Trong một nghiên cứu, bề dầy thành tối đa đo trên siêu âm là 24 ± 3 mm so với CMR là 32 ± 1 mm [17]. Ưu thế này của CMR có ý nghĩa quan trọng trong thực hành lâm sàng do bề dầy thành tối đa (≥ 30 mm) là một yếu tố tiên lượng chính của bệnh liên quan đến đột tử do loạn nhịp tim [18]. CMR cũng đánh giá tốt các bất thường của cơ trụ trong HCM như cơ trụ di lệch về phía trước mỏm (anteroapical displacement), hay cơ trụ chẻ đôi (double bifid papillary muscles) phối hợp trong thể tắc nghẽn buồng tống thất trái độc lập với bề dầy thành.
Tắc nghẽn buồng tống thất trái có thể phát hiện trên CMR bằng kỹ thuật phase-contrast flow imaging khảo sát vận tốc qua buồng tống thất trái.
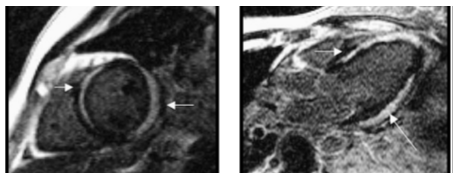
Hình 11.Hình ảnh cine HCM thể mỏm ở một trường hợp nam, 55 tuổi,với bề dầy thành vùng mỏm 1.5 – 1.7 cm, các vùng khác có bề dầy thành tối đa 1.3 cm.
Một ưu thế nổi bật khác của CMR trong HCM, đó là xác định xơ hóa, sẹo cơ tim ổ nhỏ hay lan tỏa bằng kỹ thuật LGE, không chỉ thấy ở vùng cơ tim phì đại nặng mà ở cả những vùng có bề dầy thành bình thường. Tuy nhiên, vùng cơ tim phì đại có khả năng bị sẹo, xơ hóa nhiều hơn và có thể là nền tảng của loạn nhịp thất. Dạng LGE trong HCM có thể dưới dạng đốm, điển hình nằm ở giữa thành (midwall), và thường liên quan đến vị trí nối giữa thất trái với thất phải (LV-RV junctions) (hình 12).
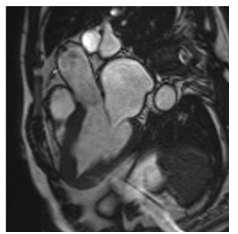
Hình 12.Kiểu phân bố LGE điển hình trong HCM dạng đốm nằm giữa thành của vách liên thất, ở vị trí tiếp nối của thất phải với thất trái.
LGE cũng có thể gặp ở mỏm trong HCM thể mỏm. Trong burned-out HCM, thành thất trái mỏng và LGE có thể có dạng xuyên thành như NMCT cũ xuyên thành, nhưng không theo vùng phân bố mạch vành (hình 13). Mô bệnh học cho thấy tích tụ collagen ở các vùng có LGE. Cơ chế của sự tích tụ này còn chưa được sáng tỏ. Một nghiên cứu về mô bệnh học xác định vùng có sẹo có bất thường của động mạch trong thành (intramural arteries), gợi ý khả năng về cơ chế TMCB khu trú [19]. Bất kể là cơ chế nào, có vẻ mức độ lan rộng của sẹo liên quan đến tiến triển của bệnh với tần suất tăng ở giai đoạn bệnh tiến triển. Tỉ lệ xơ hóa cơ tim trong HCM trong các thử nghiệm lâm sàng thay đổi, có thể lên đến 80%.
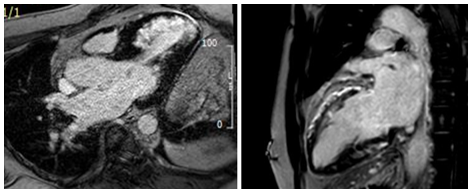
Hình 13.Dạng phân bố LGE không điển hình của của một trường hợp burned-out HCM dưới nội mạc thành trước vách (hình bên trái) và dưới thượng mạc thành trước (hình bên phải)
Tiên lượng của LGE trong HCM đang được nghiên cứu. Mức độ xơ sẹo có tương quan nghịch với EF và là yếu tố nguy cơ của đột tử. Xơ hóa trên LGE cũng là yếu tố tiên đoán độc lập cho nhịp nhanh thất trên holter ECG ở bệnh nhân HCM không triệu chứng hoặc có triệu chứng nhẹ, nguy cơ nhịp nhanh thất không dai dẳng (VT nonsustained) tăng gấp 7 lần nếu có xơ hóa cơ tim so với không có xơ hóa cơ tim [20,21,22] (biểu đồ 1).
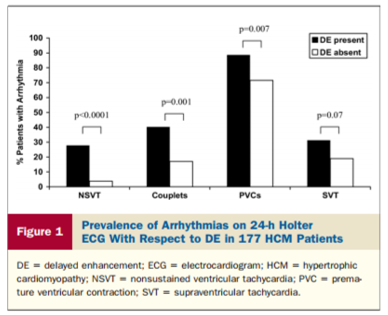
Biểu đồ 1.Tần suất loạn nhịp trên holter ECG 24 giờ trên nhóm có và không có xơ hóa cơ tim [J Am Coll Cardiol 2008;51:1369 –74]
Ngoài giá trị chẩn đoán, tiên lượng và theo dõi bệnh, CMR đánh giá rất tốt đáp ứng với điều trị can thiệp làm mỏng vách liên thất bằng alcohol trong trường hợp HCM có tắc nghẽn buồng tống thất trái.
5. BỆNH CƠ TIM AMYLOID (AMYLOID CARDIOMYOPATHY)
Amyloidosis thường gây ảnh hưởng trên tim. Trong thể AL là thể thường gặp nhất của amyloidosis, có tới 50% các trường hợp có ảnh hưởng trên tim với khoảng phân nửa các trường hợp này biểu hiện lâm sàng bằng triệu chứng suy tim sung huyết. Khi xuất hiện suy tim, thời gian sống trung bình của bệnh nhân còn dưới 6 tháng nếu không được điều trị. Vì vậy phát hiện bệnh và điều trị bệnh sớm rất quan trọng.
Để xác định liên quan tim của bệnh, cần sinh thiết nội mạc cơ tim nhiều mẫu, với độ nhạy phát hiện tích tụ amyloid protein của 1 mẫu chỉ khoảng 55%, vì vậy chẩn đoán được bệnh bằng phương pháp không xâm lấn là vô cùng hấp dẫn.
CMR có thể giúp phát hiện các đặc tính về cấu trúc và chức năng của bệnh tim nhiễm amyloid như phì đại thất trái đồng tâm với chức năng co bóp thất trái bình thường hoặc giảm, dầy vách liên nhĩ, dãn 2 nhĩ. Động học ngấm (wash-in) và thải (wash-out) gadolinium sẽ bất thường đáng kể khi các sợi amyloid tích tụ trong khoảng kẽ của cơ tim, làm cơ tim ngấm gadolinium nhiều và lan tỏa trong khi đó gadolinium trong máu lại thải trừ nhanh. Khi chụp hình ảnh LGE, cần chú ý đến các thông số của chuỗi xung TI scout. Hình LGE chọn điểm TI làm mất tín hiệu cơ tim bình thường (null point), do đó giúp phân biệt rõ cơ tim bình thường và bất thường. Bình thường, máu qua điểm mất tín hiệu (null point) trước cơ tim. Cơ tim nhiễm amyloid lan tỏa làm tăng thể tích phân bố gadolinium, do đó có T1 ngắn lại và cơ tim sẽ qua điểm null point trước máu, mô cơ tim nhiễm amyloid sẽ tăng tín hiệu so với máu và cơ tim bình thường lân cận (Hình 14).
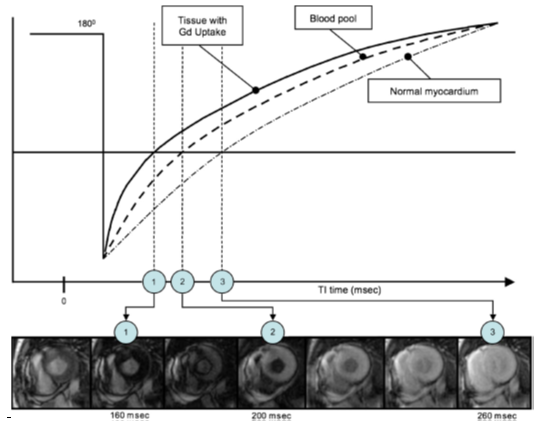
Hình 14.Giản đồ (hình trên) của thư giãn dọc sau một tiền xung đảo ngược (inversion 1800 prepulse). Cơ tim bình thường sẽ đạt điểm null point (mất tín hiệu) ở thời điểm số 3; máu đạt null point ở thời điểm số 2, sớm hơn cơ tim. Cơ tim hấp thu gadolinium lan tỏa (sau tiêm gadolinium 10 phút) sẽ đi qua điểm null point ở thời điểm số 1. Hình ảnh TI scout (hình dưới) của một ca amyloidosis cho thấy cơ tim nhiễm amyloid lan tỏa đạt điểm null point trước máu (thời điểm 1) và tăng tín hiệu muộn lan tỏa. Thời điểm số 2 thấy rõ nhất bất thường của cơ tim [23]
Trong trường hợp điển hình, hình ảnh tăng tín hiệu muộn với gadolinium có tính chất riêng biệt và đặc trưng cho bệnh, đó là hình ảnh tăng tín hiệu muộn lan tỏa theo chu vi, ưu thế ở lớp dưới nội mạc (hình 15), với thời điểm thu hình tối ưu có thể là thời điểm null point của máu (thời điểm 2, hình 14). Nhưng LGE cũng có thể biểu hiện dưới dạng các mảng xuyên thành, dạng sọc ngựa vằn (zebra-stripe) dưới nội mạc thành thất trái và thất phải, chừa lại vùng giữa thành (midwall) của vách liên thất. Cũng có thể sẽ không thể tìm được điểm null point của cơ tim khi cơ tim nhiễm gadolinium không đồng đều và khó phân biệt cơ tim bình thường với cơ tim bất thường. Hình ảnh LGE của bệnh cơ tim amyloid có tương quan với sinh thiết nội mạc cơ tim. Trong một nghiên cứu trên 33 bệnh nhân suy tim tâm trương kèm phì đại thất trái và / hoặc các biểu hiện khác của bệnh cơ tim amyloid, dạng đặc trưng LGE dưới nội mạc lan tỏa theo chu vi có độ nhạy 80% và độ chuyên biệt 94% cho chẩn đoán bệnh [24]. Trong một nghiên cứu trên 45 trường hợp xác chẩn có bệnh amyloid hệ thống nghi ngờ có liên quan tim, các bệnh nhân có hình ảnh LGE lan tỏa có thời gian sống trung bình giảm 4 lần và tăng nguy cơ tử vong hoặc ghép tim 6.7 so với các bệnh nhân không có biểu hiện này [25].
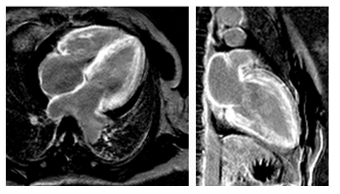
Hình 15.Bệnh nhân nữ, 51 tuổi, bị bệnh cơ tim amyloid, xác chẩn amyloidosis trên giải phẫu bệnh mô dưới lưỡi, hình DE-CMR chọn TI ở thời điểm nulling máu (cơ tim nulled ở 100ms, máu ở 150ms), có hình ảnh tăng tín hiệu muộn lan tỏa toàn bộ thất trái và thất phải, vách liên nhĩ.
Mặc dù ảnh hưởng trên tim được xem là biểu hiện muộn của bệnh amyloidosis hệ thống, 11 trong số 15 bệnh nhân trong một nghiên cứu có biểu hiện đầu tiên của bệnh tại tim [24]. Kết quả này phần nào cho thấy khả năng của LGE trong phát hiện sớm biểu hiện tại tim khi các thay đổi hình thái trên siêu âm hoặc hình ảnh hạt nhân không rõ ràng.
6. BỆNH CƠ TIM NONCOMPACTION
Bệnh cơ tim noncompaction đặc trưng bởi bất thường cấu trúc liên quan đến vùng giữa và mỏm thất trái. Tần xuất bệnh khoảng 0.05% trong cộng đồng. Cơ thất trái phân thành từng lớp (delamination) ở một mức độ nhất định là biến đổi bình thường, gặp trong hơn 90% người khỏe mạnh bình thường [26]. Trong bệnh lý này có tình trạng tăng cơ bè thất trái quá mức (hypertrabeculation), tạo những ngách sâu giữa các cơ bè (hình 16), tạo nên lớp noncompact trong buồng thất trái, dẫn đến rối loạn chức năng tâm thu thất trái tiến triển, kèm theo nguy cơ về loạn nhịp thất và các biến cố huyết khối thuyên tắc. Do cấu trúc bất thường biểu hiện ưu thế ở vùng mỏm, CMR có khả năng cung cấp hình ảnh tối ưu hơn siêu âm để đánh giá các bất thường về cấu trúc và chức năng này. Siêu âm tim không chất cản âm có thể chẩn đoán nhầm bệnh thất trái noncompaction với bệnh cơ tim phì đại thể mỏm. CMR giúp phân biệt rất rõ bệnh cơ tim phì đại thể mỏm, tăng nhẹ cơ bè (mild normal trabeculation) và bệnh thất trái noncompaction.
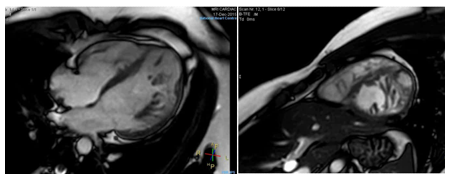
Hình 16.Một trường hợp LVNC nam, 22 tuổi. Hình cine cho thấy vùng non-compacted lan tỏa từ thành trước đến thành bên thất trái và toàn bộ mỏm tim, tỉ lệ lớp noncompacted / lớp compacted là 6.6, LVEF 46%.
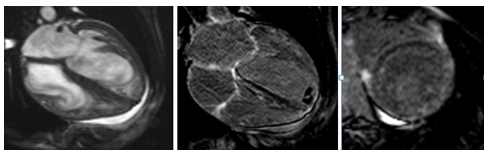
Hình 17.Một trường hợp LVNC nam, 39 tuổi, vùng non-compacted lan tỏa từ thành trước đến thành dưới và toàn bộ mỏm, có tràn dịch màng ngoài tim (hình cine bên trái); có huyết khối mỏm và LGE dạng patchy lan tỏa toàn bộ các vùng non-compacted (hình giữa và phải).
Theo kết quả nghiên cứu của Petersen và cs, tỉ lệ lớp non-compact / lớp compact > 2.3 có độ nhậy 86% và độ chuyên biệt 99% cho chẩn đoán bệnh bệnh cơ tim noncompaction [26]. Các tác giả này cũng thấy vùng tăng tín hiệu muộn trên hình ảnh LGE ở những vùng cơ tim có noncompact và cơ trụ trong một số trường hợp, gợi ý xơ hóa cơ tim có thể là một phần trong tiến triển tự nhiên của bệnh (hình 17).
7. SARCOIDOSIS
Tổn thương tim chiếm ít nhất 25% các trường hợp sarcoidosis trên tử thiết. Tuy nhiên, dưới 50% các trường hợp này có các dấu hiệu và triệu chứng liên quan đến tim, vì vậy chẩn đoán sarcoidosis thể liên quan tim là một thách thức. Đột tử do loạn nhịp là nguyên nhân gây tử vong đứng hàng đầu ở các bệnh nhân này, cho thấy việc tầm soát tổn thương tim là cần thiết cho cả những bệnh nhân không có triệu chứng tim mạch. Suy tim sung huyết tiến triển là nguyên nhân gây tử vong trong khoảng 25% các trường hợp sarcoidosis thể liên quan tim.
Các dấu hiệu trên CMR của sarcoidosis thể liên quan tim: vách liên thất mỏng, dãn và rối loạn chức năng tâm thu thất trái và thất phải, tràn dịch màng ngoài tim. LGE giúp phát hiện sarcoidosis thể liên quan tim ngay cả trong các trường hợp chức năng thất trái bình thường, đồng thời giúp đánh giá đáp ứng với điều trị steroid. Hình ảnh tăng tín hiệu muộn kiểu non-ischemic phân bố giữa thành (midwall) hoặc dưới thượng mạc với phân bố không theo một quy luật nhất định. Tuy nhiên LGE cũng có thể phân bố dưới nội mạc hay xuyên thành như kiểu TMCB (hình 18). Thành trước vách và dưới bên thường bị ảnh hưởng nhiều nhất, mặc dù các vùng khác cũng có thể bị ảnh hưởng, kể cả thất phải. Các nghiên cứu theo dõi cho thấy những vùng tăng tín hiệu muộn giảm kích thước và đậm độ sau điều trị steroid. LGE cũng có thể được sử dụng để hướng dẫn sinh thiết nội mạc cơ tim. Hình T2w cung cấp thông tin về những vùng cơ tim phù nề do viêm và các sang thương hạt (granulomatous) [1].
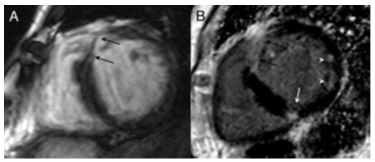
Hình 18. Hình ảnh minh họa về một ca sarcoidosis. Hình A: một hình trong chuỗi hình cine cho thấy vùng trước vách mỏng đi đáng kể (mũi tên đen). Hình B: hình LGE thấy 3 kiểu phân bố tăng tín hiệu muộn: xuyên thành ở vùng trước vách (mũi tên đen), dưới thượng mạc ở thành dưới (mũi tên trắng) và midwall ở thành bên (dấu mũi tên trắng) [1].
8. BỆNH CƠ TIM QUÁ TẢI SẮT (IRONOVERLOAD CARDIOMYOPATHY)
Cơ tim nhiễm sắt có thể gây rối loạn chức năng tâm trương và tâm thu, đưa đến suy tim. Suy tim do quá tải sắt là nguyên nhân gây tử vong hàng đầu của bệnh beta-thalassemia thể major. Cơ tim nhiễm sắt cũng gặp trong các trường hợp thiếu máu phụ thuộc truyền máu và bệnh hemochromatosis tiên phát. Bệnh cơ tim quá tải sắt có thể đảo ngược được nếu bệnh nhân được điều trị thải sắt sớm , tuy nhiên chẩn đoán bệnh thường muộn do khởi phát triệu chứng muộn. Do đó phát hiện và theo dõi tình trạng cơ tim quá tải sắt có ý nghĩa quan trọng trên lâm sàng.
Vùng cơ tim nhiễm sắt sẽ mất tính đồng nhất về từ trường, bị mất tín hiệu trên hình cine, tương ứng với màu đen. Tình trạng quá tải sắt của cơ tim có thể định lượng được trên hình T2*. T2* giảm khi tính đồng nhất của từ trường cơ tim giảm ở những vùng lân cận của cơ tim nhiễm sắt. Tất cả các trường hợp suy tim phân suất tống máu thất trái giảm do quá tải sắt đều có T2* dưới 20 ms. T2* hữu ích không chỉ cho hướng dẫn điều trị mà còn cho theo dõi đáp ứng điều trị thải sắt. CMR là phương tiện duy nhất hiện nay giúp chẩn đoán và tiên lượng các bệnh nhân bị quá tải sắt cơ tim. Tuy nhiên, giữa T2* cơ tim và các thông số về sắt như ferritin hoặc tải sắt trong gan (liver iron load) có thể không có mối tương quan.
9. BỆNH ANDERSON-FABRY
Đây là bệnh rối loạn chuyển hóa của lysosome liên quan nhiễm sắc thể X do thiếu một phần hoặc hoàn toàn emzyme alpha galactosidase A, dẫn đến tích tụ glycosphingolipid trong tế bào của mạch máu và cơ tim, gây phì đại thất trái, xơ hóa cơ tim tiến triển và tử vong do suy tim. CMR giúp đánh giá chức năng thất trái, dạng và phân bố của phì đại thất trái cũng như xác định vùng xơ hóa cơ tim. Kiểu phân bố điển hình của bệnh trên hình LGE thường tập trung vùng đáy thành dưới và bên (hình 19). Trong 1 nghiên cứu trên 35 bệnh nhân được chứng minh về gen có bệnh Fabry, 50% có hình ảnh tổn thương trên LGE. Dữ liệu về mô học cho thấy vùng LGE tương ứng với tế bào cơ tim bị mô xơ thay thế. Khoảng 6% các bệnh nhân lúc đầu được chẩn đoán HCM thực chất có bằng chứng bệnh Anderson-Fabry [27]. Chẩn đoán đúng bệnh có ý nghĩa quan trọng vì bệnh này đáp ứng với điều trị thay thế enzyme, bao gồm cải thiện chức năng và giảm phì đại thất trái. Lý tưởng, bổ xung recombinant alphagalactosidase A nên bắt đầu sớm trước khi cơ tim bị xơ hóa tiến triển để đạt được sự cải thiện lâu dài về hình thái, chức năng cơ tim và khả năng gắng sức. Chú ý loại trừ bệnh này trong các trường hợp phì đại thất trái không giải thích được, đặc biệt ở người trẻ.
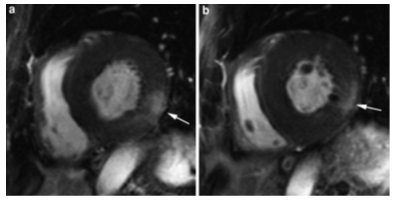
Hình 19. Hình LGE của một trường hợp bệnh Anderson-Fabry’s cho thấy dầy thất trái đồng tâm và tăng tín hiệu muộn ở thành dưới bên (mũi tên) [Nguồn: Bogaert J, Taylor AM. Clinical cardiac MRI. Spinger 2013, 1st edit:275-354]
10. BỆNH CƠ TIM DO STRESS (TAKOTSHUBO)
Điển hình, các bệnh nhân này không có vùng tăng tín hiệu muộn trên hình LGE mặc dù rối loạn vận động giống nhồi máu cơ tim vùng trước mỏm (hình 20), có thể thấy phù cơ tim trên hình T2W.
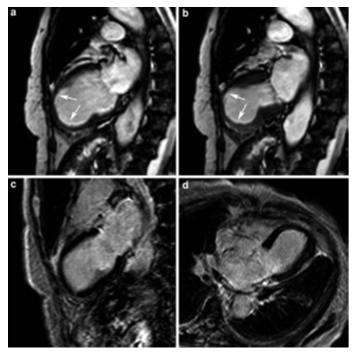
Hình 20.Một trường hợp bệnh cơ tim Tako-Tsubo: hình cine trục đứng dọc cuối tâm thu (a) và cuối tâm trương (b) cho thấy toàn bộ mỏm tim vô động (mũi tên) trong khi hình LGE trục đứng 2 buồng (c) và 4 buồng (d) không thấy vùng tăng tín hiệu muộn.[Nguồn: Bogaert J, Taylor AM. Clinical cardiac MRI. Springer 2013, 1st edit:275-354].
11. BỆNH CƠ TIM DO TĂNG URE MÁU (UREMIC CARDIOMYOPATHY)
Bệnh thận giai đoạn cuối làm tăng tỉ lệ rối loạn chức năng cơ tim, phì đại thất trái và tử vong do tim mạch. Có thể có nhiều yếu tố nguy cơ dẫn đến suy tim trong bệnh thận mạn như tăng huyết áp, đái tháo đường, và có thể có nhiều cơ chế phối hợp trong môi trường tăng ure máu tác động lên cơ tim gây xơ hóa mô kẽ và rối loạn chức năng thất trái. Nghiên cứu của Mark và cs trên 134 bệnh nhân cho thấy tỉ lệ LGE gặp trong 28% các trường hợp bệnh thận giai đoạn cuối [28]. Phân nửa các trường hợp này có dạng nonischemic, LGE lan tỏa. Sẹo cũng có thể có tính chất khu trú. Cũng có trường hợp kiểu phân bố LGE tương tự amyloidosis trên bệnh nhân bệnh thận mạn giai đoạn cuối, thường gặp ở những bệnh nhân phì đại thất trái đồng tâm đáng kể, mặc dù trên sinh thiết nội mạc cơ tim không thấy lắng đọng amyloid.
12. BỆNH CƠ TIM THẤT PHẢI GÂY LOẠN NHỊP (Arythmogenic right ventricular cardiomyopathy – ARVC)
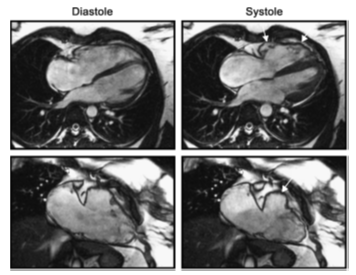
ARVC là bệnh di truyền, biểu hiện bằng tiến triển của các tình trạng: thất phãi dãn, rối loạn chức năng, cơ thất phải bị thay thế bởi mô sợi và mỡ (fibrofatty replacement), làm tăng nguy cơ suy thất phải và tử vong do loạn nhịp nhanh thất. Điển hình, bệnh xuất hiện ở người trẻ. Một số trường hợp bệnh có thể ảnh hưởng đến cả hai thất hoặc ưu thế thất trái. Tiêu chuẩn chẩn đoán gồm các tiêu chuẩn chính và phụ liên quan đến những bất thường trên lâm sàng, ECG, chức năng và hình thái tim. CMR là một trong những phương tiện hình ảnh xác định các bất thường về giải phẫu và chức năng của bệnh. So với siêu âm, CMR đánh giá cấu trúc và chức năng thất phải tốt hơn nhiều do có thể khảo sát thất phải qua bất kỳ mặt cắt nào như các mặt cắt ngang và đứng dọc theo trục cơ thể, đứng ngang theo mặt phẳng trán, mặt cắt theo trục ngang và dọc của thất phải… Các bất thường chức năng và hình thái thất phải trong ARVC gồm: bất thường vận động vùng thất phải, mỏng hoặc phình vách hoặc dầy thành khu trú, cơ bè phì đại và sắp xếp lộn xộn (disarray), phì đại dải điều hòa (moderator band), dãn buồng tống thất phải, dãn thất phải toàn bộ, rối loạn chức năng, tẩm nhuận mỡ trong cơ (intramyocardial fatty infiltration). Ủng hộ cho chẩn đoán này khi bất cứ bất thường nào nêu trên không có nguyên nhân giải thích được. Tiêu chuẩn chẩn đoán chính về mặt hình ảnh gồm: phình khu trú, dãn nặng thất phải theo vùng hay toàn bộ, rối loạn chức năng thất phải toàn bộ (hình 21,22). Tiêu chuẩn phụ gồm: dãn nhẹ thất phải theo vùng hay toàn bộ, bất thường vận động vùng [29].
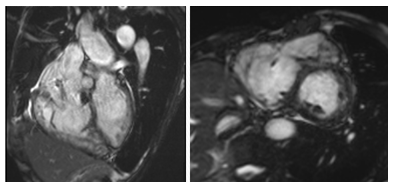
Hình 21.Một trường hợp ARVC nam, 67 tuổi. Hình cine cho thấy dãn nặng toàn bộ thất phải (thể tích thất phải cuối tâm trương RVEDVi 114 mL/m2), rối loạn vận động toàn bộ các thành thất phải, phân suất tống máu thất phải giảm nặng (RVEF 13%).
Hình 22.Phình vách thành thất phải trên hình cine MRI (mũi tên) [2]
Những nghiên cứu gần đây đề cao vai trò của CMR trong phát hiện xơ hóa cơ tim thất phải [30, 31]. Sự hiện diện của vùng cơ tim tăng tín hiệu muộn trên hình LGE (hình 23) tương quan tốt với tình trạng mô xơ – mỡ thay thế mô cơ tim (fibrofatty replacement) trên sinh thiết nội mạc cơ tim và tiên đoán tạo loạn nhịp nhanh thất trên thăm dò điện sinh lý. Tuy nhiên, khó phát hiện mô xơ mỡ thay thế do phân bố lan tỏa xen lẫn với mô cơ tim bình thường, thành thất phải mỏng và gần với lớp mỡ trong khoang màng ngoài tim dễ bị sai lệch tín hiệu gây dương tính giả. Xác định có thâm nhiễm mỡ ở thành RV trên hình T1W (có hay không xóa mỡ) không nằm trong tiêu chuẩn chẩn đoán chính và phụ của ARVC, do độ nhạy và độ chuyên biệt thấp và là dấu hiệu có tính lặp lại kém nhất trên CMR. Trái lại, bất thường vận động vùng hay toàn bộ thành thất phải có độ đặc hiệu cao cho chẩn đoán ARVC, tuy nhiên đánh giá này cần kinh nghiệm và sự cẩn thận. Cũng cần lưu ý vùng thất phải gần dải điều hòa có thể co bóp bất thường, vì vậy bất thường vận động vùng này đơn độc không có giá trị chẩn đoán bệnh. Khi đánh giá chức năng, chú ý tam giác “triangle of dysplasia” gồm vùng phễu (infundibulum) tới mỏm, và thành dưới thất phải ngay dưới vòng van ba lá trên các mặt cắt trục ngắn và 4 buồng, kèm buồng tống thất phải để khảo sát kỹ kích thước và vận động vùng. Cine CMR hiện vẫn được xem là có giá trị và tính lặp lại cao nhất, với giá trị chẩn đoán dương là 90% [32].
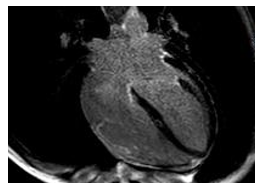
Hình 23.Hình LGE một trường hợp ARVC nam, 37 tuổi, cho thấy tăng tín hiệu muộn ở vùng đáy và giữa thành tự do thất phải.
V. VAI TRÒ CỦA LGE TRONG TIÊN LƯỢNG VÀ THEO DÕI ĐIỀU TRỊ SUY TIM
Vai trò của đánh giá xơ – sẹo cơ trong tiên lượng và phân tầng nguy cơ suy tim đang được mở rộng một cách nhanh chóng. Theo dữ liệu nghiên cứu, sự hiện diện của sẹo giúp xác định nhóm bệnh nhân nguy cơ cao bị các biến cố tim và loạn nhịp trong bệnh cơ tim TMCB và bệnh cơ tim không do TMCB. LGE vì vậy có tiềm năng trong xác định các bệnh nhân có nguy cơ cao và hướng tới một số phương pháp điều trị như đặt ICD phòng ngừa đột tử.
Vai trò của đánh giá xơ – sẹo cơ tim trong đánh giá đáp ứng điều trị suy tim hướng tới thay đổi bệnh nền và diễn tiến của bệnh nền. Các nghiên cứu đã chứng minh mối tương quan giữa mức độ xơ – sẹo và đáp ứng với điều trị nội khoa và điều trị xâm lấn, giải thích sự khác biệt trong đáp ứng điều trị của các bệnh nhân suy tim do bệnh cơ tim TMCB với bệnh cơ tim không do TMCB. Mức độ xơ – sẹo trên LGE là yếu tố tiên đoán mạnh cho cải thiện chức năng và lâm sàng của các bệnh nhân suy tim đáp ứng với điều trị nội khoa, phẫu thuật và can thiệp tái thông mạch vành hay điều trị tái đồng bộ.
VI. KẾT LUẬN
Xác định bệnh căn của suy tim đặc biệt cần thiết cho việc lập kế hoạch điều trị suy tim. Nhiều trường hợp trên lâm sàng, xác định bệnh căn của suy tim vẫn còn là vấn đề nan giải. CMR là một kỹ thuật chẩn đoán hình ảnh tim mạch còn khá mới mẻ, đang không ngừng phát triển và hoàn thiện. CMR không chỉ giúp đánh giá hình thái và chức năng tim, mà còn hướng đến chẩn đoán nguyên nhân của suy tim, tiên lượng bệnh và chọn lựa các đối tượng được hưởng lợi từ các phương pháp điều trị bậc cao như tái thông, điều trị tái đồng bộ cơ tim hoặc đặt ICD. Bên cạnh đó, CMR cũng là phương tiện theo dõi diễn tiến bệnh lý tưởng do các đo lường có tính chính xác và tính lặp lại cao và không gây phơi nhiễm với tia X.
TÀI LIỆU THAM KHẢO
1. Karamitsos TD, Francis JM, Myerson S, et al. The Role of Cardiovascular Magnetic
Resonance Imaging in Heart Failure. J Am Coll Cardiol 2009;54:1407–24
2. white JA, Patel MR. The Role of Cardiovascular MRI in Heart Failure and the Cardiomyopathies. Cardiol Clin 2007 (25) 71–95.
3. Miskulin D, Rudnick MR. Nephrogenic systemic fibrosis in advanced renal failure. uptodate, last update Jan 26, 2018.
4. Wagner A, Mahrholdt H, Holly TA, et al. Contrast-enhanced MRI and routine single photon emission computed tomography (SPECT) perfusion imaging for detection of subendocardial myocardial infarcts: an imaging study. Lancet 2003;361:374 –9.
5. Selvanayagam JB, Kardos A, Francis JM, et al. Value of delayedenhancement cardiovascular magnetic resonance imaging in predicting myocardial viability after surgical revascularization. Circulation 2004;110:1535– 41.
6. Beek AM, Kuhl HP, Bondarenko O, et al. Delayed contrastenhanced magnetic resonance imaging for the prediction of regional functional improvement after acute myocardial infarction. J Am Coll Cardiol 2003;42:895–901.
7. Nandalur KR, Dwamena BA, Choudhri AF, Nandalur MR, Carlos RC. Diagnostic performance of stress cardiac magnetic resonance imaging in the detection of coronary artery disease: a meta-analysis. J Am Coll Cardiol 2007;50:1343–53.
8. Bluemke DA, Achenbach S, Budoff M, et al. Noninvasive coronary artery imaging: magnetic resonance angiography and multidetector computed tomography angiography: a scientific statement from the American Heart Association Committee on Cardiovascular Imaging and Intervention of the Council on Cardiovascular Radiology and Intervention, and the Councils on Clinical Cardiology and Cardiovascular Disease in the Young. Circulation 2008;118:586–606.
9. McCrohon JA, Moon JC, Prasad SK, et al. Differentiation of heart failure related to dilated cardiomyopathy and coronary artery disease using gadolinium-enhanced cardiovascular magnetic resonance. Circulation 2003;108:54 –9.
10. Casolo G, Minneci S, Manta R, et al. Identification of the ischemic etiology of heart failure by cardiovascular magnetic resonance imaging: diagnostic accuracy of late gadolinium enhancement. Am Heart J 2006;151:101– 8.
11. Soriano CJ, Ridocci F, Estornell J, et al. Noninvasive diagnosis of coronary artery disease in patients with heart failure and systolic dysfunction of uncertain etiology, using late gadolinium-enhanced cardiovascular magnetic resonance. J Am Coll Cardiol 2005;45:743– 8.
12. Wu KC, Weiss RG, Thiemann DR, et al. Late gadolinium enhancement by cardiovascular magnetic resonance heralds an adverse prognosis in nonischemic cardiomyopathy. J Am Coll Cardiol 2008;51:2414–21.
13. Friedrich MG, Strohm O, Schulz-Menger J, et al. Contrast media-enhanced magnetic resonance imaging visualizes myocardial changes in the course of viral myocarditis. Circulation 1998;97:1802–9.
14. Abdel-Aty H, Boye P, Zagrosek A, et al. Diagnostic performance of cardiovascular magnetic resonance in patients with suspected acute myocarditis: comparison of different approaches. J Am Coll Cardiol 2005;45:1815–22.
15. Laissy JP, Messin B, Varenne O, et al. MRI of acute myocarditis: a comprehensive approach based on various imaging sequences. Chest 2002;122(5):1638–48.
16. De Cobelli F, Pieroni M, Esposito A, et al. Delayed gadolinium-enhanced cardiac magnetic resonance in patients with chronic myocarditis presenting with heart failure or recurrent arrhythmias. J Am Coll Cardiol 2006;47(8):1649–54.
17. Rickers C, Wilke NM, Jerosch-Herold M, et al. Utility of cardiac magnetic resonance imaging in the diagnosis of hypertrophic cardiomyopathy. Circulation 2005;112(6):855–61.
18. Sorajja P, Nishimura RA, Ommen SR, et al. Use of echocardiography in patients with hypertrophic cardiomyopathy: clinical implications of massive hypertrophy. J Am Soc Echocardiogr 2006;19(6):788–95.
19. Maron BJ, Wolfson JK, Epstein SE, et al. Intramural (small vessel) coronary artery disease in hypertrophic cardiomyopathy. J Am Coll Cardiol 1986;8(3):545–57.
20. Moon JC, McKenna WJ, McCrohon JA, et al. Toward clinical risk assessment in hypertrophic cardiomyopathy with gadolinium cardiovascular magnetic resonance. J Am Coll Cardiol 2003;41(9):1561–7.
21. Adabag AS, Maron BJ, Appelbaum E, et al. Occurrence and frequency of arrhythmias in hypertrophic cardiomyopathy in relation to delayed enhancement on cardiovascular magnetic resonance. J Am Coll Cardiol 2008;51:1369 –74.
22. Kwon DH, Setser RM, Popovic ZB, et al. Association of myocardial fibrosis, electrocardiography and ventricular tachyarrhythmia in hypertrophic cardiomyopathy: a delayed contrast enhanced MRI study. Int J Cardiovasc Imaging 2008;24:617–25.
23. James A. White, MD, Manesh R. Patel, MD. The Role of Cardiovascular MRI in Heart Failure and the Cardiomyopathies . Cardiol Clin 25 (2007) 71–95.
24. Vogelsberg H, Mahrholdt H, Deluigi CC, et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol 2008;51:1022–30.
25. White J, Patel M, Shah DJ, et al. Prognostic utility of delayed enhancement magnetic resonance imaging in patients with systemic amyloidosis and suspected cardiac involvement. Circulation 2006;114:679.
26. Petersen SE, Selvanayagam JB, Wiesmann F, et al. Left ventricular non-compaction: insights from cardiovascular magnetic resonance imaging. J Am Coll Cardiol 2005;46(1):101–5.
27. Sachdev B, Takenaka T, Teraguchi H, et al. Prevalence of Anderson-Fabry disease in male patients with late onset hypertrophic cardiomyopathy. Circulation 2002;105:1407–11.
28. Mark PB, Johnston N, Groenning BA, et al. Redefinition of uremic cardiomyopathy by contrast- enhanced cardiac magnetic resonance imaging. Kidney Int 2006;69(10):1839–45.
29. Marcus FI, McKenna WJ, Sherrill D, et al. Diagnosis of Arrhythmogenic Right Ventricular Cardiomyopathy/Dysplasia Proposed Modification of the Task Force Criteria. Circulation. 2010;121:1533-1541.
30. Tandri H, Saranathan M, Rodriguez ER, et al. Noninvasive detection of myocardial fibrosis in arrhythmogenic right ventricular cardiomyopathy using delayed-enhancement magnetic resonance imaging. J Am Coll Cardiol 2005;45:98 –103.
31. Hunold P, Wieneke H, Bruder O, et al. Late enhancement: a new feature in MRI of arrhythmogenic right ventricular cardiomyopathy? J Cardiovasc Magn Reson 2005;7:649 –55.
32. Tandri H, Castillo E, Ferrari V, et al. Magnetic resonance imaging of arrhythmogenic right ventricular dysplasia. J Am Coll Cardiol 2006;48:2277–84.







