Rối loạn lipid máu là một trong những yếu tố nguy cơ tim mạch chính và thường gặp trong dân số chung cũng như nhiều đối tượng bệnh nhân khác nhau.
ThS.BS TRẦN CÔNG DUY1
GS.TS.BS ĐẶNG VẠN PHƯỚC2
1Giảng Viên Bộ Môn Nội, Đại Học Y Dược TP. Hồ Chí Minh
2Chủ Tịch Hội Tim Mạch TP. Hồ Chí Minh
Rối loạn lipid máu, chủ yếu là nồng độ cholesterol cao, góp phần gây ra khoảng 56% bệnh tim thiếu máu cục bộ và 18% đột quỵ, dẫn đến 4,4 triệu người tử vong hàng năm trên thế giới [1]. Vào cuối tháng 8 năm 2016, Hội Tim Châu Âu (European Society of Cardiology – ESC) và Hội Xơ Vữa Động Mạch Châu Âu (European Atherosclerosis Society – EAS) đã công bố hướng dẫn mới nhất về rối loạn lipid máu [2]. Bài báo này cập nhật những khuyến cáo chính với mức độ khuyến cáo (MĐKC) và mức độ chứng cứ (MĐCC) trong hướng dẫn của ESC/EAS 2016 để giúp các bác sĩ có hướng tiếp cận chẩn đoán, điều trị và theo dõi bệnh nhân thích hợp trong thực hành lâm sàng hàng ngày.
1. ĐÁNH GIÁ CÁC THÔNG SỐ LIPID VÀ APOLIPOPROTEIN
Tầm soát rối loạn lipid máu (RLLM) luôn luôn được chỉ định ở các đối tượng có biểu hiện lâm sàng của bệnh tim mạch, các tình trạng lâm sàng liên quan với tăng nguy cơ bệnh tim mạch và bất kỳ khi nào cần tầm soát yếu tố nguy cơ. Các tình trạng viêm mạn tự miễn như viêm khớp dạng thấp, lupus ban đỏ hệ thống và vảy nến có liên quan tăng nguy cơ tim mạch và rối loạn lipid máu. Hơn nữa, ở phụ nữ, đái tháo đường hoặc tăng huyết áp trong thai kỳ là các chỉ điểm nguy cơ, và ở nam rối loạn cương dương. Bệnh nhân bệnh thận mạn cũng tăng nguy cơ các biến cố tim mạch và nên được tầm soát RLLM. Các biểu hiện lâm sàng của RLLM di truyền như u vàng (xanthoma), xanthelasma (< 45 tuổi) nên được tầm soát vì các dấu hiệu này có thể chỉ điểm rối loạn lipoprotein nặng, nhất là tăng cholesterol máu gia đình, một rối loạn đơn gen thường gặp nhất liên quan với bệnh tim mạch sớm. Điều trị kháng siêu vi có thể liên quan với tăng xơ vữa động mạch. Tầm soát RLLM cũng nên được chỉ định ở các bệnh nhân bệnh động mạch ngoại biên hoặc tăng độ dày lớp nội trung mạc hoặc xơ vữa động mạch cảnh.
Tầm soát RLLM nên được thực hiện ở tất cả người trưởng thành nam ≥ 40 tuổi và nữ ≥ 50 tuổi hoặc sau mãn kinh, nhất là khi có các yếu tố nguy cơ tim mạch. Những thành viên trong gia đình của bệnh nhân RLLM nặng và bệnh tim mạch sớm cũng được chỉ định tầm soát RLLM.
Các thông số được đề nghị sử dụng để đánh giá lipid ban đầu là cholesterol toàn phần, triglyceride, HDL-C, LDL-C (tính theo công thức Friedewald trừ khi triglyceride tăng > 4,5 mmol/L hoặc > 400 mg/dL hoặc phương pháp xét nghiệm trực tiếp) và non-HDL-C. ApoB có thể được xem tương đương non-HDL-C. Các trị số lipid huyết tương khác có thể xem xét là Lipoprotein (a), tỉ số apoB:apoA1 và tỉ số non-HDL-C:HDL-C (Bảng 1).
Trước đây, các mẫu máu để xét nghiệm lipid cần được lấy lúc đói. Tuy nhiên, các mẫu máu lúc đói hoặc không đói có kết quả cholesterol toàn phần, LDL-C và HDL-C tương tự. Triglyceride bị ảnh hưởng bởi thức ăn, dẫn đến tăng trung bình nồng độ huyết tương 0,3 mmol/L (27 mg/dL) phụ thuộc vào thành phần và thời gian của bữa ăn cuối cùng. Nồng độ lipid không nhịn đói có giá trị tiên lượng tương tự như nồng độ lúc đói và có thể được dùng để tầm soát và đánh giá nguy cơ chung. Tuy nhiên, nguy cơ có thể bị đánh giá thấp ở các bệnh nhân đái tháo đường bởi vì trong một nghiên cứu, các bệnh nhân đái tháo đường có LDL-C thấp hơn 0,6 mmol/L ở mẫu máu không nhịn đói [3]. Hơn nữa, các mẫu máu lúc đói được khuyến cáo để xác định RLLM nặng và theo dõi các bệnh nhân tăng triglyceride.
Bảng 1. Khuyến cáo phân tích lipid để xác định đặc điểm RLLM trước khi điều trị
|
Khuyến cáo |
MĐKC |
MĐCC |
|
LDL-C phải được sử dụng là phân tích lipid chính |
I |
C |
|
Khuyến cáo phân tích HDL-C trước khi điều trị |
I |
C |
|
Triglyceride cung cấp thêm thông tin về nguy cơ và được chỉ định để chẩn đoán và chọn lựa điều trị. |
I |
C |
|
Non-HDL-C được khuyến cáo tính, đặc biệt ở những đối tượng tăng triglyceride. |
I |
C |
|
Nếu sẵn có, apoB nên là trị số thay thế cho non-HDL-C. |
IIa |
C |
|
Lp (a) nên được khuyến cáo ở những trường hợp chọn lọc nguy cơ cao, tái phân loại ở nguy cơ giới hạn và có tiền sử gia đình bệnh tim mạch sớm. |
IIa |
C |
|
Cholesterol toàn phần có thể được xem xét nhưng thường không đủ để xác định đặc điểm của RLLM trước khi khởi trị. |
IIb |
C |
Bảng 2. Khuyến cáo phân tích lipid để xác định mục tiêu điều trị trong dự phòng bệnh tim mạch
|
Khuyến cáo |
MĐKC |
MĐCC |
|
LDL-C được khuyến cáo là mục tiêu điều trị chính |
I |
A |
|
Cholesterol toàn phần có thể được xem xét là mục tiêu điều trị nếu các thông số khác không có sẵn. |
IIa |
A |
|
Non-HDL-C có thể được xem xét là mục tiêu điều trị phụ. |
IIa |
B |
|
ApoB nên được xem xét là mục tiêu điều trị phụ khi có sẵn. |
IIa |
B |
|
HDL-C không được khuyến cáo là mục tiêu điều trị. |
III |
A |
|
Tỉ số apoB/apoA1 và non-HDL-C/HDL-C không được khuyến cáo là mục tiêu điều trị. |
III |
B |
2. MỤC TIÊU ĐIỀU TRỊ
Trong hướng dẫn điều trị RLLM của EAS/ESC 2011 và hướng dẫn giảm cholesterol để giảm nguy cơ bệnh tim mạch do xơ vữa của ACC/AHA 2013, tầm quan trọng của giảm LDL-C để dự phòng bệnh tim mạch được nhấn mạnh. Các tiếp cận đạt mục tiêu LDL-C của hai hướng dẫn khác nhau. Ban biên soạn hướng dẫn về RLLM của EAS/ESC 2016 đã xem xét vấn đề này. Các chuyên gia của Hoa Kỳ chỉ chọn nguồn chứng cứ từ kết quả của các thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng. Mặc dù vậy, không đủ các thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng ủng hộ các khuyến cáo của AHA/ACC về sử dụng statin liều cao ở tất cả bệnh nhân nguy cơ cao bất kể nồng độ LDL-C ban đầu. Ban biên soạn EAS/ESC cảm thấy việc giới hạn hiểu biết hiện tại về dự phòng bệnh tim mạch chỉ từ kết quả của các thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng sẽ làm giảm việc phát hiện tiềm năng dự phòng bệnh tim mạch. Sự phù hợp của các kết luận từ nhiều tiếp cận khác nhau (khoa học cơ bản, quan sát lâm sàng, di truyền học, dịch tễ học, thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng, …) góp phần hiểu biết về các nguyên nhân của bệnh tim mạch và tiềm năng dự phòng. Ban biên soạn nhận biết các hạn chế của một số nguồn chứng cứ và chấp nhận các thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng không kiểm tra các mục tiêu LDL-C khác nhau một cách hệ thống nhưng cảm thấy thích hợp để nhìn lại toàn bộ chứng cứ. Thực ra, ban biên soạn chấp nhận việc chọn lựa bất kỳ mục tiêu LDL-C có thể mở ra cuộc tranh luận về bản chất liên tục của mối quan hệ giữa giảm LDL-C và giảm nguy cơ. Sự xem xét đặc biệt các kết quả từ các tổng quan hệ thống khẳng định giảm nguy cơ tim mạch với giảm LDL-C phụ thuộc liều; giảm LDL-C càng nhiều, giảm nguy cơ tim mạch càng nhiều. Lợi ích liên quan giảm LDL-C không đặc hiệu đối với điều trị statin. Không có nồng độ LDL-C được xác định mà dưới đó lợi ích ngừng hoặc gây hại.
Có sự biến thiên đáng kể giữa các cá thể trong đáp ứng LDL-C với chế độ ăn và điều trị thuốc. Việc giảm nguy cơ tim mạch toàn thể nên được cá thể hóa, và điều này có thể đặc hiệu hơn nếu các mục tiêu được xác định. Sử dụng các mục tiêu có thể hỗ trợ giao tiếp bệnh nhân – bác sĩ. Tiếp cận theo mục tiêu có thể tăng cường sự tuân thủ điều trị mặc dù ý kiến đồng thuận này chưa được kiểm tra đầy đủ. Vì những lý do trên mà EAS/ESC duy trì tiếp cận theo mục tiêu để điều trị RLLM và các mục tiêu điều trị được xác định, điều chỉnh theo mức nguy cơ tim mạch toàn thể. Các chứng cứ đề nghị rằng giảm LDL-C vượt quá mục tiêu trong các hướng dẫn EAS/ESC trước đây liên quan với ít biến cố tim mạch hơn. Do đó, việc giảm LDL-C càng thấp càng tốt có thể hợp lý, ít nhất ở các bệnh nhân nguy cơ tim mạch rất cao.
Các mục tiêu lipid là một phần của chiến lược làm giảm nguy cơ tim mạch toàn diện. Phân loại mức nguy cơ tim mạch toàn thể và chiến lược can thiệp dựa vào nguy cơ tim mạch toàn thể và nồng độ LDL-C được trình bày ở bảng 3 và bảng 4. Tiếp cận điều trị RLLM theo mục tiêu chủ yếu nhắm vào giảm LDL-C. Đối với bệnh nhân nguy cơ tim mạch toàn thể rất cao: mục tiêu LDL-C < 1,8 mmol/L (70 mg/dL) hoặc giảm ít nhất 50% trị số ban đầu (nếu > 1,8 mmol/L). Đối với bệnh nhân nguy cơ tim mạch toàn thể cao, mục tiêu nồng độ LDL-C < 2,6 mmol/L (100 mg/dL) hoặc giảm ít nhất 50% trị số ban đầu [nếu > 2,6 mmol/L (100 mg/dL)]. Ở những người nguy cơ tim mạch trung bình, mục tiêu LDL-C < 3 mmol/L (115 mg/dL) (Bảng 3).
Khi các mục tiêu phụ được sử dụng, các khuyến cáo là:
· Non-HDL-C < 2,6 mmol/L (100 mg/dL) và < 3,4 mmol/L (130 mg/dL) lần lượt ở các đối tượng nguy cơ tim mạch toàn thể rất cao và cao (MĐKC: IIa, MĐCC: B).
· apoB < 80 mg/dL và < 100 mg/dL lần lượt ở các đối tượng nguy cơ tim mạch toàn thể rất cao và cao (MĐKC: IIa, MĐCC: B).
Các mục tiêu phụ non-HDL-C và apoB cũng được xác định bằng cách suy luận vì không được nghiên cứu rộng rãi trong các thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng. Các bác sĩ dùng apoB trong thực hành có thể sử dụng nồng độ mục tiêu < 100 mg/dL và < 80 mg/dL lần lượt ở các đối tượng nguy cơ tim mạch toàn thể cao hoặc rất cao. Mục tiêu chuyên biệt non-HDL-C nên cao hơn mục tiêu LDL-C tương ứng 0,8 mmol/L (30 mg/dL). Điều chỉnh liệu pháp giảm lipid máu theo các mục tiêu phụ có thể được xem xét sau khi đạt mục tiêu LDL-C ở bệnh nhân nguy cơ tim mạch rất cao mặc dù sự thuận lợi lâm sàng của cách tiếp cận này về mặt các kết cục vẫn còn được đề cập. Cho đến hiện tại, không có mục tiêu chuyên biệt đối với HDL-C và triglyceride được xác định trong các thử nghiệm lâm sàng, mặc dù tăng HDL-C tiên đoán sự thoái triển xơ vữa động mạch và HDL-C thấp có liên quan với tăng các biến cố và tử vong ở bệnh nhân bệnh mạch vành, thậm chí khi LDL-C < 1,8 mmol/L (70 mg/dL). Tuy nhiên, thiếu chứng cứ thử nghiệm lâm sàng về hiệu quả của can thiệp các thông số này để giảm thêm nguy cơ tim mạch. Các bác sĩ nên đánh giá lâm sàng khi xem xét điều trị tăng cường cho các bệnh nhân có nguy cơ tim mạch toàn thể cao hoặc rất cao.
Bảng 3. Phân loại nguy cơ tim mạch toàn thể
|
Nguy cơ rất cao |
Các đối tượng với bất kỳ tiêu chuẩn sau: Bệnh tim mạch đã được xác định bằng lâm sàng hoặc rõ ràng trên hình ảnh. Bệnh tim mạch đã được xác định bao gồm tiền sử nhồi máu cơ tim, hội chứng mạch vành cấp, tái thông mạch vành (can thiệp mạch vành qua da, phẫu thuật bắc cầu động mạch vành) và thủ thuật tái thông các động mạch khác, đột quỵ và cơn thoáng thiếu máu não, và bệnh động mạch ngoại biên. Bệnh tim mạch đã xác định rõ ràng trên hình ảnh là các tình trạng thúc đẩy mạnh các biến cố lâm sàng như mảng xơ vữa có ý nghĩa trên chụp mạch vành hoặc siêu âm động mạch cảnh. Đái tháo đường có tổn thương cơ quan đích như tiểu đạm hoặc có một yếu tố nguy cơ chính khác như hút thuốc lá, tăng huyết áp hoặc rối loạn lipid máu. Bệnh thận mạn mức độ nặng (độ lọc cầu thận <30 mL/phút/1,73 m2) Điểm số SCORE ≥ 10% đối với nguy cơ 10 năm của bệnh tim mạch gây tử vong. |
|
Nguy cơ cao |
Các đối tượng có: Một yếu tố nguy cơ tăng đáng kể, đặc biệt cholesterol > 8 mmol/L (>310 mg/dL) (như tăng cholesterol máu có tính gia đình) hoặc huyết áp ≥ 180/110 mmHg. Hầu hết các bệnh nhân đái tháo đường (một số bệnh nhân trẻ đái tháo đường típ 1 có thể ở mức nguy cơ thấp hoặc trung bình). Bệnh thận mạn mức độ trung bình (độ lọc cầu thận 30-59 mL/phút/1,73 m2) Điểm số SCORE ≥ 5% và < 10% đối với nguy cơ 10 năm của bệnh tim mạch gây tử vong. |
|
Nguy cơ trung bình |
Điểm số SCORE ≥ 1% và < 5% đối với nguy cơ 10 năm của bệnh tim mạch gây tử vong. |
|
Nguy cơ thấp |
Điểm số SCORE < 1% đối với nguy cơ 10 năm của bệnh tim mạch gây tử vong. |
Bảng 4. Chiến lược can thiệp dựa vào nguy cơ tim mạch toàn thể và nồng độ LDL-C
|
Nguy cơ tim mạch toàn thể (SCORE) % |
Nồng độ LDL-C |
|||||
|
< 70 mg/dL < 1,8 mmol/L |
70 đến <100 mg/dL 2,6 đến 4,0 mmol/L |
100 đến <155 mg/dL 4,0 đến <4,9 mmol/L |
155 đến < 190 mg/dL 4,0 đến <4,9 mmol/L |
≥ 190 mg/dL ≥ 4,9 mmol/L |
|
|
|
< 1 |
Không can thiệp lipid |
Không can thiệp lipid |
Không can thiệp lipid |
Không can thiệp lipid |
Can thiệp lối sống, xem xét dùng thuốc nếu không kiểm soát |
|
|
MĐKC/MĐCC |
I/C |
I/C |
I/C |
I/C |
IIa/A |
|
|
≥ 1 đến 5 |
Không can thiệp lipid |
Không can thiệp lipid |
Can thiệp lối sống, xem xét dùng thuốc nếu không kiểm soát |
Can thiệp lối sống, xem xét dùng thuốc nếu không kiểm soát |
Can thiệp lối sống, xem xét dùng thuốc nếu không kiểm soát |
|
|
MĐKC/MĐCC |
I/C |
I/C |
IIa/A |
IIa/A |
I/A |
|
|
≥ 5 đến 10 |
Không can thiệp lipid |
Can thiệp lối sống, xem xét dùng thuốc nếu không kiểm soát |
Can thiệp lối sống và thuốc đồng thời |
Can thiệp lối sống và thuốc đồng thời |
Can thiệp lối sống và thuốc đồng thời |
|
|
MĐKC/MĐCC |
IIa/A |
IIa/A |
IIa/A |
I/A |
I/A |
|
|
≥ 10 |
Can thiệp lối sống, xem xét dùng thuốc |
Can thiệp lối sống và thuốc đồng thời |
Can thiệp lối sống và thuốc đồng thời |
Can thiệp lối sống và thuốc đồng thời |
Can thiệp lối sống và thuốc đồng thời |
|
|
MĐKC/MĐCC |
IIa/A |
IIa/A |
I/A |
I/A |
I/A |
|
Bảng 5. Khuyến cáo mục tiêu điều trị của LDL-C
|
Khuyến cáo |
MĐKC |
MĐCC |
|
Ở bệnh nhân nguy cơ tim mạch RẤT CAO, mục tiêu LDL-C < 1,8 mmol/L (70 mg/dL) hoặc giảm ít nhất 50% nếu LDL-C ban đầu ở khoảng giữa 1,8 và 3,5 mmol/L (70 và 135 mg/dL) được khuyến cáo. |
I |
B |
|
Ở bệnh nhân nguy cơ tim mạch CAO, mục tiêu LDL-C < 2,6 mmol/L (100 mg/dL) hoặc giảm ít nhất 50% nếu LDL-C ban đầu ở khoảng giữa 2,6 và 5,2 mmol/L (100 và 200 mg/dL) được khuyến cáo. |
I |
B |
|
Ở bệnh nhân nguy cơ THẤP hoặc TRUNG BÌNH, LDL-C < 3,0 mmol/L (< 115 mg/dL) được xem xét. |
IIa |
C |
3. ĐIỀU CHỈNH LỐI SỐNG
Vai trò của dinh dưỡng và lối sống trong dự phòng bệnh tim mạch đã được đánh giá nhiều. Nhiều chứng cứ mạnh cho thấy các yếu tố dinh dưỡng và lối sống có thể ảnh hưởng trực tiếp đến sự hình thành xơ vữa động mạch hoặc thông qua ảnh hưởng đến các yếu tố nguy cơ truyền thống như lipid huyết tương, huyết áp hoặc nồng độ đường huyết. Sự ảnh hưởng của thay đổi lối sống và thực phẩm lên nồng độ lipoprotein được đánh giá và tóm tắt ở bảng 6; trong bảng này mức độ tác dụng và mức độ chứng cứ đề cập ảnh hưởng của thay đổi lối sống lên nhóm lipoprotein chuyên biệt, không phải các kết cục bệnh tim mạch. ESC khuyến cáo các biện pháp thay đổi lối sống và chọn lựa thức ăn lành mạnh để điều trị nguy cơ tim mạch toàn thể như sau:
· Các khuyến cáo chế độ ăn nên luôn luôn xem xét thói quen sử dụng thực phẩm địa phương; tuy nhiên, chọn lựa thực phẩm lành mạnh từ các nền văn hóa khác cũng nên được khuyến khích.
· Nên ăn đa dạng thực phẩm. Nên điều chỉnh năng lượng nhập để phòng ngừa thừa cân và béo phì.
· Nên khuyến khích sử dụng trái cây, rau, cây họ đậu, hạt, ngũ cốc nguyên hạt và cá (đặc biệt cá có dầu).
· Nên thay thế thực phẩm giàu chất béo trans hoặc bão hòa (bơ cứng, dầu nhiệt đới, thịt nhiều chất béo hoặc nấu sẵn, kẹo, kem, bơ, pho mát thường) với các thực phẩm trên và chất béo đơn không bão hòa (dầu oliu) và chất béo đa không bão hòa (dầu thực vật không nhiệt đới) để giữ chất béo trans < 1% tổng năng lượng và chất béo bão hòa < 10% (< 7% trị số cholesterol huyết tương cao).
· Giảm nhập muối < 5 g/ngày bằng cách giảm muối ăn và hạn chế muối trong nấu ăn và chọn thực phẩm tươi hoặc đông lạnh không có muối; nhiều thức ăn chế biến sẵn có nồng độ muối cao bao gồm bánh mì.
· Đối với người sử dụng thức uống có cồn, nên tư vấn sử dụng mức độ trung bình (< 10g/ngày đối với nữ và < 20g/ngày đối với nam) và các bệnh nhân tăng triglyceride máu nên kiêng rượu.
· Nên hạn chế sử dụng thức uống và thực phẩm thêm đường, đặc biệt những người thừa cân, tăng triglyceride máu, hội chứng chuyển hóa hoặc đái tháo đường.
· Nên khuyến khích hoạt động thể lực, tập thể dục ít nhất 30 phút/ngày mỗi ngày.
· Nên tránh sử dụng và tiếp xúc với các sản phẩm thuốc lá.
Bảng 6. Ảnh hưởng của thay đổi lối sống lên nồng độ lipid
|
|
Mức độ tác dụng |
MĐCC |
|
Can thiệp lối sống làm giảm nồng độ cholesterol toàn phần và LDL-C |
||
|
Giảm ăn chất béo trans |
+++ |
A |
|
Giảm ăn chất béo bão hòa |
+++ |
A |
|
Tăng ăn chất xơ |
++ |
A |
|
Sử dụng thực phẩm chức năng giàu phytosterol |
++ |
A |
|
Sử dụng bổ sung gạo đỏ lên men |
++ |
A |
|
Giảm thừa cân |
++ |
A |
|
Giảm cholesterol trong chế độ ăn |
+ |
B |
|
Tăng thói quen hoạt động thể lực |
+ |
B |
|
Sử dụng sản phẩm protein đậu nành |
+/- |
B |
|
Can thiệp lối sống làm giảm nồng độ lipoprotein giàu triglyceride |
||
|
Giảm thừa cân |
+++ |
A |
|
Giảm uống rượu |
+++ |
A |
|
Tăng thói quen hoạt động thể lực |
++ |
A |
|
Giảm lượng carbohydrate trong chế độ ăn |
++ |
A |
|
Sử dụng viên bổ sung chất béo đa không bão hòa n-3 |
++ |
A |
|
Giảm nhập mono- và disaccharide |
++ |
B |
|
Thay thế chất béo bão hòa với chất béo đơn hoặc đa không bão hòa |
+ |
B |
|
Can thiệp lối sống làm tăng nồng độ HDL-C |
||
|
Giảm ăn chất béo trans |
+++ |
A |
|
Tăng thói quen hoạt động thể lực |
+++ |
A |
|
Giảm thừa cân |
++ |
A |
|
Giảm carbohydrate trong chế độ ăn và thay thế bằng chất béo không bão hòa |
++ |
A |
|
Có thể tiếp tục sử dụng mức độ trung bình ở những người uống rượu |
++ |
B |
|
Ngưng hút thuốc lá |
+ |
B |
|
Trong số thực phẩm giàu carbohydrate, ưu tiên chọn thực phẩm có chỉ số đường huyết thấp và chất xơ nhiều |
+/- |
C |
|
Giảm nhập mono- và disaccharide |
+/- |
C |
Mức độ tác dụng: +++ = tác dụng đáng kể, ++ = tác dụng ít đáng kể hơn, + = tác dụng ít, – = không hiệu quả
4. ĐIỀU TRỊ TĂNG CHOLESTEROL MÁU
4.1 Statin
Statin làm giảm tổng hợp cholesterol ở gan bằng cách ức chế hoạt tính HMG-CoA reductase. Mức độ giảm LDL-C phụ thuộc liều và thay đổi theo các statin khác nhau (Hình 1). Statin là thuốc được nghiên cứu nhiều nhất trong dự phòng bệnh tim mạch. Một số thử nghiệm quy mô lớn đã chứng minh statin làm giảm đáng kể bệnh suất và tử suất tim mạch trong dự phòng nguyên phát lẫn thứ phát ở cả hai giới và tất cả các nhóm tuổi. Statin làm giảm tiến triển hoặc thậm chí thúc đẩy sự thoái triển của mảng xơ vữa động mạch vành.
Chứng cứ hiện tại từ các phân tích gộp cho thấy lợi ích lâm sàng độc lập với loại statin nhưng phụ thuộc vào mức độ giảm LDL-C, do đó sử dụng loại statin nên dựa vào mục tiêu LDL-C ở bệnh nhân. Kế hoạch điều trị có thể được đặt ra như sau:
· Đánh giá nguy cơ tim mạch toàn thể của đối tượng.
· Yêu cầu bệnh nhân quyết định điều trị nguy cơ tim mạch.
· Xác định mục tiêu LDL-C cho mức nguy cơ đó.
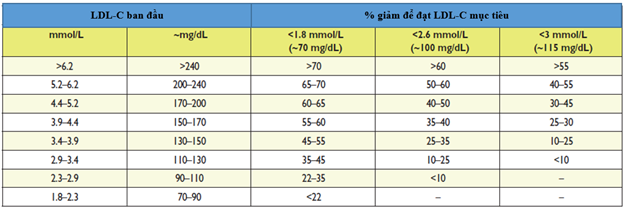
· Tính phần trăm LDL-C cần giảm để đạt mục tiêu đó (Bảng 8).
· Chọn một statin và liều trung bình có thể cung cấp mức giảm này.
· Đáp ứng với điều trị statin biến thiên, do đó có thể cần tăng liều.
· Nếu liều cao nhất dung nạp được không đạt mục tiêu, xem xét phối hợp thuốc.
· Ngoài ra, đối với các đối tượng nguy cơ rất cao và cao, nên đạt mức giảm LDL-C ≥ 50%.
· Mục tiêu LDL-C có thể đạt được bằng statin đơn trị hoặc phối hợp với các thuốc khác (Bảng 7).
Bảng 7. Khuyến cáo điều trị tăng cholesterol máu bằng thuốc
|
Khuyến cáo |
MĐKC |
MĐCC |
|
Kê đơn statin đến liều cao nhất theo khuyến cáo hoặc liều cao nhất dung nạp được để đạt mục tiêu. |
I |
A |
|
Trong trường hợp không dung nạp statin, ezetimibe hoặc thuốc gắn axit mật hoặc phối hợp các thuốc này nên được xem xét. |
IIa |
C |
|
Nếu không đạt được mục tiêu, phối hợp statin với thuốc ức chế hấp thu cholesterol nên được xem xét. |
IIa |
B |
|
Nếu không đạt dược mục tiêu, phối hợp statin với thuốc gắn axit mật có thể được xem xét. |
IIb |
C |
|
Ở bệnh nhân nguy cơ rất cao với LDL-C tăng kéo dài mặc dù điều trị liều statin cao nhất dung nạp được, phối hợp với ezetimibe hoặc ở bệnh nhân không dung nạp statin, thuốc ức chế PCSK9 có thể được xem xét. |
IIb |
C |
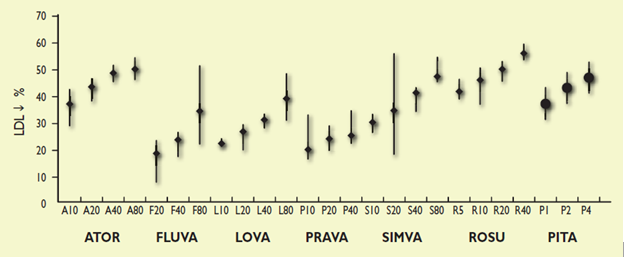
Hình 1. Mức độ giảm LDL-C của các statin qua tổng quan hệ thống và phân tích gộp. ATOR = atorvastatin; FLU = fluvastatin; LOVA = lovastatin; PRAVA = pravastatin; SIMVA = simvastatin; ROSU = rosuvastatin; PITA = pitavastatin
Bảng 8. Phần trăm giảm LDL-C để đạt mục tiêu theo trị số ban đầu
4.2 Thuốc gắn axit mật
Với liều cao nhất 24g cholestyramine, 20g colestipol hoặc 4,5g colesevelam, LDL-C giảm 18 -25%. Thuốc này không ảnh hưởng lên HDL-C nhưng có thể làm tăng triglyceride ở một số bệnh nhân. Trong các thử nghiệm lâm sàng, thuốc gắn axit mật góp phần chứng minh hiệu quả của giảm LDL-C trong giảm các biến cố tim mạch ở các bệnh nhân tăng cholesterol máu với lợi ích tỉ lệ thuận với mức độ giảm LDL-C. Tuy nhiên, nghiên cứu này được thực hiện trước khi nhiều chọn lựa điều trị hiện đại có sẵn.
4.3 Thuốc ức chế hấp thu cholesterol
Ezetimibe là thuốc giảm lipid đầu tiên ức chế hấp thu cholesterol trong thức ăn và mật mà không ảnh hưởng chất dinh dưỡng tan trong chất béo. Trong các thử nghiệm lâm sàng, đơn trị ezetimibe giảm LDL-C 15–22% ở các bệnh nhân tăng cholesterol máu. Điều trị phối hợp ezetimibe và statin làm giảm thêm 15-20% nồng độ LDL-C. Hiệu quả giảm các biến cố tim mạch của ezetimibe phối hợp với simvastatin được chứng minh ở bệnh nhân hẹp động mạch chủ trong nghiên cứu SEAS (Simvastatin and Ezetimibe in Aortic Stenosis study), bệnh nhân bệnh thận mạn trong nghiên cứu SHARP (Study of Heart and Renal Protection) và bệnh nhân sau hội chứng mạch vành cấp trong nghiên cứu IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial). Các nghiên cứu này ủng hộ đề nghị rằng giảm LDL-C bằng các thuốc ngoài statin có thể mang lợi ích và không có tác dụng phụ nặng. Tác dụng có lợi của ezetimibe cũng được hỗ trợ bằng các nghiên cứu di truyền về đột biến NPC1L1. Đột biến xảy ra tự nhiên bất hoạt protein này có liên quan với giảm LDL-C huyết tương và giảm nguy cơ bệnh mạch vành. Thực hiện cùng với các nghiên cứu khác như PRECISE-IVUS, IMPROVE-IT ủng hộ ezetimibe nên được sử dụng như điều trị hàng thứ hai phối hợp với statin khi mục tiêu điều trị không đạt được với liều statin cao nhất dung nạp được hoặc ở các bệnh nhân không dung nạp hoặc chống chỉ định với statin.
4.4 Thuốc ức chế PCSK9
Một nhóm thuốc mới gần đây, ức chế PCSK9, đã có mặt trên thị trường với cơ chế nhắm vào protein PCSK9 liên quan với kiểm soát thụ thể LDL. EMA (European Medicines Agency) và FDA (US Food and Drug Administration) đã chấp thuận hai kháng thể đơn dòng kiểm soát LDL-C huyết tương. Hiệu quả giảm LDL-C khoảng 50 – 70% độc lập với điều trị nền (statin, ezetimibe …); dữ liệu sơ bộ từ các thử nghiệm pha 3 cho thấy giảm các biến cố tim mạch cùng với giảm LDL-C. Một phân tích gộp gần đây khẳng định các phát hiện này [4]. Thuốc không có tác dụng lên HDL-C và triglyceride huyết tương. Tuy nhiên, tác dụng lên triglyceride phải được xác nhận lại trong các dân số với nồng độ triglyceride cao hơn. Nhóm thuốc này có hiệu quả giảm LDL-C ở tất cả bệnh nhân có khả năng biểu lộ thụ thể LDL ở gan. Do đó, thuốc ức chế PCSK9 hiệu quả ở phần lớn bệnh nhân bao gồm bệnh nhân tăng cholesterol dị hợp tử và hiệu quả thấp hơn ở bệnh nhân tăng cholesterol đồng hợp tử với biểu lộ thụ thể LDL tồn dư. Bệnh nhân tăng cholesterol đồng hợp tử thiếu thụ thể LDL đáp ứng kém với điều trị.
Bệnh nhân nguy cơ tim mạch toàn thể rất cao, tăng cholesterol dị hợp tử (và một số bệnh nhân tăng cholesterol đồng hợp tử) đang điều trị liều tối đa dung nạp được của thuốc hàng thứ nhất và hàng thứ hai và/hoặc lọc máu và không dung nạp statin với nồng độ LDL-C cao kéo dài là các ứng cử viên thích hợp cho sử dụng thuốc ức chế PSCK9.
4.5 Nicotinic acid
Nicotinic acid có tác dụng điều hòa lipid rộng, tăng HDL-C đến 25% phụ thuộc liều và giảm LDL-C 15 – 18% và triglyceride 20 – 40 % với liều 2 g/ngày. Axit nicotinic giảm Lp(a) đến 30% với liều này. Sau hai nghiên cứu về axit nicotinic [5],[6] cho thấy không có tác dụng lợi ích mà còn tăng tần suất tác dụng phụ nặng, không thuốc nào chứa axit nicotinic hiện tại được chấp thuận ở châu Âu.
5. ĐIỀU TRỊ TĂNG TRIGLYCERIDE MÁU
Mặc dù vai trò của triglyceride như là một yếu tố nguy cơ tim mạch vẫn còn tranh luận nhưng dữ liệu gần đây thiên về vai trò của các lipoprotein giàu triglyceride là yếu tố nguy cơ tim mạch. Các nghiên cứu tiến cứu lớn đã báo cáo nồng độ triglyceride lúc không nhịn đói tiên đoán nguy cơ bệnh mạch vành mạnh hơn triglyceride lúc đói.
Nồng độ triglyceride lúc đói ≤ 1,7 mmol/L (150 mg/dL) được mong đợi kiểm soát. Bước đầu tiên của chiến lược kiểm soát triglyceride huyết tương là xem xét các nguyên nhân và đánh giá nguy cơ tim mạch toàn thể. Mục tiêu chính là đạt nồng độ LDL-C khuyến cáo dựa vào mức nguy cơ tim mạch toàn thể. So với chứng cứ về lợi ích của giảm LDL-C, chứng cứ về lợi ích của giảm triglyceride vẫn còn khiêm tốn, và chủ yếu từ các phân tích dưới nhóm hoặc hậu kiểm. Tuy nhiên các chứng cứ gần đây về triglyceride là một yếu tố nguy cơ tim mạch có thể khuyến khích việc giảm triglyceride.
Mặc dù nguy cơ bệnh tim mạch gia tăng nếu triglyceride lúc đói > 1,7 mmol/L (150 mg/dL) nhưng việc sử dụng thuốc giảm triglyceride chỉ có thể xem xét ở những đối tượng nguy cơ cao khi triglyceride > 2,3 mmol/L (200 mg/dL) và không thể giảm bằng các biện pháp thay đổi lối sống. Các can thiệp bằng thuốc có sẵn bao gồm statin, fibrate, ức chế PCSK9. Axit nicotinic hiện không được chấp thuận bởi Cục Dược Phẩm Châu Âu EMA.
Bảng 9. Khuyến cáo về thuốc điều trị tăng triglyceride máu
|
Khuyến cáo |
MĐKC |
MĐCC |
|
Điều trị thuốc nên được xem xét ở các bệnh nhân nguy cơ cao với triglyceride > 2,3 mmol/L (200 mg/dL) |
IIa |
B |
|
Điều trị statin có thể được xem xét như thuốc đầu tay để giảm nguy cơ bệnh tim mạch ở những người tăng triglyceride máu nguy cơ cao. |
IIb |
B |
|
Ở các bệnh nhân nguy cơ cao với triglyceride > 2,3 mmol/L (200 mg/dL) mặc dù điều trị statin, fenofibrate có thể được xem xét phối hợp với statin. |
IIb |
C |
6. ĐIỀU TRỊ HDL-C THẤP
Nồng độ HDL-C thấp là một yếu tố tiên đoán mạnh và độc lập của nguy cơ phát triển sớm xơ vữa động mạch. Tình trạng tăng nguy cơ tim mạch liên quan nồng độ HLD-C thấp đặc biệt đáng kể trong ngưỡng HDL-C từ 0,65 đến 1,17 mmol/L (25 đến 45 mg/dL). Kết quả từ một phân tích gộp của bốn thử nghiệm can thiệp về sử dụng siêu âm nội mạch để đánh giá sự thay đổi của thể tích mảng xơ vữa động mạch vành, cho thấy tăng 7,5% HDL-C cùng với giảm LDL-C đến mục tiêu 2,0 mmol/L (< 80 mg/dL) là yêu cầu tối thiểu cho thoái triển mảng xơ vữa [7].
Các bệnh nhân đái tháo đường típ 2, rối loạn lipid máu hỗn hợp, suy thận và suy gan hoặc bệnh tự miễn thường có nồng độ HDL-C huyết tương thấp. Ngoài HDL-C thấp, các tình trạng này có tăng triglyceride máu trung bình hoặc nặng. Chuyển hóa nội mạch cuối cùng của các lipoprotein giàu triglyceride (chủ yếu VLDL) có liên quan với HDL. Tăng HDL-C bằng thuốc có thể làm giảm nồng độ VLDL và LDL.
Các chọn lựa sẵn có để điều trị HDL-C thấp tương đối ít. Trong khi nồng độ HDL-C có thể tăng đến 10% bằng cách thực hiện các biện pháp thay đổi lối sống bao gồm giảm cân, tập thể dục, ngưng hút thuốc và sử dụng rượu mức độ trung bình, nhiều bệnh nhân cần can thiệp bằng thuốc. Tuy nhiên, cho đến hiện tại chưa có chứng cứ rõ ràng rằng tăng HDL-C thực sự dẫn đến dự phòng bệnh tim mạch. Các nghiên cứu gần đây nhằm kiểm định giả thuyết này đã thất bại chứng minh bất kỳ tác dụng có lợi: ILLUMINATE (torcetrapib), Dalcetrapib Outcomes, ACCELERATE (evacetrapib), HPS2-THRIVE (axit nicotinic và statin), AIM-HIGH (axit nicotinic trên nền statin) [2]. Nghiên cứu REVEAL (the Randomized Evaluation of the Effects of Anacetrapib Through Lipid Modification) đang tiến hành sẽ cung cấp nhiều thông tin hơn [2].
Bảng 10. Khuyến cáo điều trị HDL-C thấp
|
Khuyến cáo |
MĐKC |
MĐCC |
|
Statin và fibrate làm tăng HDL-C với mức độ tương tự và các thuốc này có thể được xem xét. |
IIb |
B |
|
Hiệu quả của fibrate làm tăng HDL-C có thể bị giảm ở bệnh nhân đái tháo đường típ 2 |
IIb |
B |
7. ĐIỀU TRỊ RỐI LOẠN LIPID MÁU TRONG MỘT SỐ TÌNH HUỐNG LÂM SÀNG
7.1 Rối loạn lipid máu gia đình
Tăng cholesterol máu gia đình được khuyến cáo tầm soát ở các bệnh nhân bệnh mạch vành trước 55 tuổi ở nam và 60 tuổi ở nữ, những đối tượng có người thân trực hệ mắc bệnh tim mạch sớm tử vong hoặc không tử vong, có người thân bị u vàng ở gân và đối tượng tăng LDL-C nặng [người trưởng thành > 5 mmol/L (190 mg/dL), trẻ em > 4 mmol/L (150 mg/dL)]. Chẩn đoán xác định dựa vào tiêu chuẩn lâm sàng và phân tích ADN nếu được. Tầm soát các thành viên trong gia đình được khuyến cáo nếu chẩn đoán một trường hợp bị tăng cholesterol máu gia đình. Các bệnh nhân này được khuyến cáo điều trị bằng statin liều mạnh, thường phối hợp với ezetimibe (MĐKC: I; MĐCC: C). Điều trị nên hướng đến mục tiêu đạt LDL-C < 2,6 mmol/L (100 mg/dL) hoặc < 1,8 mmol/L (70 mg/dL) nếu có bệnh tim mạch. Nếu không thể đạt mục tiêu, giảm tối đa LDL-C nên được xem xét bằng cách sử dụng phối hợp thuốc thích hợp (MĐKC: IIa; MĐCC: C). Điều trị với kháng thể PCSK9 nên được xem xét ở bệnh nhân tăng cholesterol máu gia đình với bệnh tim mạch hoặc các yếu tố nguy cơ khác làm họ có nguy cơ rất cao bệnh mạch vành như các yếu tố nguy cơ bệnh tim mạch khác, tiền sử gia đình, Lp(a) cao hoặc không dung nạp statin (MĐKC: IIa. MĐCC: C).
Ở trẻ em, xét nghiệm được khuyến cáo từ 5 tuổi hoặc sớm hơn nếu nghi ngờ tăng cholesterol máu gia đình đồng hợp tử. Trẻ em mắc bệnh này nên được giáo dục thực hiện chế độ ăn phù hợp và điều trị bằng statin từ 8-10 tuổi. Mục tiêu điều trị nên là LDL-C < 3,5 mmol/L (135 mg/dL) ở tuổi > 10 (MĐKC: IIa, MĐCC: C).
7.2 Trẻ em
Chỉ trẻ em tăng cholesterol máu gia đình nên được xem xét điều trị bằng thuốc giảm lipid. Trong các trường hợp rối loạn lipid máu khác ở trẻ em, nên tập trung vào chế độ ăn và điều trị các rối loạn chuyển hóa cơ bản. Bệnh nhân tăng cholesterol máu gia đình đồng hợp tử nên được điều trị bằng thuốc giảm lipid càng sớm càng tốt, tương tự đối với bệnh nhân tăng cholesterol máu ia đình dị hợp tử với LDL-C rất cao như ≥ 400 mg/dL (≈ 10,3 mmol/L). Trong trường hợp trẻ em tăng cholesterol máu gia đình khác, điều trị statin nên trì hoãn đến khoảng 8-10 tuổi. Tuy nhiên, độ tuổi chính xác khởi trị statin là một vấn đề của đánh giá lâm sàng.
7.3 Phụ nữ
Trong số các nghiên cứu đánh giá ảnh hưởng của điều trị giảm lipid lên dự phòng nguyên phát và thứ phát bệnh mạch vành, chỉ một số nghiên cứu có phụ nữ với số lượng nhỏ, và các kết quả thường không được báo cáo riêng theo giới tính. Tuy nhiên, phân tích gộp CTT gần đây nhất cho thấy lợi ích tương đối tương tự giữa nam và nữ [8]. Điều trị statin được khuyến cáo dự phòng nguyên phát bệnh mạch vành ở phụ nữ nguy cơ cao. Statin được khuyến cáo dự phòng thứ phát ở nữ với cùng chỉ định và mục tiêu như ở nam. Các thuốc giảm lipid không nên sử dụng khi dự định mang thai, trong thai kỳ hoặc trong thời gian cho con bú; tuy nhiên, thuốc gắn axit mật (không hấp thu) có thể được xem xét.
7.4 Người cao tuổi
Điều trị statin được khuyến cáo ở người cao tuổi với bệnh tim mạch tương tự như các bệnh nhân trẻ (MĐKC: I, MĐCC: A). Vì người cao tuổi thường có bệnh đồng mắc và thay đổi dược lực học, thuốc giảm lipid nên được bắt đầu liều thấp và sau đó chỉnh liều thận trọng để đạt mục tiêu nồng độ lipid tương tự như ở các đối tượng trẻ (MĐKC: IIa, MĐCC: C). Điều trị statin nên được xem xét ở người cao tuổi không có bệnh tim mạch, đặc biệt khi có tăng huyết áp, hút thuốc lá, đái tháo đường và rối loạn lipid máu (MĐKC: IIa, MĐCC: B).
7.5 Đái tháo đường và hội chứng chuyển hóa
Rối loạn lipid máu trong hội chứng chuyển hóa bao gồm các bất thường lipid và lipoprotein như tăng triglyceride lúc đói và sau ăn, apoB, LDL nhỏ đậm đặc, HDL-C và apoA1 thấp. Non-HDL-C hoặc apoB là các dấu ấn đại diện tốt của các lipoprotein giàu triglyceride và tàn dư và là mục tiêu điều trị phụ. Non-HDL-C < 3,4 mmol/L (<130 mg/dL) hoặc apoB < 100 mg/dL cần đạt ở bệnh nhân nguy cơ cao và lần lượt < 2,6 mmol/L (< 100 mg/dL) và < 80 mg/dL ở bệnh nhân nguy cơ rất cao. Tăng vòng eo và tăng triglyceride có vẻ là công cụ đơn giản để chẩn đoán đối tượng hội chứng chuyển hóa nguy cơ cao. Rối loạn lipid máu sinh xơ vữa là một trong những yếu tố nguy cơ chính của bệnh tim mạch ở bệnh nhân đái tháo đường típ 2.
Ở các bệnh nhân đái tháo đường típ 1 và có albumin niệu vi lượng và/hoặc bệnh thận, giảm LDL-C (ít nhất 50%) bằng statin là lựa chọn đầu tiên được khuyến cáo bất kể nồng độ LDL-C ban đầu (MĐKC: I; MĐCC: C). Ở các bệnh nhân đái tháo đường típ 2 và bệnh tim mạch hoặc bệnh thận mạn, bệnh nhân không có bệnh tim mạch > 40 tuổi với một hoặc nhiều hơn các yếu tố nguy cơ tim mạch hoặc dấu ấn của tổn thương cơ quan đích, mục tiêu LDL-C khuyến cáo là < 1,8 mmol/L (< 70 mg/dL) và mục tiêu phụ non-HDL-C < 2,6 mmol/L (< 100 mg/dL) và apoB < 80 mg/dL (MĐKC: I; MĐCC: B). Ở tất cả bệnh nhân đái tháo đường típ 2 không có yếu tố nguy cơ và/hoặc chứng cứ của tổn thương cơ quan đích, LDL-C < 2,6 mmol/L (< 100 mg/dL) là mục tiêu chính; non-HDL-C < 3,4 mmol/L (< 130 mg/dL) và apoB < 100 mg/dL là mục tiêu phụ (MĐKC: I; MĐCC: B).
7.6 Hội chứng mạch vành cấp và can thiệp mạch vành qua da
Tất cả bệnh nhân hội chứng mạch vành cấp được khuyến cáo khởi trị hoặc tiếp tục statin liều cao sớm sau khi nhập viện nếu không có chống chỉ định hoặc tiền sử không dung nạp bất kể trị số LDL-C ban đầu (MĐKC: I, MĐCC: A). Nếu không đạt mục tiêu LDL-C với liều statin cao nhất dung nạp được, ezetimibe nên được xem xét phối hợp với statin ở bệnh nhân sau hội chứng mạch vành cấp (MĐKC: IIa, MĐCC: B). Nếu không đạt mục tiêu LDL-C với liều statin cao nhất dung nạp được và/hoặc ezetimibe, ức chế PCSK9 có thể được xem xét trên nền điều trị giảm lipid; đơn trị hoặc phối hợp với ezetimibe ở bệnh nhân không dung nạp statin hoặc chống chỉ định với statin (MĐKC: IIa; MĐCC: C). Lipid nên được đánh giá lại 4-6 tuần sau hội chứng mạch vành cấp để xác định có đạt mục tiêu nồng độ LDL-C < 1,8 mmol/L (< 70 mg/dL) hoặc giảm ít nhất 50% nếu trị số ban đầu 1,8-3,5 mmol/L (70-135 mg/dL) và xem có các vấn đề về tính an toàn hay không. Liều điều trị nên được điều chỉnh phù hợp. Liều nạp thường quy với statin liều cao (trên nền điều trị mạn tính) trước can thiệp mạch vành qua da nên được xem xét trong can thiệp mạch vành qua da chương trình hoặc hội chứng mạch vành cấp không ST chênh lên (MĐKC: IIa; MĐCC: A).
7.7 Suy tim và bệnh van tim
Điều trị giảm cholesterol với statin không được khuyến cáo (nhưng không gây hại) ở bệnh nhân suy tim không có chỉ định sử dụng (MĐKC: III, MĐCC: A). Axit béo đa không bão hòa n-3 1g/ngày có thể được xem xét thêm vào điều trị tối ưu ở bệnh nhân suy tim (MĐKC: IIb, MĐCC: B). Điều trị giảm cholesterol không được khuyến cáo ở bệnh nhân hẹp van động mạch chủ không có bệnh mạch vành và không có chỉ định sử dụng (MĐKC: III, MĐCC: A).
7.8 Bệnh tự miễn
Bệnh tự miễn, bao gồm viêm khớp dạng thấp, lupus ban đỏ hệ thống, vảy nến và hội chứng kháng phospholipid, làm tăng xơ vữa động mạch, bệnh suất và tử suất tim mạch cao hơn so với dân số chung. Statin có hiệu quả giảm mức độ hoạt động bệnh, biến cố tim mạch và tử vong (đặc biệt trong dự phòng nguyên phát) ở tình trạng bệnh này, trong khi ngưng statin có thể làm tăng nhồi máu cơ tim và tử vong [9]. Tuy nhiên, không khuyến cáo điều trị giảm lipid chỉ dựa vào sự hiện diện của bệnh này (MĐKC: III, MĐCC: C).
7.9 Bệnh thận mạn
Bệnh thận mạn giai đoạn 3-5 được xem là nguy cơ cao hoặc rất cao. Statin hoặc statin/ezetimibe được chỉ định ở các bệnh nhân bệnh thận mạn không lọc máu (MĐKC: I, MĐCC: A). Ở các bệnh nhân bệnh thận mạn lọc máu và không có bệnh tim mạch do xơ vữa, không nên khởi trị statin (MĐKC: III; MĐCC: A). Ở các bệnh nhân đã dùng statin, ezetimibe hoặc phối hợp statin/ezetimibe tại thời điểm bắt đầu lọc máu, các thuốc này nên được tiếp tục, đặc biệt ở các bệnh nhân bệnh tim mạch (MĐKC: IIa, MĐCC: C). Ở người trưởng thành ghép thận, điều trị với statin có thể được xem xét (MĐKC: IIb, MĐCC: C).
7.10 Ghép tạng
Chiến lược quản lý nguy cơ tim mạch toàn thể cần được thực hiện ở bệnh nhân ghép tạng. Statin nên được xem là lựa chọn hàng đầu ở bệnh nhân ghép tạng, khởi trị liều thấp và cẩn thận tăng liều, thận trọng về tiềm năng tương tác thuốc-thuốc, nhất là ở bệnh nhân dùng ciclosporin (MĐKC: IIa, MĐCC: B). Ở các bệnh nhân không dung nạp statin hoặc rối loạn lipid máu nặng và nguy cơ tồn dư cao mặc dù liều statin cao nhất dung nạp được, điều trị thay thế hoặc thêm vào có thể được xem xét: ezetimibe đối với bệnh nhân có LDL-C cao là bất thường chính; hoặc fibrate đối với bệnh nhân tăng triglyceride và/hoặc HDL-C thấp là bất thường chính (MĐKC: IIb; MĐCC: C).
7.11 Bệnh động mạch ngoại biên
Thuật ngữ bệnh động mạch ngoại biên bao gồm các động mạch cảnh, cột sống, chi trên, mạc treo, thận và chi dưới. Động mạch chủ thường được bao gồm trong thuật ngữ này. Bệnh động mạch ngoại biên là tình trạng nguy cơ tim mạch rất cao và điều trị giảm lipid (chủ yếu statin) được khuyến cáo ở những bệnh nhân này (MĐKC: I, MĐCC: A). Điều trị statin nên được xem xét để phòng ngừa tiến triển của phình động mạch chủ bụng (MĐKC: IIa, MĐCC: B).
7.12 Đột quỵ
Điều trị statin để đạt mục tiêu được khuyến cáo ở các bệnh nhân nguy cơ cao hoặc rất cao nhằm dự phòng nguyên phát đột quỵ (MĐKC: I, MĐCC: A). Điều trị giảm lipid được khuyến cáo ở bệnh nhân có các biểu hiện khác của bệnh tim mạch để dự phòng nguyên phát đột quỵ (MĐKC: I, MĐCC: A). Điều trị statin mạnh được khuyến cáo ở bệnh nhân có tiền sử đột quỵ thiếu máu não không do thuyên tắc từ tim hoặc cơn thoáng thiếu máu não để dự phòng thứ phát đột quỵ (MĐKC: I, MĐCC: A).
7.13 Bệnh nhân HIV
Bệnh nhân nhiễm HIV điển hình có cholesterol toàn phần và LDL-C thấp cũng như HDL-C thấp và triglyceride cao. Điều trị kháng siêu vi (ART – antiretroviral treatment) hoặc điều trị kháng siêu vi hoạt tính cao (HAART – highly active antiretroviral treatment) làm tăng đáng kể cholesterol toàn phần, LDL-C và triglyceride và ưu thế các phần tử LDL nhỏ đậm đặc trong khi HDL-C vẫn thấp. Bệnh nhân nhiễm HIV có nguy cơ bệnh tim mạch cao hơn người không nhiễm HIV [nguy cơ tương đối 1,61 (khoảng tin cậy 95% 1,43 – 1,83)], trong khi ART (và đặc biệt thuốc ức chế protease thế hệ cũ) làm tăng thêm nguy cơ lên đến 2 lần [nguy cơ tương đối 2,00 (khoảng tin cậy 95% 1,70 – 2,37]. Nguy cơ tim mạch vẫn còn cao sau khi hiệu chỉnh các yếu tố nguy cơ truyền thống. Điều trị giảm lipid (chủ yếu statin) nên được xem xét ở bệnh nhân HIV rối loạn lipid máu để đạt mục tiêu LDL-C như đã định nghĩa đối với nhóm nguy cơ cao (MĐKC: IIa, MĐCC: C).
7.14 Rối loạn tâm thần
Sự hiện diện của rối loạn tâm thần nặng như tâm thần phân liệt hoặc rối loạn lưỡng cực gây ra tác dụng có hại đối với nguy cơ phát triển bệnh tim mạch. Tình trạng này liên quan với lối sống không lành mạnh ở phần lớn bệnh nhân này (lối sống tĩnh tại, chế độ ăn không cân đối, hút thuốc lá) và điều trị thuốc. Một số thuốc chống loạn thần, thuốc chống trầm cảm, thuốc chống lo âu và ổn định khí sắc có liên quan với tăng cân và rối loạn tim mạch – chuyển hóa bao gồm rối loạn lipid máu và rối loạn đường huyết.
Rối loạn tâm thần nặng là các yếu tố bổ sung đối với đánh giá nguy cơ tim mạch toàn thể. Điều trị nguy cơ tim mạch toàn thể ở bệnh nhân rối loạn tâm thần không khác với những gì được khuyến cáo ở bệnh nhân nguy cơ cao/rất cao (MĐKC: I, MĐCC: C). Ở bệnh nhân rối loạn tâm thần, cần chú ý đến sự tuân thủ thay đổi lối sống và điều trị thuốc.
8. THEO DÕI LIPID VÀ MEN Ở BỆNH NHÂN ĐIỀU TRỊ RỐI LOẠN LIPID MÁU
Chứng cứ từ các thử nghiệm về xét nghiệm nào nên được thực hiện để theo dõi lipid ở các bệnh nhân đang điều trị còn hạn chế. Chứng cứ cũng hạn chế về các xét nghiệm độc tính như ALT và CK. Các khuyến cáo sau bắt nguồn từ đồng thuận hơn là y học chứng cứ.
Bao lâu nên xét nghiệm lipid?
Trước khi bắt đầu điều trị thuốc giảm lipid, nên thực hiện ít nhất hai lần xét nghiệm cách nhau 1-12 tuần, ngoại trừ các trường hợp cần điều trị thuốc ngay lập tức như bệnh nhân hội chứng mạch vành cấp và nguy cơ rất cao.
Bao lâu nên xét nghiệm lipid của bệnh nhân sau khi bắt đầu điều trị giảm lipid?
· 8 (±4) tuần sau khi bắt đầu điều trị
· 8 (±4) tuần sau khi chỉnh liều đến khi trong phạm vi mục tiêu
Bao lâu nên xét nghiệm lipid khi bệnh nhân đạt mục tiêu hoặc nồng độ lipid tối ưu?
Hàng năm (trừ khi có các vấn đề tuân trị hoặc các lý do chuyên biệt cần đánh giá thường xuyên hơn).
Bao lâu nên xét nghiệm thường quy men gan (ALT) ở bệnh nhân điều trị thuốc giảm lipid?
· Trước khi điều trị
· Mỗi 8-12 tuần sau khi bắt đầu điều trị một thuốc hoặc sau khi tăng liều.
· Kiểm tra thường quy ALT sau đó không được khuyến cáo trong điều trị giảm lipid.
Chuyện gì xảy ra nếu men gan tăng ở người đang sử dụng thuốc giảm lipid?
· Nếu ALT < 3 lần giới hạn trên của bình thường (GHTBT):
♦ Tiếp tục điều trị
♦ Kiểm tra lại men gan trong 4-6 tuần.
· Nếu trị số tăng ≥ 3 lần GHTBT:
♦ Ngưng điều trị giảm lipid hoặc giảm liều và kiểm tra lại men gan trong vòng 4-6 tuần.
♦ Thận trọng điều trị lại có thể được xem xét sau khi ALT trở về bình thường.
♦ Nếu ALT vẫn còn tăng, tìm các nguyên nhân khác
Bao lâu nên xét nghiệm CK ở bệnh nhân đang sử dụng thuốc giảm lipid máu?
· Trước điều trị
♦ Trước khi khởi trị
♦ Nếu CK ban đầu gấp 4 lần GHTBT, không khởi trị, kiểm tra lại.
· Theo dõi
♦ Không cần thiết theo dõi thường quy CK.
♦ Kiểm tra CK nếu bệnh nhân đau cơ.
♦ Thận trọng về bệnh cơ và tăng CK ở các bệnh nhân có nguy cơ như: người cao tuổi, điều trị tương tác thuốc đồng thời, điều trị nhiều thuốc, bệnh gan hoặc thận hoặc vận động viện thể thao.
Chuyện gì xảy ra nếu CK tăng ở người đang sử dụng thuốc giảm lipid?
· Đánh giá lại chỉ định điều trị statin.
· Nếu ≥ 4 lần GHTBT:
♦ Nếu CK > 10 lần GHTBT: ngưng điều trị, kiểm tra chức năng thận và theo dõi CK mỗi 2 tuần.
♦ Nếu CK < 10 lần GHTBT: nếu không triệu chứng, có thể tiếp tục điều trị giảm lipid trong khi theo dõi CK.
♦ Nếu CK < 10 lần GHTBT: nếu có triệu chứng, ngưng statin và theo dõi bình thường hóa CK trước khi thử điều trị lại với liều statin thấp hơn.
♦ Xem xét khả năng tăng CK thoáng qua vì những lý do khác như gắng sức.
♦ Xem xét bệnh cơ nếu CK vẫn còn tăng.
♦ Xem xét điều trị phối hợp hoặc thuốc thay thế
· Nếu < 4 lần GHTBT:
♦ Nếu không có triệu chứng cơ, tiếp tục statin (bệnh nhân nên được cảnh báo báo cáo triệu chứng, kiểm tra CK).
♦ Nếu có triệu chứng cơ, theo dõi triệu chứng và CK thường xuyên.
♦ Nếu triệu chứng kéo dài, ngưng statin và đánh giá lại triệu chứng sau 6 tuần; đánh giá lại chỉ định điều trị statin.
♦ Xem xét thử điều trị lại với statin đang dùng hoặc statin khác.
♦ Xem xét statin liều thấp với liều cách ngày hoặc một/hai lần mỗi tuần hoặc điều trị phối hợp.
Tóm lại, hướng dẫn về rối loạn lipid máu của ESC/EAS 2016 kế thừa những quan điểm và khuyến cáo của hướng dẫn cách đây 5 năm, đồng thời cập nhật thêm những khuyến cáo mới từ kết quả của các nghiên cứu và sự ra đời của các thuốc mới. Hướng dẫn mới này của ESC/EAS sẽ giúp các bác sĩ chọn lựa những tiếp cận tối ưu hơn trong việc quản lý các bệnh nhân rối loạn lipid máu, góp phần cải thiện các biến cố tim mạch cho bệnh nhân và giảm gánh nặng toàn cầu của bệnh tim mạch do xơ vữa.
TÀI LIỆU THAM KHẢO
1. Mann DL, et al. Braunwalds heart disease : a textbook of cardiovascular medicine 2015, 10th edition.
2. Catapano AL, et al. 2016 ESC/EAS guidelines for the management of dyslipidemia. European Heart Journal, doi:10.1093/eurheart/ehw272.
3. Langsted A, Nordestgaard BG. Nonfasting lipids, lipoproteins, and apolipoproteins in individuals with and without diabetes: 58.434 individuals from the Copenhagen General Population Study. Clin Chem 2011; 57: 482-489.
4. Navarese EP, et al. Proprotein convertase subtilistin/kexin type 9 monoclonal antibodies for acute coronary syndrome: a narrative review. Ann Intern Med 2016; 164: 600-607.
5. AIM-HIGH Investigators, Boden WE, et al. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med 2011; 365: 2255-2267.
6. HPS2-THRIVE Collaborative Group, Landray MJ, et al. Effects of extended-release niacin with laropiprant in high-risk patients. N Engl J Med 2014; 371: 203-212.
7. Nicholls SJ, et al. Statins, high-density lipoprotein cholesterol, and regression of coronary atherosclerosis. JAMA 2007; 297: 499-508.
8. Cholesterol Treatment Trialists (CTT) Collaboration, Fulcher J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376: 1670-1681.
9. De Vera MA, et al. Statin discontinuation and risk of acute myocardial infarction in patients with rheumatoid arthritis: a population-based cohort study. Ann Rheum Dis 2011; 70: 1020-1024.







