NGUYỄN DƯƠNG KHANG*, NGUYỄN THANH HIỀN
* Khoa Tim mạch can thiệp, BV Đại học Y Dược TP. Hồ Chí Minh
I. Tổng quan
Aldosterone là loại hormon mineralcorticoid chính, được sản sinh từ vùng cầu là lớp ngoài cùng của vỏ tuyến thượng thận. Aldosterone có vai trò trong điều hòa thể tích máu và huyết áp thông qua cơ chế ổn định muối – Kali. Tác động của aldosterone được thông qua các cơ chế do gen và không do gen. Các cơ chế do gen bao gồm việc gắn aldosterone vào các thụ thể trong tế bào, từ đó giải mã gen liên quan đến điều chỉnh trương lực mạch máu và cân bằng nước – điện giải; các cơ chế không do gen liên quan đến việc gắn trực tiếp aldosterone vào các thụ thể màng chuyển biệt tại tim, mạch máu, và mô thận [1]. Tiết aldosterone quá mức là hậu quả của quá trình sản sinh phụ thuộc renin của cường aldosterone nguyên phát (PA) hoặc tăng hoạt hệ thống renin-angiotensin-aldosterone (RAAS) như trong cường aldosterone thứ phát của suy tim. Trong cả hai trường hợp, việc giữ muối và nước sẽ dẫn đến tăng thể tích, co mạch, và thiếu hụt kali; từ đó dẫn đến tăng huyết áp. Aldosterone cũng thúc đẩy tiến trình stress oxy hóa và làm giảm hoạt lực sinh học của nitric oxide [2], dẫn đến giảm trương lực mạch máu, làm nặng hơn quá trình xơ hóa mạch máu do aldosterone (Hình 1).
Thụ thể mineralcorticoid (RA) hiện diện trong các tế bào cơ trơn động mạch vành [2]. Tăng tiết aldosterone sẽ làm tái cấu trúc mạch máu và cơ tim, xơ hóa cơ tim, suy chức năng nội mạc; từ đó làm tăng nguy cơ biến cố tim mạch và tử vong tim mạch [3–5]. Nhiều nghiên cứu đã đưa ra bằng chứng về lợi ích của việc ức chế aldosterone [6–9]. Do vậy, ức chế aldosterone được khuyến cáo trong điều trị suy tim với phân suất tống máu giảm [10–12]. Trong bài này, chúng tôi sẽ nói về sự tăng hoạt tín hiệu aldosterone trong các bệnh lý tim mạch, đồng thời nhấn mạnh những con đường gây tổn thương cơ tim, và vai trò của MRA trong thực hành lâm sàng.
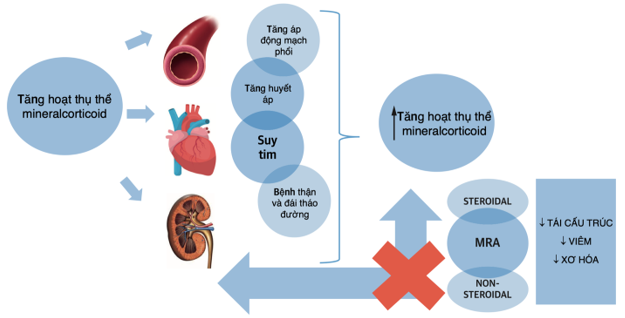
Hình 1. Hiệu quả của MRAs trên thận, tim và mạch máu
II. Aldosterone và tái cấu trúc cơ tim
Nồng độ aldosterone cao có thể gây phì đại cơ tim. Ở các tế bào cơ tâm thất của chuột sơ sinh, việc truyền aldosterone có thể trực tiếp kích thích phì đại thông qua hoạt hóa thụ thể mineralocorticoid và các yếu tố phiên mã liên quan [13]. Cesari và cộng sự [14] cho thấy bệnh nhân cường aldosterone nguyên phát và thứ phát có tỷ lệ phì đại thất trái cao (lần lượt 61% và 39%) và rối loạn chức năng tâm trương (35% và 36%) so với nhóm chứng khỏe mạnh. Ngoài ra, ở bệnh nhân PA (primary aldosteronism), còn ghi nhận tình trạng rối loạn chức năng tâm thu dưới lâm sàng với biến dạng tâm thu vách liên thất cực đại và mức co rút giữa vách thấp hơn so với bệnh nhân cường aldosterone thứ phát (20% so với 23%; P ≤ 0,001 và 15,9% so với 16,7%; P = 0,001). Chen và cộng sự [15] báo cáo sự giảm đáng kể sức căng dọc toàn bộ ở bệnh nhân PA so với bệnh nhân tăng huyết áp nguyên phát (–17,84 ± 2,36 so với –20,13 ± 2,32; P < 0,001). Sức căng dọc toàn bộ có tương quan có ý nghĩa với nồng độ kali huyết thanh (r = –0,261; P = 0,033), chỉ số khối lượng LV (r = 0,299; P = 0,014), log hoạt tính renin huyết tương (r = –0,302; P = 0,013), log tỷ lệ aldosterone/renin (r = 0,329; P = 0,007), và log nồng độ aldosterone niệu 24 giờ (r = 0,326; P = 0,007). Điều này gợi ý rằng nồng độ aldosterone cao có thể gây rối loạn chức năng tâm thu dưới lâm sàng. Ở bệnh nhân PA, xơ hóa cơ tim tăng lên, được gợi ý qua hình ảnh cộng hưởng từ tim. Freel và cộng sự nhận thấy tần suất tăng đáng kể hiện tượng tăng tín hiệu gadolinium muộn không do nhồi máu ở bệnh nhân PA (16/23; 70%) so với bệnh nhân tăng huyết áp nguyên phát (5/39; 13%; P < 0,0001) [16]. Ngoài ra, bệnh nhân PA còn có mức superoxide và CRP cao hơn có ý nghĩa. Hiện tượng đảo ngược tái cấu trúc tim đã được ghi nhận sau cắt bỏ tuyến thượng thận ở bệnh nhân phẫu thuật, cũng như sự giảm xơ hóa cơ tim [17].
III. Aldosterone và cơ chế phân tử của tổn thương cơ tim
Cơ chế phân tử của rối loạn chức năng cơ tim liên quan đến nồng độ aldosterone huyết tương cao vẫn chưa được hiểu rõ hoàn toàn. Aldosterone có thể hoạt hóa enzym NADPH oxidase, dẫn đến sản sinh các gốc oxy phản ứng (ROS), gây apoptosis tế bào cơ tim và xơ hóa. Cannavo và cộng sự [18] đã chứng minh rằng tác dụng gây phì đại của aldosterone lên tim được trung gian bởi các kinase thụ thể bắt cặp protein G ty thể (GRKs) phụ thuộc MR. Đặc biệt, GRK2 di chuyển vào ty thể, thúc đẩy chết tế bào, trong khi GRK5 chuyển vị vào nhân, hoạt hóa phiên mã các gen tiền phì đại. Trong nghiên cứu của Cannavo, các tế bào cơ thất tách từ chuột sơ sinh phơi nhiễm mạn tính với aldosterone cao có sự biểu hiện quá mức GRK2, phụ thuộc vào hoạt hóa cả MR và thụ thể angiotensin loại 1 (AT1R), và liên quan đến sự hình thành ROS, rối loạn chức năng ty thể và apoptosis; đồng thời, hoạt hóa tín hiệu MR–AT1R còn gây chuyển vị GRK5 vào nhân với sự phiên mã myocyte enhancer factor-2, gây tình trạng phì đại bất lợi. Việc điều trị tế bào trước bằng losartan hoặc spironolactone ức chế hoạt hóa GRK2 và GRK5. Dù aldosterone được sản xuất quá mức, rối loạn chức năng cơ tim được ngăn chặn hoàn toàn ở chuột được ức chế GRK2 và giảm nhẹ ở chuột được ức chế GRK5; hơn nữa, chuột được ức chế GRK5 không phát triển phì đại cơ tim. Do đó, GRK liên quan đến tín hiệu MR–AT1R chịu trách nhiệm cho rối loạn chức năng tim và có thể trở thành mục tiêu tiềm năng trong điều trị suy tim.
He và cộng sự [19] ghi nhận ở chuột, nồng độ aldosterone cao sau nhồi máu cơ tim gây hoạt hóa NADPH oxidase, sản sinh ROS, và hoạt hóa oxy hóa Ca2+/calmodulin kinase II (CaMKII) ở tế bào cơ tim với sự biểu hiện quá mức MMP-9, dẫn đến vỡ tim. Các tác giả cũng chứng minh rằng ức chế CaMKII cơ tim trong mô hình chuột sau MI có liên quan đến giảm hoạt hóa MMP9 và vỡ tim. Điều này gợi ý rằng hoạt hóa oxy hóa CaMKII thúc đẩy tác dụng gây độc tim của aldosterone sau MI. Hơn nữa, hoạt hóa CaMKII gây cường phosphoryl hóa các kênh Na+ phụ thuộc điện thế và thụ thể ryanodine type 2, dẫn đến hậu quả rối loạn nhịp.
Mối liên hệ giữa aldosterone và xơ vữa động mạch đã được chứng minh rõ. Bệnh nhân PA có nguy cơ cao biến chứng tim mạch, bệnh động mạch vành và nhồi máu cơ tim so với bệnh nhân tăng huyết áp nguyên phát. Trong một nghiên cứu hồi cứu của Mulatero và cộng sự [20], bệnh nhân PA có tỷ lệ biến cố tim mạch và não cao hơn so với bệnh nhân tăng huyết áp nguyên phát, cả ở thời điểm ban đầu (14,1% so với 8,4%; P = 0,007) và trong quá trình theo dõi (8,5% so với 4,3%; P = 0,008). Inoue và cộng sự [21] chứng minh rằng nồng độ aldosterone cao có liên quan đến tăng nguy cơ xơ vữa động mạch dưới lâm sàng (đánh giá bằng điểm vôi hóa động mạch vành) và tử vong do mọi nguyên nhân ở bệnh nhân có hoạt tính renin huyết tương bị ức chế. McGraw và cộng sự [22] cho thấy trên mô hình chuột, truyền aldosterone làm tăng xơ vữa ở những vùng dòng chảy rối loạn và gây viêm mảng xơ vữa thông qua hoạt hóa yếu tố tăng trưởng nhau thai tiền viêm, thúc đẩy tăng sinh tế bào cơ trơn và hóa ứng động bạch cầu đơn nhân. Tác dụng gây loạn nhịp của aldosterone có thể liên quan đến hoạt hóa kênh Ca2+ loại L ở cơ tim và giảm hoạt động của dòng K+ tái cực nhanh Ikr cũng như dòng K+ thoáng qua [23]. Ngoài ra, aldosterone còn làm tăng giải phóng Ca2+ từ lưới cơ tương thông qua hoạt hóa thụ thể ryanodine, dẫn đến quá tải Ca2+ [24]. Tác hại của aldosterone đối với loạn nhịp được giảm nhờ các thuốc đối kháng MR (MRA). Trong thử nghiệm RALES, bệnh nhân suy tim được điều trị bằng spironolactone giảm 31% nguy cơ tử vong do nguyên nhân tim mạch so với nhóm giả dược (P < 0,001), nhờ cả việc giảm tiến triển suy tim và giảm đột tử thông qua ngăn ngừa xơ hóa cơ tim và tái cấu trúc. Stambler và cộng sự [25] chứng minh rằng eplerenone làm giảm tái cấu trúc điện học thất và giảm nguy cơ nhịp nhanh thất ở mô hình chó suy tim do kích thích thất nhanh.
IV. MRA trong thực hành lâm sàng
Hình 2 thể hiện hệ RAA và tác động trên tim, thận, và mạch máu; và những bệnh lý là hậu quả của việc tăng hoạt tính này. Hình 3 thể hiện tình trạng cường aldosterone và các bệnh lý gây tình trạng này, có hoặc không phụ thuộc renin.
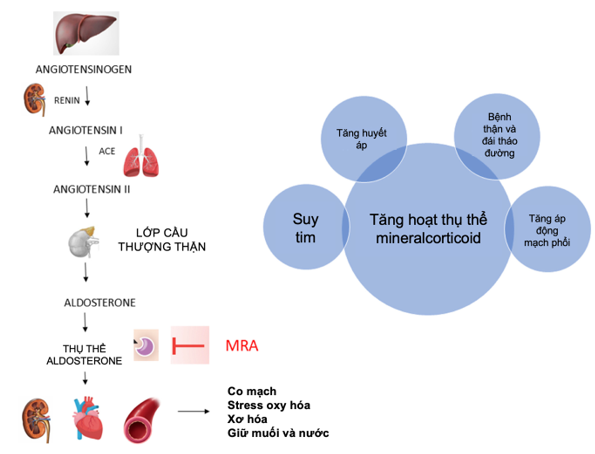
Hình 2. Mô phỏng trục renin-angiotensin-aldosterone và tác động trên tim, thận và mạch máu
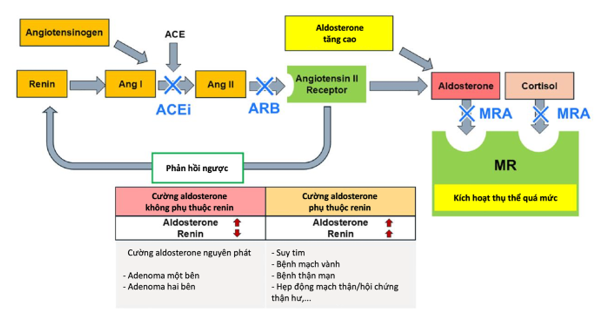
Hình 3. Cường aldosterone phụ thuộc và không phụ thuộc renin [26]
4.1 MRA trong tăng huyết áp
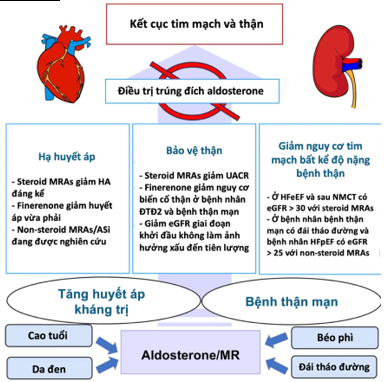
Hình 4. Ứng dụng sớm điều trị kháng aldosterone trong quản lý bệnh nhân tăng huyết áp kháng trị và bệnh thận mạn [26]
Sự hoạt hóa quá mức hệ renin–angiotensin–aldosterone đóng vai trò then chốt trong cơ chế bệnh sinh của tăng huyết áp cũng như các bệnh tim mạch và thận. Thuốc ức chế men chuyển angiotensin và thuốc chẹn thụ thể angiotensin II là nền tảng trong điều trị tăng huyết áp, cùng với thuốc chẹn beta, thuốc lợi tiểu, và thuốc chẹn kênh canxi. Theo khuyến cáo 2024 của Hội Tim châu Âu về quản lý tăng huyết áp [27], có từ 10% đến 20% bệnh nhân bị tăng huyết áp kháng trị, được định nghĩa là không đạt được huyết áp mục tiêu mặc dù đã có thay đổi lối sống và điều trị bằng liều dung nạp tối đa của nhiều thuốc, bao gồm thuốc lợi tiểu, thuốc ức chế RAAS, và thuốc chẹn kênh canxi, sau khi đã loại trừ các nguyên nhân như chẩn đoán nhầm (như do bệnh nhân không tuân thủ điều trị hoặc đo huyết áp sai). Tăng huyết áp kháng trị không phải là một bệnh riêng biệt, mà là chỉ dấu của nhóm bệnh nhân có nguy cơ tim mạch cao, trong đó tăng huyết áp thứ phát cũng thường gặp [27]. Bệnh nhân tăng huyết áp kháng trị có nguy cơ cao hơn về các biến cố tim mạch (nhồi máu cơ tim, đột quỵ, bệnh thận giai đoạn cuối, và tử vong) so với bệnh nhân kiểm soát huyết áp tốt [28].
Các thử nghiệm lâm sàng, bao gồm nghiên cứu PATHWAY-2 [29], đã khẳng định rằng spironolactone là thuốc hiệu quả nhất trong điều trị tăng huyết áp kháng trị, thể hiện ở khả năng hạ huyết áp tâm thu mạnh hơn so với giả dược (–8,7 mmHg; 95% CI: –9,72 đến –7,69; P < 0,0001), so với phối hợp đồng thời doxazosin và bisoprolol (–4,26 mmHg; 95% CI: –5,13 đến –3,38; P < 0,0001), so với doxazosin đơn độc (–4,03 mmHg; 95% CI: –5,04 đến –3,02; P < 0,0001), và so với bisoprolol đơn độc (–4,48 mmHg; 95% CI: –5,50 đến –3,46; P < 0,0001). Tác dụng phụ chính là tăng kali máu, vú to ở nam, rối loạn kinh nguyệt và chảy máu sau mãn kinh ở nữ (chủ yếu do tác động đối kháng với thụ thể hormone steroid), thường dẫn đến việc ngừng thuốc.
Các bằng chứng hiện có cho thấy nguy cơ cộng hưởng rất cao về biến cố tim mạch và thận ở bệnh nhân tăng huyết áp kháng trị và bệnh thận mạn, trong đó aldosterone và sự hoạt hóa thụ thể mineralocorticoid đóng vai trò trung gian quan trọng. Liệu các liệu pháp nhắm trúng đích aldosterone, bao gồm MRA và/hoặc ức chế tổng hợp aldosterone (aldosterone synthase inhibitors – ASis), không chỉ có tác dụng hạ huyết áp mà còn mang lại lợi ích chống viêm và chống xơ hóa, từ đó có thể giúp giảm cả nguy cơ thận và nguy cơ tim mạch thông qua cơ chế hạ huyết áp và cả các cơ chế ngoài huyết áp. Tuy nhiên, về mặt lịch sử, các thử nghiệm lâm sàng trên bệnh nhân TRH chủ yếu tập trung vào hiệu quả hạ huyết áp hoặc giảm albumin niệu của các can thiệp khác nhau như thuốc hoặc phương pháp cắt đốt thần kinh thận, điều này có thể hạn chế việc áp dụng trong thực hành lâm sàng [30–32].
Phân tích gộp của nhóm Blood Pressure Lowering Treatment Trialists’ Collaboration cho thấy các phác đồ dựa trên ACEi làm giảm nguy cơ phát triển suy tim, trong khi thuốc chẹn kênh canxi không có hiệu quả này dù mang lại mức giảm huyết áp tương tự [33]. Trong chương trình FIDELITY, finerenone làm giảm có ý nghĩa nguy cơ khởi phát suy tim hoặc tiến triển đến bệnh thận giai đoạn cuối dù chỉ có tác dụng hạ huyết áp ở mức tối thiểu, trên quần thể bệnh nhân T2DM và CKD (đặc trưng bởi tình trạng tăng aldosterone rõ rệt) [34,35]. Những phát hiện này nhấn mạnh rằng việc chỉ tập trung hạ huyết áp đơn thuần có thể không phải là cách tiếp cận toàn diện để ngăn ngừa các biến cố đe dọa tính mạng.
Hơn nữa, mặc dù việc hạ huyết áp ở bệnh nhân CKD có thể giảm nguy cơ tim mạch, nhưng tác động của nó đến tiến triển CKD lại cho kết quả không nhất quán [36,37]. Do bệnh nhân TRH phải đối mặt với nguy cơ kép vừa phát triển biến cố tim mạch vừa biến cố thận, nên cần tiến hành các nghiên cứu dài hạn hơn với các tiêu chí lâm sàng cứng như tử vong tim mạch, nhập viện vì suy tim, đột quỵ, NMCT, và tiến triển đến ESKD; hoặc cân nhắc sử dụng tiêu chí gộp cardio-kidney outcome trong các thử nghiệm lâm sàng trên bệnh nhân TRH và CKD [38]. Để giảm hiệu quả nguy cơ tim mạch và thận, điều quan trọng là phải hiểu rõ các cơ chế tiềm ẩn của sự hình thành và tiến triển TRH và CKD. Mặc dù việc đo nồng độ aldosterone không được thực hiện thường quy trong thực hành lâm sàng do quy trình phức tạp và chịu ảnh hưởng bởi các thuốc điều trị thay đổi diễn tiến bệnh [39], nhưng việc triển khai liệu pháp nhắm trúng đích aldosterone/MR ngay từ giai đoạn sớm của TRH và/hoặc CKD là thiết yếu nếu muốn phòng ngừa hậu quả tim mạch và thận của các bệnh này (Hình 4).
4.2 MRA trong hội chứng vành cấp
Nồng độ aldosterone cao có liên quan đến lắng đọng collagen và xơ hóa mô kẽ, gây tái cấu trúc mạch máu và phì đại cơ tim. Ở bệnh nhân nhồi máu cơ tim (MI), việc sử dụng sớm thuốc đối kháng thụ thể mineralocorticoid (MRAs) đã được chứng minh giúp ngăn ngừa tái cấu trúc tim [40]. Các thử nghiệm ngẫu nhiên có đối chứng trước đây đã nghiên cứu lợi ích của việc dùng MRA sớm ở bệnh nhân MI.
Trong nghiên cứu REMINDER (Early Eplerenone Treatment In Patients With Acute ST-Elevation Myocardial Infarction Without Heart Failure) [41], việc bổ sung eplerenone vào điều trị chuẩn trong vòng 24 giờ từ khi khởi phát triệu chứng ở bệnh nhân STEMI không có suy tim giúp giảm tiêu chí gộp chính (tử vong tim mạch, nhập viện lại hoặc kéo dài thời gian nằm viện do suy tim, nhịp nhanh thất hoặc rung thất kéo dài, LVEF ≤ 40%, hoặc BNP/NT-proBNP tăng cao) sau 1 tháng và trong thời gian theo dõi trung bình 10,5 tháng; tác dụng chủ yếu nhờ giảm BNP.
Nghiên cứu ALBATROSS (Aldosterone Lethal Effects Blockade in Acute Myocardial Infarction Treated With or Without Reperfusion to Improve Outcome and Survival at Six Months Follow-Up) [42] không chứng minh được hiệu quả của việc dùng sớm một liều tĩnh mạch canrenoate kali 200 mg, sau đó spironolactone đường uống 25 mg/ngày trong 6 tháng, bổ sung vào điều trị chuẩn so với điều trị chuẩn đơn thuần ở bệnh nhân MI cấp, bất kể có hay không suy tim hoặc rối loạn chức năng thất trái. Kết cục chính (tử vong, ngừng tim được cấp cứu, loạn nhịp thất nặng, chỉ định cấy ICD, hoặc suy tim mới/xấu đi tại 6 tháng) xảy ra với tỷ lệ tương tự ở nhóm điều trị (11,8%) và nhóm chứng (12,2%). Các tác giả cho rằng lợi ích của MRA ở bệnh nhân hội chứng vành cấp (ACS) chủ yếu nhờ trên nhóm có suy tim.
Trong nghiên cứu EPHESUS (Eplerenone Post-AMI Heart Failure Efficacy and Survival Study) [8], bổ sung eplerenone (25 mg/ngày, liều tối đa 50 mg/ngày) ở bệnh nhân MI cấp biến chứng suy tim làm giảm bệnh suất tim mạch (RR: 0,87; 95% CI: 0,79–0,95; P = 0,002) và tử vong (RR: 0,83; 95% CI: 0,72–0,94; P = 0,005) với độ an toàn chấp nhận được. Khuyến cáo ESC 2023 về ACS khuyên dùng MRA ở bệnh nhân ACS có LVEF ≤ 40% kèm suy tim [43].
4.3 MRA trong suy tim
Nhiều thử nghiệm đã chứng minh hiệu quả của MRA ở bệnh nhân suy tim phân suất tống máu giảm (HFrEF), bất kể căn nguyên.
Trong nghiên cứu RALES (Effect of Spironolactone on Morbidity and Mortality in Patients With Severe Heart Failure) [7], bổ sung spironolactone 25 mg/ngày vào điều trị chuẩn giúp giảm 35% nguy cơ bệnh suất và tử vong tim mạch (RR tử vong: 0,70; 95% CI: 0,60–0,82; P < 0,001; RR nhập viện: 0,65; 95% CI: 0,54–0,77; P < 0,001).
Thử nghiệm EMPHASIS-HF (Eplerenone in Mild Patients Hospitalization and Survival Study in Heart Failure) [9] chứng minh rằng bổ sung eplerenone (tối đa 50 mg/ngày) ở bệnh nhân suy tim tâm thu mạn, triệu chứng nhẹ giúp giảm tử vong tim mạch và nhập viện vì suy tim; tiêu chí gộp (tử vong tim mạch hoặc nhập viện vì suy tim) xảy ra ở 18,3% nhóm eplerenone so với 25,9% nhóm giả dược (HR: 0,63; 95% CI: 0,54–0,74; P < 0,001). Nghiên cứu EPHESUS [8] đã chứng minh lợi ích của MRA ở bệnh nhân ACS biến chứng suy tim. Trong nghiên cứu TOPCAT (Treatment of Preserved Cardiac Function Heart Failure With An Aldosterone Antagonist) [44], spironolactone được đánh giá ở bệnh nhân suy tim phân suất tống máu bảo tồn. Kết quả ghi nhận spironolactone không giảm tiêu chí gộp chính (tử vong tim mạch, ngừng tim cấp cứu, hoặc nhập viện vì suy tim); sau theo dõi trung bình 3,3 năm, kết cục chính xảy ra ở 18,6% nhóm spironolactone so với 20,4% nhóm giả dược (HR: 0,89; 95% CI: 0,77–1,04; P = 0,14). Tuy nhiên, có giảm đáng kể nhập viện vì suy tim (12,0% so với 14,2%; HR: 0,83; 95% CI: 0,69–0,99; P = 0,04). Đáng chú ý, tỷ lệ nhập viện cao hơn ở phân nhóm có nồng độ peptide lợi niệu tăng trong vòng 60 ngày trước so với nhóm chỉ có tiền sử nhập viện vì suy tim [45].
Tất cả các thử nghiệm này đã khẳng định lợi ích của việc ức chế aldosterone, vì vậy MRA đã được đưa vào khuyến cáo của ACC/AHA và ESC trong điều trị suy tim với phân suất tống máu giảm [10–12].
Một nghiên cứu gần đây [46] trên bệnh nhân amyloidosis tim thể transthyretin cho thấy thường phải ngưng các thuốc suy tim kinh điển (ACEi, ARB), trong khi MRA dung nạp tốt và giảm nguy cơ tử vong (HR: 0,82; 95% CI: 0,71–0,94; P = 0,004).
4.4 Tác dụng trên tim – thận của finerenone
Sự tăng điều hòa của thụ thể mineralocorticoid đóng vai trò then chốt trong tiến triển xấu của bệnh thận và tổn thương tim mạch, thúc đẩy tình trạng viêm và xơ hóa, đặc biệt ở bệnh nhân đái tháo đường típ 2. Sự ức chế hệ RAA truyền thống bằng thuốc ức chế men chuyển, chẹn thụ thể angiotensin II và thuốc đối vận thụ thể mineralocorticoid vẫn chưa đủ để ngăn chặn tiến triển bệnh thận và bệnh tim mạch. Gần đây, thuốc SGLT2i [47] đã chứng minh hiệu quả trong việc làm chậm tiến triển bệnh thận và giảm biến chứng tim mạch. Tuy nhiên, dù đã được điều trị bằng RAAS blocker và SGLT2i, bệnh nhân mắc bệnh thận mạn và T2DM vẫn còn nguy cơ cao tiến triển CKD và biến chứng tim mạch [48].
Finerenone là một MRA không steroid, chọn lọc, mới được chỉ định cho bệnh nhân CKD (giai đoạn 3 và 4 kèm albumin niệu) và T2DM. Ba thử nghiệm lâm sàng giai đoạn III quan trọng đã đánh giá finerenone ở bệnh nhân CKD và T2DM trên nền điều trị RAAS blocker tối đa dung nạp: FIDELIO-DKD (Finerenone in Reducing Kidney Failure and Disease Progression in Diabetic Kidney Disease) [49], FIGARO-DKD (Finerenone in Reducing Cardiovascular Mortality and Morbidity in Diabetic Kidney Disease) [50], và phân tích gộp định trước FIDELITY (Combined FIDELIO-DKD and FIGARO-DKD Trial program analysis) [34]. Trong thử nghiệm FIDELIO-DKD, finerenone làm giảm 18% tiêu chí chính gồm: suy thận, giảm ≥40% eGFR so với ban đầu, hoặc tử vong do nguyên nhân thận (HR: 0,82; KTC 95%: 0,73-0,93; P = 0,001) và giảm 14% tiêu chí phụ gồm: tử vong do tim mạch, NMCT không tử vong, đột quỵ không tử vong, hoặc nhập viện vì suy tim (HR: 0,86; KTC 95%: 0,75-0,99) trong thời gian theo dõi trung vị 2,6 năm. Trong FIGARO-DKD, tiêu chí chính (tử vong do tim mạch, NMCT không tử vong, đột quỵ không tử vong, hoặc nhập viện vì suy tim) giảm đáng kể sau 3,4 năm theo dõi trung vị (HR: 0,87; KTC 95%: 0,76-0,98; P = 0,03). Hiệu quả chủ yếu đến từ giảm tỷ lệ nhập viện vì suy tim ở nhóm finerenone so với giả dược (3,2% so với 4,4%; HR: 0,71; KTC 95%: 0,56-0,90). Ở cả hai thử nghiệm, tần suất tăng kali máu cao hơn ở bệnh nhân dùng finerenone.
Phân tích gộp FIDELITY bao gồm 13.026 bệnh nhân từ cả FIDELIO-DKD và FIGARO-DKD. Sau 3 năm theo dõi trung vị, finerenone làm giảm có ý nghĩa kết cục tim mạch gộp (tử vong tim mạch, đột quỵ không tử vong, NMCT không tử vong, và nhập viện vì suy tim) (HR: 0,86; KTC 95%: 0,78-0,95; P = 0,0018) cũng như nhập viện vì suy tim đơn thuần (HR: 0,78; KTC 95%: 0,66-0,92; P = 0,003). Dựa trên các kết quả này, finerenone được khuyến cáo cho bệnh nhân suy tim kèm T2DM và CKD trong Bản cập nhật trọng điểm 2023 của Hướng dẫn ESC 2021 về chẩn đoán và điều trị suy tim cấp và mạn.
Vì bệnh nhân HFrEF bị loại khỏi các thử nghiệm trên, nghiên cứu FINEARTS-HF [51] đã được phát triển để đánh giá tác động của finerenone đến tử vong tim mạch và biến cố suy tim ở bệnh nhân suy tim với LVEF ≥40% bất kể có CKD hoặc đái tháo đường hay không. Finerenone giảm 18% biến cố suy tim (RR: 0,82; KTC 95%: 0,71-0,94; P = 0,006); tuy nhiên, sự khác biệt về tử vong tim mạch không có ý nghĩa (8,1% so với 8,7% ở nhóm finerenone và giả dược) [52]. Nguy cơ tăng kali máu (>5,5 mmol/L) cao hơn ở nhóm finerenone (14,3% so với 6,9%), nhưng không có ca tử vong và rất ít ca nhập viện do biến cố này. Ngoài ra, SGLT2i và finerenone có thể có tác dụng hiệp đồng. Nghiên cứu CONFIDENCE (NCT05254002) [53] đang được tiến hành để đánh giá hiệu quả phối hợp empagliflozin với finerenone ở bệnh nhân CKD và T2DM.
So với các MRA steroid như spironolactone và eplerenone, finerenone chứng minh hiệu quả giảm tiến triển bệnh thận và bệnh tim mạch với tỷ lệ tăng kali máu thấp hơn. Bảng 1 trình bày đặc điểm chính của các MRA steroid và không steroid. Hình 5 trình bày tập trung vào cơ chế tác động và ứng dụng của MRAs cũng như ASis trên lâm sàng.
Bảng: Các đặc điểm chính của MRAs loại steroid (Spironolactone, eplerenone) và non-steroid (Finerenone)
| Steroidal MRA | Nonsteroidal MRA | ||
| Spironolactone | Eplerenone | Finerenone | |
| Chọn lọc MR | + | ++ | +++ |
| Tương thích MR | +++ | + | +++ |
| Thu nhận
đồng yếu tố MR |
Đồng vận một phần | Đồng vận một phần | Đồng vận ngược |
| Phân bổ trong mô | Thận > tim | Thận > tim | Thận = tim |
| Thời gian bán hủy | > 20 giờ | 4 – 6 giờ | 2 – 3 giờ |
| Chuyển hóa hoạt động | ++ | – | – |
| Tác dụng phụ
trên sinh dục |
++ | + | – |
| Tăng kali máu | ++ | ++ | + |
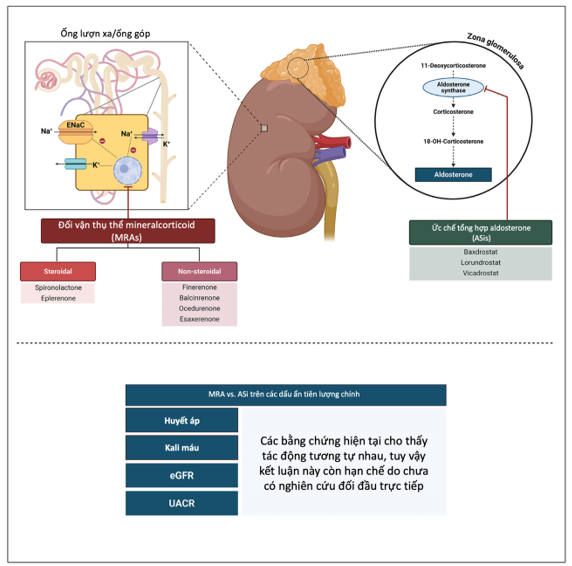
Hình 5. Cơ chế tác động, ứng dụng lâm sàng khả dĩ của MRAs và ASis trên các dấu ấn tiên lượng chính
4.5 MRA trong rung nhĩ
Tăng huyết áp động mạch là yếu tố nguy cơ lớn cho rung nhĩ (AF) [54]. Tăng aldosterone gây tái cấu trúc tim và biến đổi điện sinh lý, thúc đẩy hình thành AF. Bệnh nhân cường aldosterone nguyên phát có nguy cơ AF cao gấp 3,52 lần so với bệnh nhân tăng huyết áp (theo phân tích gộp 31 nghiên cứu) [55]. Tỷ lệ hiện mắc PA ở bệnh nhân AF là 42% [68]; do đó, khuyến cáo sàng lọc PA trong quần thể AF. Phẫu thuật cắt bỏ u tuyến thượng thận ở bệnh nhân PA làm giảm nguy cơ xuất hiện AF [56]. Các nghiên cứu gộp quy mô lớn cho thấy MRA có hiệu quả giảm rung nhĩ mới khởi phát và rung nhĩ tái phát [57,58]. Do đó, hướng dẫn hiện tại của ESC về rung nhĩ khuyến nghị sử dụng MRA như liệu pháp upstream trong bệnh nhân AF [59].
Ở những bệnh nhân mắc bệnh thận mạn kèm đái tháo đường týp 2, quá trình tái cấu trúc cơ tim và các biến chứng tại thận làm gia tăng nguy cơ xuất hiện rung nhĩ hoặc cuồng nhĩ (AFF). Finerenone – một thuốc đối kháng thụ thể mineralocorticoid không steroid chọn lọc thế hệ mới – đã cho thấy khả năng ức chế tái cấu trúc cơ tim trong các mô hình tiền lâm sàng. Dựa trên dữ liệu từ thử nghiệm FIDELIO-DKD [60], nghiên cứu này nhằm đánh giá hiệu quả của finerenone đối với biến cố AFF mới khởi phát, cũng như tác động lên các kết cục tim – thận phân nhóm theo tiền sử AFF. Các bệnh nhân CKD và ĐTĐ týp 2 đủ điều kiện (có tỷ số albumin/creatinine niệu từ 30 đến 5.000 mg/g, eGFR từ 25 đến <75 ml/phút/1,73 m² và đang được điều trị tối ưu bằng thuốc ức chế hệ renin-angiotensin) được phân ngẫu nhiên theo tỷ lệ 1:1 dùng finerenone hoặc giả dược. Kết quả ghi nhận trong tổng số 5.674 bệnh nhân tham gia, có 461 trường hợp (8,1%) đã có tiền sử AFF. Tỷ lệ xuất hiện AFF mới ở nhóm dùng finerenone thấp hơn đáng kể so với nhóm giả dược (3,2% so với 4,5%; HR 0,71; KTC 95%: 0,53–0,94; p = 0,016). Đáng chú ý, hiệu quả của finerenone trên các kết cục chính về thận và tim mạch không bị ảnh hưởng bởi tiền sử AFF ban đầu (p tương tác lần lượt là 0,16 và 0,85) (Hình 6). Tóm lại, ở bệnh nhân CKD kèm ĐTĐ tuýp 2, finerenone giúp giảm nguy cơ mắc mới AFF, đồng thời giảm thiểu các biến cố thận hoặc tim mạch bất kể bệnh nhân có tiền sử rung nhĩ/cuồng nhĩ hay không.
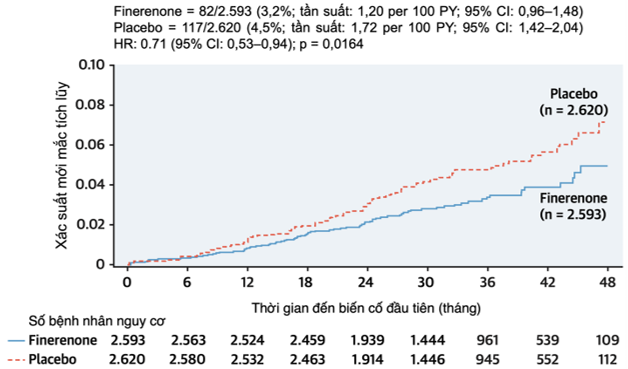
Hình 6. Thời gian đến biến cố rung-cuồng nhĩ đầu tiên ở những bệnh nhân chưa có tiền sử rung-cuồng nhĩ
4.6 MRA trong tăng áp động mạch phổi
PAH đặc trưng bởi tái cấu trúc mạch máu phổi, dày thành động mạch phổi nhỏ, tăng dần sức cản mạch phổi và áp lực động mạch phổi, kèm theo tiên lượng xấu. Ở bệnh nhân PAH, nồng độ aldosterone huyết tương tăng cao, gợi ý MR có vai trò trong tái cấu trúc mạch máu phổi [73]. Hoạt hóa MR ở tế bào cơ tim, tế bào nội mô và cơ trơn mạch máu thúc đẩy viêm và tái cấu trúc bất lợi tim – mạch. Các nghiên cứu trên động vật và in vitro cho thấy những yếu tố như thiếu oxy, endothelin-1 và angiotensin II có thể trực tiếp kích thích sản xuất aldosterone tại hệ mạch phổi [61,62]. Hoạt hóa MR ở tế bào mạch phổi làm thay đổi tín hiệu NO thông qua tăng sản xuất ROS và hoạt hóa các yếu tố sinh xơ như TGF, collagen-1, MMP-2 và MMP-9 [63].
Trong mô hình PAH trên chuột, điều trị MRA sau khi khởi phát suy thất phải cho thấy cải thiện chức năng tim trên MRI: tăng chỉ số tim, cải thiện tỷ số thể tích cuối tâm trương thất phải/thất trái và mức độ lệch vách [64]. Các nghiên cứu lâm sàng gợi ý lợi ích của MRA trong PAH. Trong phân tích hồi cứu các thử nghiệm ARIES-1 và ARIES-2, phối hợp spironolactone và ambrisentan ở bệnh nhân PAH cải thiện quãng đường đi bộ 6 phút và giảm BNP so với ambrisentan đơn trị [65]. Hướng dẫn ESC/ERS 2022 về chẩn đoán và điều trị tăng áp phổi [66] khuyến cáo hạn chế dịch và sử dụng lợi tiểu (loop, thiazide, và MRA) ở bệnh nhân PAH có suy thất phải.
V. Kết luận
Nồng độ aldosterone cao có liên quan với tái cấu trúc mạch máu và cơ tim, xơ hóa cơ tim, rối loạn chức năng nội mạc và đồng thời làm tăng nguy cơ biến cố tim mạch và tử vong do tim mạch. MRA là loại thuốc được chứng minh hiệu quả rõ rệt trong nhiều bệnh cảnh liên quan với tăng hoạt hệ RAA, như tăng huyết áp, hội chứng vành cấp, suy tim, và tăng áp phổi. MRA non-steroid như finerenone làm giảm tiến triển bệnh lý thận và tim mạch với tần suất tăng kali thấp hơn ở những bệnh nhân suy tim, bệnh thận mạn, và đái tháo đường típ 2.
TÀI LIỆU THAM KHẢO
[1] Funder JW. Aldosterone and the Cardiovascular System: Genomic and Nongenomic Effects. Endocrinology. 2006;147(12):5564–5567.
[2] Jaffe IZ, Mendelsohn ME. Angiotensin II and Aldosterone Regulate Gene Transcription Via Functional Mineralocortocoid Receptors in Human Coronary Artery Smooth Muscle Cells. Circulation Research. 2005;96(6):643–650.
[3] Buffolo F, Tetti M, Mulatero P, et al. Aldosterone as a Mediator of Cardiovascular Damage. Hypertension. 2022;79(9):1899–1911.
[4] Duprez D, De Buyzere M, Rietzschel ER, et al. Aldosterone and vascular damage. Current Science Inc. 2000;2(3):327–334.
[5] Petramala L, Pignatelli P, Carnevale R, et al. Oxidative stress in patients affected by primary aldosteronism. Journal of Hypertension. 2014;32(10):2022.
[6] Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med. 1999;341(10):709–717.
[7] Pitt B, Remme W, Zannad F, et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med. 2003;348(14):1309–1321.
[8] Pitt B, Bakris G, Ruilope LM, et al. Serum potassium and clinical outcomes in the Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study (EPHESUS). Circulation. 2008;118(16):1643–1650.
[9] Zannad F, McMurray JJV, Krum H, et al. Eplerenone in Patients with Systolic Heart Failure and Mild Symptoms. New England Journal of Medicine. 2011;364(1):11–21.
[10] Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Journal of the American College of Cardiology. 2022;79(17):e263–e421.
[11] McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal. 2021;42(36):3599–3726.
[12] McDonagh TA, Metra M, Adamo M, et al. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2023;44(37):3627–3639.
[13] Okoshi MP, Yan X, Okoshi K, et al. Aldosterone directly stimulates cardiac myocyte hypertrophy. Journal of Cardiac Failure. 2004;10(6):511–518.
[14] Cesari M, Letizia C, Angeli P, et al. Cardiac Remodeling in Patients With Primary and Secondary Aldosteronism. Circulation: Cardiovascular Imaging. 2016;9(6):e004815.
[15] Chen Z-W, Huang K-C, Lee J-K, et al. Aldosterone induces left ventricular subclinical systolic dysfunction: a strain imaging study. Journal of Hypertension. 2018;36(2):353.
[16] Freel EM, Mark PB, Weir RAP, et al. Demonstration of Blood Pressure-Independent Noninfarct Myocardial Fibrosis in Primary Aldosteronism. Circulation: Cardiovascular Imaging. 2012;5(6):740–747.
[17] Lin Y-H, Wu X-M, Lee H-H, et al. Adrenalectomy reverses myocardial fibrosis in patients with primary aldosteronism. Journal of Hypertension. 2012;30(8):1606.
[18] Cannavo A, Liccardo D, Eguchi A, et al. Myocardial pathology induced by aldosterone is dependent on non-canonical activities of G protein-coupled receptor kinases. Nat Commun. 2016;7(1):10877.
[19] He BJ, Joiner MA, Singh MV, et al. Oxidation of CaMKII determines the cardiotoxic effects of aldosterone. Nat Med. 2011;17(12):1610–1618.
[20] Savard S, Amar L, Plouin P-F, et al. Cardiovascular Complications Associated With Primary Aldosteronism. Hypertension. 2013;62(2):331–336.
[21] Mulatero P, Monticone S, Bertello C, et al. Long-Term Cardio- and Cerebrovascular Events in Patients With Primary Aldosteronism. J Clin Endocrinol Metab. 2013;98(12):4826–4833.
[22] McGraw AP, Bagley J, Chen W, et al. Aldosterone Increases Early Atherosclerosis and Promotes Plaque Inflammation Through a Placental Growth Factor‐Dependent Mechanism. Journal of the American Heart Association. 2013;2(1):e000018.
[23] Bénitah JP, Perrier E, Gómez AM, et al. Effects of aldosterone on transient outward K+ current density in rat ventricular myocytes. J Physiol. 2001;537(Pt 1):151–160.
[24] Ouvrard-Pascaud A, Sainte-Marie Y, Bénitah J-P, et al. Conditional Mineralocorticoid Receptor Expression in the Heart Leads to Life-Threatening Arrhythmias. Circulation. 2005;111(23):3025–3033.
[25] Stambler BS, Laurita KR, Shroff SC, et al. Aldosterone blockade attenuates development of an electrophysiological substrate associated with ventricular tachyarrhythmias in heart failure. Heart Rhythm. 2009;6(6):776–783.
[26] Kobayashi M, Pitt B, Ferreira JP, et al. Aldosterone-targeted therapies: early implementation in resistant hypertension and chronic kidney disease. Eur Heart J. 2025;46(27):2618–2642.
[27] McEvoy JW, McCarthy CP, Bruno RM, et al. 2024 ESC Guidelines for the management of elevated blood pressure and hypertension. Eur Heart J. 2024;45(38):3912–4018.
[28] Carey RM, Calhoun DA, Bakris GL, et al. Resistant Hypertension: Detection, Evaluation, and Management: A Scientific Statement From the American Heart Association. Hypertension. 2018;72(5):e53–e90.
[29] Williams B, MacDonald TM, Morant S, et al. Spironolactone versus placebo, bisoprolol, and doxazosin to determine the optimal treatment for drug-resistant hypertension (PATHWAY-2): a randomised, double-blind, crossover trial. The Lancet. 2015;386(10008):2059–2068.
[30] Schlaich MP, Bellet M, Weber MA, et al. Dual endothelin antagonist aprocitentan for resistant hypertension (PRECISION): a multicentre, blinded, randomised, parallel-group, phase 3 trial. Lancet. 2022;400(10367):1927–1937.
[31] Muxfeldt ES, Margallo V, Costa LMS, et al. Effects of Continuous Positive Airway Pressure Treatment on Clinic and Ambulatory Blood Pressures in Patients With Obstructive Sleep Apnea and Resistant Hypertension. Hypertension. 2015;65(4):736–742.
[32] Bhatt DL, Vaduganathan M, Kandzari DE, et al. Long-term outcomes after catheter-based renal artery denervation for resistant hypertension: final follow-up of the randomised SYMPLICITY HTN-3 Trial. The Lancet. 2022;400(10361):1405–1416.
[33] Effects of different blood-pressure-lowering regimens on major cardiovascular events: results of prospectively-designed overviews of randomised trials. The Lancet. 2003;362(9395):1527–1535.
[34] Agarwal R, Filippatos G, Pitt B, et al. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022;43(6):474–484.
[35] Filippatos G, Anker SD, Pitt B, et al. Finerenone and Heart Failure Outcomes by Kidney Function/Albuminuria in Chronic Kidney Disease and Diabetes. JACC: Heart Failure. 2022;10(11):860–870.
[36] Xie X, Atkins E, Lv J, et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: updated systematic review and meta-analysis. The Lancet. 2016;387(10017):435–443.
[37] Cheung AK, Rahman M, Reboussin DM, et al. Effects of Intensive BP Control in CKD. Journal of the American Society of Nephrology. 2017;28(9):2812.
[38] Patel RB, Ter Maaten JM, Ferreira JP, et al. Challenges of Cardio-Kidney Composite Outcomes in Large-Scale Clinical Trials. Circulation. 2021;143(9):949–958.
[39] Funder JW, Carey RM, Mantero F, et al. The Management of Primary Aldosteronism: Case Detection, Diagnosis, and Treatment: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2016;101(5):1889–1916.
[40] Hayashi M, Tsutamoto T, Wada A, et al. Immediate Administration of Mineralocorticoid Receptor Antagonist Spironolactone Prevents Post-Infarct Left Ventricular Remodeling Associated With Suppression of a Marker of Myocardial Collagen Synthesis in Patients With First Anterior Acute Myocardial Infarction. Circulation. 2003;107(20):2559–2565.
[41] Montalescot G, Pitt B, Lopez de Sa E, et al. Early eplerenone treatment in patients with acute ST-elevation myocardial infarction without heart failure: The Randomized Double-Blind Reminder Study. Eur Heart J. 2014;35(34):2295–2302.
[42] Beygui F, Cayla G, Roule V, et al. Early Aldosterone Blockade in Acute Myocardial Infarction. JACC. 2016;67(16):1917–1927.
[43] Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023;44(38):3720–3826.
[44] Pitt B, Pfeffer MA, Assmann SF, et al. Spironolactone for Heart Failure with Preserved Ejection Fraction. New England Journal of Medicine. 2014;370(15):1383–1392.
[45] McMurray JJV, O’Connor C. Lessons from the TOPCAT Trial. New England Journal of Medicine. 2014;370(15):1453–1454.
[46] Ioannou A, Massa P, Patel RK, et al. Conventional heart failure therapy in cardiac ATTR amyloidosis. Eur Heart J. 2023;44(31):2893–2907.
[47] Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al. Dapagliflozin in Patients with Chronic Kidney Disease. New England Journal of Medicine. 2020;383(15):1436–1446.
[48] D’Marco L, Puchades MJ, Gandía L, et al. Finerenone: A Potential Treatment for Patients with Chronic Kidney Disease and Type 2 Diabetes Mellitus. 2021 [cited 2025 Oct 4];
[49] Bakris GL, Agarwal R, Anker SD, et al. Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. New England Journal of Medicine. 2020;383(23):2219–2229.
[50] Pitt B, Filippatos G, Agarwal R, et al. Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes. New England Journal of Medicine. 2021;385(24):2252–2263.
[51] Vaduganathan M, Claggett BL, Lam CSP, et al. Finerenone in patients with heart failure with mildly reduced or preserved ejection fraction: Rationale and design of the FINEARTS-HF trial. European Journal of Heart Failure. 2024;26(6):1324–1333.
[52] Solomon SD, McMurray JJV, Vaduganathan M, et al. Finerenone in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. New England Journal of Medicine. 2024;391(16):1475–1485.
[53] Green JB, Mottl AK, Bakris G, et al. Design of the COmbinatioN effect of FInerenone anD EmpaglifloziN in participants with chronic kidney disease and type 2 diabetes using a UACR Endpoint study (CONFIDENCE). Nephrol Dial Transplant. 2023;38(4):894–903.
[54] Reil J-C, Hohl M, Selejan S, et al. Aldosterone promotes atrial fibrillation. Eur Heart J. 2012;33(16):2098–2108.
[55] Monticone S, D’Ascenzo F, Moretti C, et al. Cardiovascular events and target organ damage in primary aldosteronism compared with essential hypertension: a systematic review and meta-analysis. The Lancet Diabetes & Endocrinology. 2018;6(1):41–50.
[56] Rossi GP, Maiolino G, Flego A, et al. Adrenalectomy Lowers Incident Atrial Fibrillation in Primary Aldosteronism Patients at Long Term. Hypertension. 2018;71(4):585–591.
[57] Neefs J, Berg NWE van den, Limpens J, et al. Aldosterone Pathway Blockade to Prevent Atrial Fibrillation: A Systematic Review and Meta-Analysis. International Journal of Cardiology. 2017;231:155–161.
[58] Liu T, Korantzopoulos P, Shao Q, et al. Mineralocorticoid receptor antagonists and atrial fibrillation: a meta-analysis. Europace. 2016;18(5):672–678.
[59] Van Gelder IC, Rienstra M, Bunting KV, et al. 2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): Developed by the task force for the management of atrial fibrillation of the European Society of Cardiology (ESC), with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Endorsed by the European Stroke Organisation (ESO). Eur Heart J. 2024;45(36):3314–3414.
[60] Filippatos G, Bakris GL, Pitt B, et al. Finerenone Reduces New-Onset Atrial Fibrillation in Patients With Chronic Kidney Disease and Type 2 Diabetes. J Am Coll Cardiol. 2021;78(2):142–152.
[61] Maron BA, Oldham WM, Chan SY, et al. Upregulation of Steroidogenic Acute Regulatory Protein by Hypoxia Stimulates Aldosterone Synthesis in Pulmonary Artery Endothelial Cells to Promote Pulmonary Vascular Fibrosis. Circulation. 2014;130(2):168–179.
[62] Maron BA, Zhang Y-Y, White K, et al. Aldosterone Inactivates the Endothelin-B Receptor via a Cysteinyl Thiol Redox Switch to Decrease Pulmonary Endothelial Nitric Oxide Levels and Modulate Pulmonary Arterial Hypertension. Circulation. 2012;126(8):963–974.
[63] Samokhin AO, Stephens T, Wertheim BM, et al. NEDD9 targets COL3A1 to promote endothelial fibrosis and pulmonary arterial hypertension. Science Translational Medicine. 2018;10(445):eaap7294.
[64] Lu M, Chen L-Y, Gairhe S, et al. Mineralocorticoid receptor antagonist treatment of established pulmonary arterial hypertension improves interventricular dependence in the SU5416-hypoxia rat model. American Journal of Physiology-Lung Cellular and Molecular Physiology. 2022;322(3):L315–L332.
[65] Maron BA, Waxman AB, Opotowsky AR, et al. Effectiveness of Spironolactone Plus Ambrisentan for Treatment of Pulmonary Arterial Hypertension (from the [ARIES] Study 1 and 2 Trials). American Journal of Cardiology. 2013;112(5):720–725.
[66] Humbert M, Kovacs G, Hoeper MM, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: Developed by the task force for the diagnosis and treatment of pulmonary hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS). Endorsed by the International Society for Heart and Lung Transplantation (ISHLT) and the European Reference Network on rare respiratory diseases (ERN-LUNG). Eur Heart J. 2022;43(38):3618–3731.







