Ths. BS. LÊ THỊ LAN HƯƠNG
PGS. TS. BS. PHẠM NGUYỄN VINH
Bệnh viện đa khoa Tâm Anh TP. HCM
TÓM TẮT
Tổng quan: Nhờ những tiến bộ vượt bậc trong chẩn đoán và phẫu thuật, hiện nay hơn 90% bệnh nhân tim bẩm sinh có thể sống đến tuổi trưởng thành, trong đó tứ chứng Fallot (TOF) là dạng bệnh lý thường gặp nhất. Tuy nhiên, các biến chứng muộn như hở van động mạch phổi (PR) kéo dài, gây giãn thất phải, rối loạn chức năng hai thất và rối loạn nhịp vẫn phổ biến, ảnh hưởng trực tiếp đến tiên lượng lâu dài và chất lượng sống.
Mục tiêu: Nhấn mạnh vai trò cộng hưởng từ tim mạch (CMR) trong quá trình theo dõi và đưa ra quyết định thay van động mạch phổi (PVR) cho bệnh nhân TOF đã được sửa chữa hoàn toàn , đồng thời phân tích các quan điểm xoay quanh giá trị ngưỡng (cut-off) và ứng dụng trong thực hành hiện nay.
Nội dung: CMR được các hướng dẫn của AHA và ESC công nhận là tiêu chuẩn vàng để đánh giá toàn diện bệnh nhân TOF đã phẫu thuật. Các thông số định lượng như thể tích thất phải cuối tâm trương (RVEDVi), thể tích thất phải cuối tâm thu (RVESVi), mức độ hở van động mạch phổi (PR) và phân suất tống máu hai thất (RVEF, LVEF) đều là cơ sở quan trọng để xác định thời điểm chỉ định PVR. Theo khuyến cáo, các giá trị ngưỡng như RVEDVi ≥ 160 ml/m², RVESVi ≥ 80 ml/m², hoặc RVEF giảm được sử dụng rộng rđể quyết định sửa chữa nhằm ngăn ngừa suy thất không hồi phục. Ngoài ra, CMR còn cho phép đánh giá chi tiết tình trạng xơ hóa cơ tim thông qua kỹ thuật tăng tín hiệu muộn (LGE) và T1 mapping, cung cấp thông tin giá trị về nguy cơ loạn nhịp và tiên lượng sống còn — những yếu tố mà các phương tiện chẩn đoán khác không thể thay thế.Tuy nhiên, việc áp dụng các điểm cắt này vẫn còn nhiều tranh cãi, do khác biệt giữa các nghiên cứu, đặc điểm quần thể bệnh nhân và khả năng hồi phục thất phải sau phẫu thuật chịu ảnh hưởng bởi nhiều yếu tố. Do đó, cần phối hợp chặt chẽ dữ liệu CMR với triệu chứng lâm sàng, tiến triển chức năng thất và đặc điểm mô học để đưa ra quyết định PVR phù hợp, cá thể hóa theo từng bệnh nhân.
Kết luận: CMR giữ vai trò then chốt trong đánh giá toàn diện bệnh nhân TOF đã được sửa chữa, không chỉ dừng lại ở thông số thể tích và chức năng thất mà còn cung cấp thông tin chuyên sâu về huyết động và xơ hóa cơ tim. Việc áp dụng chính xác các điểm cắt theo khuyến cáo và tích hợp lâm sàng sẽ hỗ trợ bác sĩ quyết định thời điểm PVR tối ưu, hạn chế biến chứng và nâng cao chất lượng sống cho bệnh nhân tim bẩm sinh trưởng thành.
Từ khóa: Tứ chứng Fallot, Cộng hưởng từ tim, Sửa chữa van động mạch phổi
1. TỔNG QUAN
Tứ chứng Fallot (TOF) là một dị tật tim bẩm sinh phức tạp, được mô tả lần đầu tiên bởi bác sĩ Étienne-Louis Arthur Fallot vào cuối thế kỷ 191. TOF được xếp vào nhóm bệnh tim bẩm sinh tím, chiếm khoảng 5–10% tổng số các ca tim bẩm sinh, trở thành dạng bệnh lý tím phổ biến nhất2. Về đặc điểm giải phẫu, TOF bao gồm bốn bất thường cấu trúc chính: (1) thông liên thất rộng , (2) hẹp đường ra thất phải : thường gặp nhất dưới dạng hẹp van hoặc dưới van động mạch phổi, (3) phì đại thất phải thứ phát do tăng áp lực, và (4) động mạch chủ cưỡi ngựa – tức là gốc động mạch chủ dịch chuyển sang bên phải, nằm trên vách liên thất và nhận máu từ cả hai thất3. TOF thường được phát hiện sớm từ giai đoạn sơ sinh, trẻ thường có biểu hiện tím tái mức độ từ nhẹ đến nặng, tùy thuộc vào mức độ hẹp đường ra thất phải. Những đợt tím tái đột ngột có thể xảy ra do tăng kháng lực đường ra thất phải hoặc co thắt cơ thất. Tình trạng tím kéo dài có thể dẫn đến đa hồng cầu, tăng nguy cơ tắc mạch và giảm khả năng gắng sức4.
Điều trị tứ chứng Fallot (TOF) đã có nhiều bước tiến đáng kể kể từ khi Blalock và Taussig mô tả phẫu thuật tạo cầu nối động mạch hệ thống – động mạch phổi đầu tiên vào năm 1945, và sau đó Lillehei cùng Varco thực hiện ca sửa chữa hoàn toàn bằng phẫu thuật tim hở đầu tiên vào năm 19545, nhưng phẫu thuật sửa chữa tối ưu vẫn còn nhiều thách thức. Tỷ lệ tử vong phẫu thuật sớm đã giảm từ 50% vào cuối thập niên 1950 xuống dưới 2% trong kỷ nguyên phẫu thuật hiện đại6, tuy nhiên các bất thường tồn lưu về giải phẫu và huyết động gần như vẫn tồn tại ở hầu hết bệnh nhân7. Tình trạng hở van động mạch phổi mạn tính nặng sau phẫu thuật sửa chữa hoàn toàn – được coi là nguyên nhân quan trọng và có thể điều trị được của giãn và suy thất phải – đã trở thành trọng tâm của nhiều nghiên cứu trong hơn 1 thập kỷ nay8. Hiện nay vẫn còn nhiều tranh luận xoay quanh thời điểm can thiệp lại tối ưu, trong đó vai trò của các phương tiện chẩn đoán hình ảnh hiện có như siêu âm tim, chụp cắt lớp vi tính (CT) và cộng hưởng từ tim mạch (CMR) ngày càng được quan tâm. Trong số đó, CMR được đánh giá là công cụ toàn diện nhất nhờ những tiến bộ vượt bậc, không chỉ hỗ trợ quyết định thời điểm can thiệp thay van động mạch phổi mà còn cho phép đánh giá toàn diện hình thái, thể tích, chức năng thất phải cũng như cung cấp các thông tin tiên lượng quan trọng nhờ chuỗi xung và kỹ thuật hiện đại8.
2. SINH LÝ BỆNH CỦA HỞ VAN ĐỘNG MẠCH PHỔI SAU PHẪU THUẬT SỬA CHỮA TOF9
Phẫu thuật sửa chữa hẹp buồng tống thất phải trong tứ chứng Fallot làm mất tính toàn vẹn của van động mạch phổi, dẫn đến tình trạng hở van động mạch phổi ở đa số bệnh nhân. Các bằng chứng thực nghiệm và dữ liệu lâm sàng đều cho thấy mức độ hở van động mạch phổi (PR) sẽ tiến triển tăng dần theo thời gian. Không giống hở van động mạch chủ, chênh áp thì tâm trương giữa động mạch phổi và thất phải thường nhỏ nên thể tích dòng trào ngược của hở phổi phụ thuộc nhiều yếu tố. Các yếu tố ảnh hưởng lên tình trạng hở van động mạch phổi bao gồm: (1) diện tích lỗ hở gây trào ngược; (2) độ giãn nở (compliance) thất phải; (3) chênh áp thì tâm trương giữa động mạch phổi (MPA) và thất phải; (4) sức chứa (capacitance) của động mạch phổi; và (5) thời gian thì tâm trương. Ngoài ra, sức cản động mạch phổi và chức năng thất trái cũng có thể ảnh hưởng đến hở van động mạch phổi.
Tại thời điểm ngay sau phẫu thuật sửa chữa TOF, thất phải thường bị phì đại nên độ giãn nở thấp; đường kính các động mạch phổi thường kém phát triển hoặc giá trị ở ngưỡng thấp, do đó khả năng chứa cũng thấp; và tần số tim còn cao, làm cho thời gian thì tâm trương ngắn. Vì vậy, mặc dù diện tích lỗ hở van động mạch phổi tương đối lớn ngay sau phẫu thuật, nhưng sự kết hợp của các yếu tố trên làm giảm thiểu tác động lên mức độ hở phổi. Theo thời gian, thể tích nhát bóp thất phải tăng dần, làm gia tăng kích thước và sức chứa của động mạch phổi và các nhánh, gây giãn thất phải. Kết hợp với thời gian thì tâm trương kéo dài ra khi nhịp tim giảm dần theo tuổi, những thay đổi này dẫn đến dẫn đến tiến triển mức độ hở van động mạch phổi ( Sơ đồ 1)
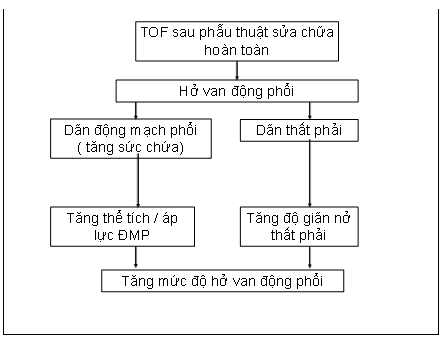
Sơ đồ 1: Yếu tố ảnh hưởng đến tiến triển hở van động mạch phổi sau sửa TOF
♦ Tác động của quá tải tải thể tích mạn tính lên hoạt động của thất9
Các nghiên cứu cho thấy thất phải và thất trái có đáp ứng sinh lý bệnh tương tự khi bị quá tải thể tích mạn tính nặng. Đáp ứng này có thể chia thành bốn giai đoạn:
1) Giai đoạn bù trừ: đặc trưng bởi sự gia tăng thể tích cuối tâm trương và kết hợp phì đại thất. Giai đoạn này có thể kéo dài nhiều năm, thậm chí hàng thập kỷ.
2) Giai đoạn suy giảm cơ chế bù trừ: đặc trưng bởi sự giãn các buồng thất, nhưng tỷ lệ khối lượng/thể tích giảm xuống (phì đại không đủ) và hậu tải tăng (tăng gánh cuối tâm thu). Điều này làm tốc độ và biên độ rút ngắn sợi cơ giảm dần. Giai đoạn này biểu hiện bằng sự suy giảm chức năng tâm thu toàn cục trong khi khả năng co bóp cơ tim nội tại vẫn còn tương đối bình thường
3) Giai đoạn giảm co bóp cơ tim giảm nhưng còn hồi phục: giai đoạn này diễn ra trong thời gian ngắn, khả năng co bóp cơ tim suy giảm này vẫn có thể hồi phục. Do đó việc can thiệp/ điều trị tình trạng quá tải thể tích có thể giúp khôi phục chức năng bơm máu của tim.
4) Giai đoạn tổn thương cơ tim không hồi phục, đi kèm với xơ hóa và tăng collagen gian bào
Mặc dù tương đồng về cơ chế với thất trái, thất phải vẫn có những điểm khác biệt quan trọng: hình dạng buồng phức tạp, cấu trúc cơ tim với lớp cơ chắc mỏng kết hợp bè cơ dày, sợi cơ sắp xếp chủ yếu theo hướng ngang với kiểu co bóp từ đáy đến đỉnh (ít xoắn hơn LV). Thất phải chỉ được cấp máu bởi một nhánh động mạch vành chính với gần 50% lưu lượng máu trong thì tâm trương (trong khi thất trái là ~90%). Hệ dẫn truyền thất phải gồm một bó sợi dài, tạo ra sự chậm kích hoạt từ đáy đến thành tự do vùng phễu xa, hình thành chuyển động co bóp kiểu nhu động10.
Sau phẫu thuật sửa chữa TOF, các can thiệp như rạch thành tự do phễu, cắt bỏ bó cơ gây tắc nghẽn, cắt bỏ toàn phần hoặc một phần van phổi, đặt miếng vá đường ra, hoặc thêm ống nối RV–PA đều góp phần làm thay đổi sinh lý thất phải. Các thủ thuật này, cộng với việc đóng VSD bằng miếng vá, có thể ảnh hưởng đến chức năng van ba lá và thường gây hở PR tồn tại, vô động hoặc loạn động vùng RVOT, phình miếng vá, xơ hóa thành tự do và dẫn truyền chậm11. Do đó, hở van động mạch phổi mạn tính và suy thất phải gần như là diễn tiến tự nhiên sau phẫu thuật, đòi hỏi lựa chọn thời điểm PVR phù hợp để ngăn suy giảm không hồi phục.
3. TIẾN BỘ CỦA CÁC KHUYẾN CÁO – TỪ NỀN TẢNG GIAI ĐOẠN ĐẦU ĐẾN CẬP NHẬT HIỆN NAY
3.1. Hướng dẫn các khuyến cáo ở giai đoạn đầu
Các khuyến cáo giai đoạn đầu đã đặt nền móng quan trọng cho việc chuẩn hóa tiêu chí chỉ định PVR.
Năm 2008, hướng dẫn của Hội tim mạch Hoa Kỳ là một trong những hướng dẫn sớm nhất khẳng định PVR nên được thực hiện ở bệnh nhân TOF đã phẫu thuật nếu bệnh nhân có hở van động mạch phổi mức độ nặng có triệu chứng hoặc giảm khả năng gắng sức rõ rệt với mức khuyến cáo Class I. Ngoài ra, PVR được coi là khuyến cáo lý ở bệnh nhân hở phổi nặng kèm ít nhất 1 yếu tố: rối loạn chức năng thất phải vừa–nặng, giãn thất phải đáng kể, xuất hiện loạn nhịp thất/nhĩ có triệu chứng hoặc dai dẳng, hoặc kèm hở van ba lá mức vừa–nặng (Class IIa, mức chứng cứ C)12.
Năm 2009 Hội tim mạch Canada (CCS) tiếp tục bổ sung nhóm bệnh nhân có hở phổi tự do (free) kèm giãn thất phải tiến triển trên 170 ml/m², rối loạn chức năng thất phải vừa–nặng, hở van ba lá nặng, hoặc loạn nhịp thất – đều là tiêu chí cần can thiệp với mức độ khuyến cáo Class IIa, mức chứng cứ C13.
Sau đó, năm 2010, Hội tim mạch Châu Âu (ESC) nhấn mạnh tính “chủ động” hơn. Thay van động mạch phổi (PVR) chỉ định ở bệnh nhân có PR nặng có triệu chứng và/hoặc hẹp đường ra thất phải với áp lực tâm thu thất phải >60 mmHg hoặc vận tốc dòng hở van ba lá >3,5 m/s với mức khuyến cáo I, mức chứng cứ C. Đồng thời hướng dẫn của ESC cũng khuyến cáo thay van động mạch phổi (PVR) ngay cả ở bệnh nhân không triệu chứng, nếu hở van động mạch phổi mức độ nặng kèm ít nhất một tiêu chí: giảm khả năng gắng sức, giãn thất phải tiến triển, rối loạn chức năng tâm thu thất phải, hở van bá lá tiến triển, hoặc tắc nghẽn RVOT với áp lực thất phải > 80 mmHg, loạn nhịp nhĩ/thất kéo dài với mức độ khuyến cáo Class IIa, mức chứng cứ C14.
Theo hướng dẫn của Hiệp hội Cộng hưởng từ Tim (SCMR)9 năm 2011 nhấn mạnh ngưỡng lượng giá chi tiết bằng cộng hưởng từ tim (CMR) để xét chỉ định thay van động mạch phổi (PVR) ở bệnh nhân tứ chứng Fallot sau phẫu thuật sửa chữa. Cụ thể, hở van động mạch phổi mức độ trung bình hoặc nặng, với phân suất hồi lưu (RF) từ 25% trở lên trên CMR, được xem là tiêu chuẩn nền tảng để cân nhắc can thiệp. Đối với bệnh nhân có triệu chứng, chỉ định PVR nên được cân nhắc khi hội tụ ít nhất hai yếu tố gồm: khả năng gắng sức giảm không giải thích được do nguyên nhân ngoài tim được khẳng định qua nghiệm pháp gắng sức tim phổi (VO₂ đỉnh < 70% so với dự đoán); xuất hiện các dấu hiệu và triệu chứng của suy tim; hoặc ngất liên quan đến loạn nhịp. Ngược lại, đối với nhóm không triệu chứng, chỉ định PVR khi có ít nhất hai tiêu chí sau: RVEDVi > 150 ml/m² hoặc z-score >4 hay tỷ lệ RV:LV ≥ 2; RVESVi > 80 ml/m²; phân suất tống máu thất phải (RVEF) < 47% hoặc phân suất tống máu thất trái (LVEF) < 55%; phình lớn đường ra thất phải (RVOT aneurysm); thời gian phức bộ QRS kéo dài> 140 msec; loạn nhịp nhanh kéo dài liên quan đến quá tải thể tích thất phải; hoặc các bất thường huyết động có ý nghĩa khác như tắc nghẽn đường ra thất phải với áp lực thất phải > 2/3 áp lực hệ thống, hẹp nặng nhánh động mạch phổi, hở van ba lá mức vừa-nặng, tồn lưu thông liên thất hoặc liên nhĩ với Qp:Qs > 1.5:1, hoặc kèm theo hở van động mạch chủ nặng, giãn gốc động mạch chủ. Ngoài ra, khuyến cáo SCMR 2011 cũng nhấn mạnh rằng ngoài RF ≥ 25%, chỉ số RVESVi cần được đánh giá đồng thời bên cạnh RVEDVi vì phản ánh sát hơn mức độ co bóp còn bù của thất phải, đồng thời cần phối hợp với chỉ số chức năng thất phải và thất trái để xác định ngưỡng phục hồi tối ưu khi can thiệp. Việc áp dụng đầy đủ các tiêu chuẩn cộng hưởng từ này đã tạo ra cơ sở khách quan hơn trong lâm sàng, giúp xác định “cửa sổ vàng” để chỉ định PVR, tránh tình trạng can thiệp quá muộn dẫn đến rối loạn chức năng thất phải không hồi phục.
3.2. Các khuyến cáo hiện hành
Theo các hướng dẫn cập nhật hiện nay của Hội tim mạch Hoa kỳ năm 2018, Hội tim mạch Châu Âu năm 2021 và Hội tim mạch Canada năm 2022, chỉ định thay van động mạch phổi (PVR) ở bệnh nhân tứ chứng Fallot sau phẫu thuật sửa chữa tiếp tục được cụ thể hóa hơn dựa trên các ngưỡng định lượng rõ ràng, phối hợp nhiều tiêu chí để tối ưu hóa thời điểm can thiệp.
Theo khuyến cáo Hội tim mạch Hoa kỳ năm 201815, việc thay van phổi nên được cân nhắc với mức độ khuyến cáo Class IIa khi bệnh nhân có hai tiêu chuẩn sau: rối loạn chức năng thất phải hoặc thất trái mức độ nhẹ đến vừa; giãn thất phải nặng với RVEDVi ≥ 160 ml/m², hoặc RVESVi ≥ 80 ml/m², hoặc thể tích cuối tâm trương RV gấp đôi thể tích LV; tắc nghẽn đường ra thất phải với áp lực thất phải vượt quá 2/3 áp lực hệ thống; hoặc giảm khả năng gắng sức tiến triển.
Tương tự, khuyến cáo của Hội tim mạch Châu Âu năm 202016 nhấn mạnh PVR nên được thực hiện khi có hở van phổi nặng (30–40% trên CMR) và/hoặc tắc nghẽn RVOT, kèm ít nhất một tiêu chẩn sau: khả năng gắng sức giảm; giãn thất phải tiến triển với RVEDVi ≥160 ml/m² và/hoặc RVESVi ≥80 ml/m² và/hoặc hở van ba lá tiến triển mức độ trung bình; rối loạn chức năng tâm thu thất phải tiến triển; hoặc tắc nghẽn RVOT với áp lực thất phải > 80 mmHg.
Năm 2022, Hội tim mạch Canada17 đưa ra khuyến cáo tương tự, nhấn mạnh hở van phổi đáng kể (PR mức độ nặng trên siêu âm hoặc RF ≥ 25% trên CMR), kèm ít nhất một trong ba yếu tố: giãn thất phải kèm hoặc không kèm rối loạn chức năng thất phải, tắc nghẽn RVOT có ý nghĩa (RVp > 2/3 áp lực hệ thống), hoặc khả năng gắng sức giảm. Các hướng dẫn đồng thuận cũng thống nhất rằng, chỉ số kích thước RV (RVEDVi ≥ 160 ml/m² hoặc RVESVi ≥ 80 ml/m²) giữ vai trò then chốt để dự đoán “ngưỡng không hồi phục” của thất phải. Đồng thời, quy trình ra quyết định can thiệp cũng nên dựa trên sự kết hợp đa yếu tố, bao gồm hình ảnh học, nghiệm pháp gắng sức khách quan và sự xuất hiện của loạn nhịp dai dẳng.
Tất cả khuyến cáo hiện nay này cho thấy xu hướng ngày càng dịch chuyển từ việc chỉ dựa vào triệu chứng lâm sàng sang cách tiếp cận cá thể hóa, chủ động can thiệp kịp thời trước khi thất phải vượt qua ngưỡng mất khả năng phục hồi hình thái và chức năng.
3.3 Phân tích điểm chính trong quyết định thay van động mạch phổi
Phân tích các khuyến cáo hiện hành cho thấy có bốn yếu tố then chốt luôn được coi là trụ cột quyết định chỉ định thay van động mạch phổi. Trước hết là mức độ hở van động mạch phổi, đặc biệt khi hở phổi mức độ trung bình đến nặng với phân suất phụt ngược (regurgitant fraction) > 25% trên CMR, gần như là điều kiện tiên quyết để cân nhắc PVR. Bên cạnh đó, thể tích và kích thước thất phải đóng vai trò quan trọng, với các chỉ số thể tích cuối tâm trương (RVEDVi) và cuối tâm thu (RVESVi) được coi là các thông số khách quan, dễ theo dõi và đã được nhiều nghiên cứu xác thực. Các ngưỡng cụ thể, thường được viện dẫn, là RVEDVi từ 150–160 ml/m² hoặc RVESVi ≥ 80 ml/m² — mốc này được xem là “ngưỡng không hồi phục”, khi thất phải đã giãn quá mức, làm giảm khả năng phục hồi chức năng ngay cả sau can thiệp. Yếu tố thứ ba là chức năng co bóp thất phải: khi RVEF giảm, khả năng hồi phục sau PVR sẽ kém đi, do đó chỉ định PVR sớm ở giai đoạn thất phải còn bù được coi là tối ưu. Cuối cùng, các yếu tố lâm sàng như loạn nhịp thất, phức bộ QRS kéo dài, hoặc khả năng gắng sức giảm đều là dấu hiệu cảnh báo thất phải đã bị quá tải huyết động kéo dài và cần được xem như “điểm báo động” thúc đẩy quyết định can thiệp. Mặc dù các tiêu chí này đã được đồng thuận và chuẩn hóa hơn, trong thực tế lâm sàng, quyết định thay van động mạch phổi vẫn còn nhiều tranh cãi. Thực tế cho thấy không ít trung tâm vẫn có xu hướng trì hoãn PVR, chờ đợi bệnh nhân có triệu chứng rõ rệt thay vì chủ động can thiệp sớm để bảo tồn chức năng thất phải. Thêm vào đó, sự khác biệt về kỹ thuật phẫu thuật ban đầu, chẳng hạn như sử dụng miếng vá đường ra thất phải (TAP) hay kỹ thuật bảo tồn van, cũng làm biến thiên kích thước RV, mức độ PR và hình thái phình đường ra thất phải (RVOT), từ đó gây khó khăn cho việc chuẩn hóa tiêu chí và lựa chọn thời điểm tối ưu. Bên cạnh đó, các hướng dẫn mới nhất về bệnh tim bẩm sinh ở người trưởng thành của Hội Tim mạch Hoa Kỳ sắp công bố được kỳ vọng sẽ tiếp tục tinh chỉnh chỉ định, hướng đến phân tầng nguy cơ chi tiết hơn, kết hợp CMR, ECG, CPET và cả chỉ dấu sinh học, nhằm hỗ trợ lựa chọn đúng “thời điểm vàng” để thay van động mạch phổi hiệu quả nhất.
4. Kết luận
Tứ chứng Fallot (TOF) là bệnh tim bẩm sinh phức tạp, dù phẫu thuật đã cải thiện tiên lượng, nhưng hở van động mạch phổi mạn tính và giãn suy thất phải vẫn là vấn đề tồn lưu cần được can thiệp đúng lúc. Các khuyến cáo hiện nay thống nhất bốn tiêu chí chính để chỉ định thay van động mạch phổi (PVR): (1) hở van phổi mức độ trung bình–nặng (RF ≥ 25% CMR); (2) thể tích thất phải giãn (RVEDVi ≥ 150–160 ml/m², RVESVi ≥ 80 ml/m²); (3) chức năng co bóp thất phải giảm; và (4) có cácdấu hiệu lâm sàng như: rối loạn nhịp, phức bộ QRS kéo dài, giảm khả năng gắng sức. Xu hướng mới nhấn mạnh can thiệp sớm, cá thể hóa, dựa trên các chỉ số định lượng rõ ràng thay vì chỉ chờ triệu chứng muộn ,tránh để thất phải mất khả năng phục hồi. Các khuyến cáo mới sắp ban hành kỳ vọng sẽ tiếp tục hoàn thiện tiêu chí chỉ định, kết hợp chặt chẽ hình ảnh học hiện đại và phân tầng nguy cơ, nhằm tối ưu hóa thời điểm can thiệp, bảo tồn chức năng thất phải lâu dài và nâng cao chất lượng sống cho bệnh nhân TOF đã được sửa chữa.
TÀI LIỆU THAM KHẢO
- Loukas M, Cesmebasi A, Le D, Etienne D, Tubbs RS, Anderson RH. E tienne‐A rthur L ouis F allot and his tetralogy. Clinical Anatomy. 2014;27(7):958-963.
- Apitz C, Webb GD, Redington AN. Tetralogy of fallot. The Lancet. 2009;374(9699):1462-1471.
- Ordovas KG, Muzzarelli S, Hope MD, et al. Cardiovascular MR imaging after surgical correction of tetralogy of Fallot: approach based on understanding of surgical procedures. J Radiographics. 2013;33(4):1037-1052.
- Bhagra CJ, Hickey EJ, Van De Bruaene A, Roche SL, Horlick EM, Wald RM. Pulmonary valve procedures late after repair of tetralogy of Fallot: current perspectives and contemporary approaches to management. J Canadian Journal of Cardiology. 2017;33(9):1138-1149.
- Blalock A, Taussig HB. The surgical treatment of malformations of the heart: in which there is pulmonary stenosis or pulmonary atresia. Journal of the American Medical Association. 1945;128(3):189-202.
- Parry AJ, McElhinney DB, Kung GC, Reddy VM, Brook MM, Hanley FL. Elective primary repair of acyanotic tetralogy of Fallot in early infancy: overall outcome and impact on the pulmonary valve. Journal of the American College of Cardiology. 2000;36(7):2279-2283.
- Nollert G, Fischlein T, Bouterwek S, Böhmer C, Klinner W, Reichart B. Long-term survival in patients with repair of tetralogy of Fallot: 36-year follow-up of 490 survivors of the first year after surgical repair. Journal of the American College of Cardiology. 1997;30(5):1374-1383.
- Nyström A, Berntsson C, Mandalenakis Z, Lagerstrand K, Dangardt F, de Lange C. Cardiovascular magnetic resonance in Tetralogy of Fallot—state of the art. J Cardiovascular Diagnosis Therapy. 2025;15(1):173.
- Geva T. Repaired tetralogy of Fallot: the roles of cardiovascular magnetic resonance in evaluating pathophysiology and for pulmonary valve replacement decision support. Journal of Cardiovascular Magnetic Resonance. 2011;13(1):9.
- Dell’Italia LJ. The right ventricle: anatomy, physiology, and clinical importance. Current problems in cardiology. 1991;16(10):658-720.
- Wald RM, Haber I, Wald R, Valente AM, Powell AJ, Geva T. Effects of regional dysfunction and late gadolinium enhancement on global right ventricular function and exercise capacity in patients with repaired tetralogy of Fallot. Circulation. 2009;119(10):1370-1377.
- Warnes CA, Williams RG, Bashore TM, et al. ACC/AHA 2008 guidelines for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association task force on practice guidelines (writing committee to develop guidelines on the management of adults with congenital heart disease): developed in collaboration with the american society of echocardiography, heart rhythm society, international society for adult congenital heart disease, society for cardiovascular angiography and interventions, and society of thoracic surgeons. Circulation. 2008;118(23):e714-e833.
- Silversides CK, Marelli A, Beauchesne L, et al. Canadian Cardiovascular Society 2009 Consensus Conference on the management of adults with congenital heart disease: executive summary. Canadian Journal of Cardiology. 2010;26(3):143-150.
- Cardiology EbtAfEP, Members ATF, Baumgartner H, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010) The Task Force on the Management of Grown-up Congenital Heart Disease of the European Society of Cardiology (ESC). European heart journal. 2010;31(23):2915-2957.
- Stout KK, Daniels CJ, Aboulhosn JA, et al. 2018 AHA/ACC guideline for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Journal of the American College of Cardiology. 2019;73(12):e81-e192.
- Baumgartner H, De Backer J, Babu-Narayan SV, et al. 2020 ESC Guidelines for the management of adult congenital heart disease: The Task Force for the management of adult congenital heart disease of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Adult Congenital Heart Disease (ISACHD). European heart journal. 2021;42(6):563-645.
- Marelli A, Beauchesne L, Colman J, et al. Canadian Cardiovascular Society 2022 guidelines for cardiovascular interventions in adults with congenital heart disease. Canadian Journal of Cardiology. 2022;38(7):862-896.







