BS. NGUYỄN THANH HIỀN
BS. NGUYỄN TRẦN THU THỦY
1. GIỚI THIỆU
Sung huyết trong suy tim (ST) theo truyền thống được coi là một khái niệm huyết động, được định nghĩa là tăng áp lực đổ đầy trung tâm thường dẫn đến hoặc là hậu quả của sự tích tụ dịch trong các khoang nội mạch và ngoại vi. Tuy nhiên, sung huyết không đồng nghĩa với với tình trạng quá tải dịch, vì áp lực trong tim tăng không phải lúc nào cũng liên quan đến việc tăng thể tích máu toàn phần và ngược lại (1,2,3).
Sự sung huyết và tích tụ dịch trong suy tim là do các cơ chế khác nhau và sự tương tác phức tạp. Rối loạn chức năng tim dẫn đến tăng áp lực ngược dòng và tái phân phối thể tích. Ngoài ra, nó dẫn đến kích hoạt tế bào thần kinh để duy trì thể tích tuần hoàn hiệu quả và áp lực tưới máu cơ quan. Những phản ứng sinh học này gây ra ái lực natri và nước trong thận, làm trầm trọng thêm và kéo dài tình trạng quá tải dịch. Mặc dù sự tăng thể tích máu toàn phần về cơ bản được coi là một tình trạng đồng nhất, đơn giản và thụ động, nhưng bằng chứng hiện tại ủng hộ vai trò của tích tụ dịch như một quá trình phức tạp, không đồng nhất và biến động làm thay đổi diễn biến tự nhiên của hội chứng ST (4).
2. CÁC LOẠI HÌNH SUNG HUYẾT
Sự tương tác phức tạp, không đồng nhất và biến động giữa khoang kẽ và khoang dịch nội mạch là một trong những lý do chính giải thích sự khác biệt lớn trong phân bố thể tích và mức độ nghiêm trọng của sung huyết/tích tụ dịch ở bệnh nhân suy tim.
2.1 Sung huyết nội mạch
Tăng áp lực đổ đầy trung tâm là một đặc điểm quan trọng của hầu hết các trường hợp suy tim mất bù. Mặc dù sự tăng áp lực đổ đầy này được coi là hậu quả của việc tăng thể tích máu toàn phần và tim suy không có khả năng cung cấp và phân phối thể tích máu trung tâm, những thay đổi trong hệ thống và chức năng điện dung tĩnh mạch phổi cũng đóng một vai trò quan trọng và không được đánh giá cao trong việc điều hòa huyết động trung tâm (1).
Hệ thống tĩnh mạch có thể lưu trữ một lượng lớn dịch (khoảng 70% tổng lượng máu), chủ yếu phân bố ở các mạch máu nội tạng có điện trở thấp và điện dung cao (lưu trữ tới 20% -30% tổng lượng thể tích máu không bị “căng thẳng”). Tuy nhiên, hệ thống ”ổ chứa tĩnh mạch” này chứa một lượng lớn thụ thể adrenergic a1 và a2, khiến chúng rất nhạy cảm với sự kích thích của hệ thần kinh giao cảm. Do đó, khả năng lưu trữ bị suy giảm hoặc trương lực giao cảm tăng lên có thể dẫn đến sự thay đổi thể tích gần như tức thời từ các mạch máu nội tạng đến tuần hoàn trung tâm, dẫn đến tăng tiền tải mà không có bất kỳ thay đổi nào về tổng thể tích máu. Một số nghiên cứu đã phát hiện ra mối tương quan yếu giữa áp lực trong tim và việc đo trực tiếp thể tích máu tuần hoàn hoặc sự thay đổi cân nặng, điều này rõ ràng đi ngược lại quan điểm cho rằng việc giữ natri và nước là nguyên nhân duy nhất làm tăng áp suất đổ đầy (5-8).
2.2 Sung huyết mô / quá tải dịch
Sự giữ nước dẫn đến sự gia tăng dần dần và bền vững áp lực thủy tĩnh trong khoang mạch máu. Cùng với các yếu tố khác như tính thấm của mạch máu và lực Starling giữa huyết tương và mô kẽ, một phần của tình trạng quá tải dịch được chuyển về phía khoang kẽ do quá trình thẩm thấu mao mạch. Do chức năng bạch huyết tăng lên rõ rệt, dịch kẽ ban đầu được dẫn lưu một cách hiệu quả, không có sự tích tụ dịch. Tuy nhiên, khi dòng bạch huyết đạt đến trạng thái ổn định, tốc độ thẩm thấu từ mao mạch vào khoang kẽ vượt quá khả năng của bạch huyết và dịch bắt đầu tích tụ trong khoảng kẽ. Có nhiều cơ chế có thể dẫn đến rối loạn điều hòa bạch huyết ở bệnh nhân suy tim. Trong số đó, hệ thống dẫn lưu bạch huyết giảm do áp lực tĩnh mạch trung tâm (ALTMTT) (CVP) tăng cao, tính toàn vẹn và độ đàn hồi của mạch bạch huyết bị suy giảm, rối loạn chức năng van bạch huyết, động lực bạch huyết ở thận bị suy giảm và sự hình thành mạch bạch huyết kém thích nghi góp phần vào sự tích tụ dịch kẽ. Điều quan trọng là, khoang kẽ bao gồm một mạng lưới của glycosaminoglycans (GAG), collagen và sợi đàn hồi cố gắng duy trì cấu trúc kẽ và hoạt động như một chất đệm vì hầu hết các phân tử nước và cation, chẳng hạn như natri trong không gian kẽ, đều liên kết với các GAG này. Tuy nhiên, về lâu dài độ bão hòa của GAG và tính thấm tăng do các tình trạng khác nhau như tiểu đường hoặc viêm sẽ làm thay đổi tính toàn vẹn của mạng lưới này và dẫn đến sung huyết mô (9-11).
3. ĐÁNH GIÁ SUNG HUYẾT NỘI MẠCH
3.1 Đánh giá xâm lấn
Sung huyết hoặc tăng áp lực đổ đầy thất phải và trái là những đặc điểm nổi bật của suy tim mất bù. Đặt ống thông tim phải là phương pháp chính xác nhất để đánh giá mức tăng áp lực đổ đầy tim bằng cách đo trực tiếp áp lực nhĩ phải (RAP) và áp lực nêm động mạch phổi. Áp lực đổ đầy cao dai dẳng thường xảy ra trước khi nhập viện do suy tim, và các thiết bị cảm biến áp suất cấy ghép trong động mạch phổi (theo dõi áp lực động mạch phổi) đã được đề xuất để giảm tỷ lệ nhập viện do suy tim. Mặc dù nó được coi là tiêu chuẩn vàng để chẩn đoán tắc nghẽn nội mạch, việc sử dụng đánh giá xâm lấn thường quy bị hạn chế do tính phức tạp về mặt kỹ thuật, chi phí cao và sự sẵn có của các thiết bị. Hơn nữa, tiện ích lâm sàng của các liệu pháp điều trị bằng áp lực vẫn cần được đánh giá rộng rãi hơn. Ví dụ, trong Nghiên cứu đánh giá về suy tim sung huyết và hiệu quả đặt ống thông động mạch phổi (thử nghiệm ESCAPE), ở bối cảnh cấp tính, việc đặt ống thông động mạch phổi để hướng dẫn điều trị giảm huyết áp không ảnh hưởng đến tỷ lệ tử vong và nhập viện nói chung (12-14).
Tương tự như đo áp lực đổ đầy tim bằng phương pháp xâm lấn, trạng thái và thành phần thể tích máu cũng có thể được định lượng bằng máy phân tích thể tích máu (BVA) đã được phê duyệt lâm sàng (ví dụ như máy BVA100TM, Daxor Corporation, Hoa Kỳ), sử dụng kỹ thuật pha loãng với chất chỉ thị tiêu chuẩn vàng Iodine131 -chất đánh dấu albumin được đánh dấu để cung cấp phép đo định lượng tổng thể tích máu, thể tích huyết tương và thể tích hồng cầu. Dữ liệu sơ bộ cho thấy một điều thú vị là có không có mối liên quan giữa áp lực trong tim và các đo đạc trực tiếp thể tích máu tuần hoàn bằng công nghệ này, điều này nêu bật khái niệm cho rằng sung huyết là sản phẩm của sự tương tác giữa huyết áp và thể tích dịch trong tuần hoàn (3,15).
3.2 Các triệu chứng và dấu hiệu
- Áp lực tĩnh mạch cảnh
Tăng áp lực tĩnh mạch cảnh được coi là một trong những triệu chứng sinh lý có giá trị nhất cho thấy sự tăng áp lực đổ đầy trung tâm. Tuy nhiên, việc ước tính chính xác rất khó và có sự khác biệt đáng kể giữa các quan sát viên. Do đó, độ chính xác được báo cáo để ước tính ALTMTT từ tĩnh mạch cảnh tĩnh mạch dao động từ 43% đến 79% (16).
- Khó thở khi nằm và khó thở khi cúi gập người
Tư thế nằm ngửa làm tăng lưu lượng máu tĩnh mạch từ chi dưới và các tĩnh mạch dự trữ, có thể làm tăng hồi lưu lượng máu tĩnh mạch trở về và tăng áp lực tĩnh mạch và mao mạch phổi, thúc đẩy các triệu chứng khó thở ở tư thế nằm ngửa trở nên trầm trọng hơn. Ngoài ra, tình trạng khó thở trầm trọng hơn khi cúi người về phía trước có liên quan đến tăng áp lực nhĩ phải, áp lực động mạch phổi và các đặc điểm sung huyết nội mạch khác (17).
- Tiếng tim thứ ba
Tiếng tim thứ ba là kết quả của sự đổ đầy tâm thất trái (TTr) (LV) sớm trong tâm trương và sự giảm tốc đột ngột của lưu lượng máu nhĩ thất. Tốc độ dòng truyền vào càng cao và đổ đầy nhanh càng dốc thì tốc độ dòng vào thất trái càng giảm và càng có nhiều khả năng tạo ra âm thanh của tiếng tim thứ ba. Theo đó, tiếng tim thứ ba là đại diện cho đổ đầy tâm trương hạn chế và, làm tăng áp lực đổ đầy thất trái. Nó cho thấy độ đặc hiệu cao nhưng độ nhạy thấp và cũng đòi hỏi chuyên môn lâm sàng (18).
3.3 Đánh giá siêu âm
- Siêu âm tim – Áp lực đổ đầy tim trái
Hiệp hội Siêu âm tim Hoa Kỳ và Hiệp hội Hình ảnh Tim mạch Châu Âu đã phát triển một thuật toán từng bước để ước tính áp lực đổ đầy, đặc biệt là áp lực nhĩ trái. Các thuật toán này tích hợp vận tốc dòng vào của sóng xung hai lá, vận tốc e’ hình khuyên hai lá, tỷ lệ E/e’, tốc độ cực đại của dòng hở van ba lá (TR) và chỉ số thể tích tối đa của tâm nhĩ trái (hình 1). Thuật toán này đã chỉ ra một độ chính xác tổng thể là 87% khi ước tính áp lực thất trái, với lợi ích tăng dần khi kết hợp với đánh giá lâm sàng. Tuy nhiên, mặc dù thuật toán này hoạt động tốt hơn khi ước tính áp lực đổ đầy thất trái ở những người mắc bệnh ST và phân suất tống máu thất trái giảm (HFrEF), nhưng nó vẫn vẫn liên quan đến tiên lượng ở những người có phân suất tống máu thất trái bảo tồn (19,20).
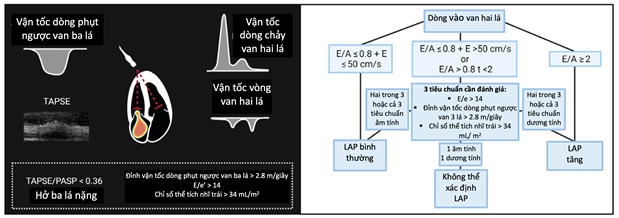
Hình 1. Đánh giá không xâm lấn áp lực đổ đầy tim (19).
Áp lực đổ đầy thất trái tăng cao được định nghĩa là tỷ lệ E/A ³ 2 hoặc nếu E/A < 2 thì ít nhất 2 trong 3 thông số được hiển thị phải cao hơn giá trị ngưỡng. Các chỉ số đại diện cho chức năng thất phải (RV) như lệch tâm thu mặt phẳng hình khuyên ba lá (TAPSE) và tỷ lệ TAPSE/áp lực tâm thu động mạch phổi (PASP), và mức độ nghiêm trọng của hở van ba lá là những dấu hiệu không xâm lấn của tăng áp lực đổ đầy bên phải. E/A – tỷ lệ vận tốc tâm trương sớm hai lá/tâm trương nhĩ; E/e’- vận tốc đầu tâm trương hai lá/tỷ lệ vận tốc e’ đầu tâm trương trung bình; LA, tâm nhĩ trái; LAP, áp lực nhĩ trái; TR, dòng phụt ngược từ van ba lá
- Chỉ số siêu âm tim phản ánh suy tim phải
Các chỉ số đại diện cho suy chức năng tâm thất phải (RV), chẳng hạn như lệch mặt phẳng vòng van bá thì tâm thu (TAPSE) hoặc tỷ lệ TAPSE/áp lực tâm thu động mạch phổi như một dấu hiệu toàn cầu không xâm lấn của sự liên kết động mạch phổi – thất phải, có liên quan chặt chẽ đến tiên lượng. Hở van ba lá là hậu quả cuối cùng của việc tách rời động mạch phổi – thất phải, tăng áp phổi và/hoặc rối loạn chức năng thất phải dẫn đến quá tải dịch, sung huyết hệ thống và suy giảm chức năng thất phải trầm trọng. Có 2 điểm quan trọng liên quan đến các thông số siêu âm tim phải trong suy tim. Đầu tiên, sự tương tác giữa các chỉ số giúp cải thiện việc phân tầng rủi ro. Ở bệnh nhân có hiện diện tách rời thất phải – động mạch phổi và hở van ba lá đáng kể có nguy cơ xảy ra biến cố cao nhất sau giai đoạn suy tim mất bù và có liên quan đến các đặc điểm sung huyết hệ thống nghiêm trọng. Thứ hai, giá trị tiên đoán và tác động lâm sàng của các thông số này dường như cao hơn ở bệnh nhân suy tim với phân suất tống máu thất trái bảo tồn (HFpEF) so với những người mắc suy tim phân suất tống máu giảm (HFrEF). Trong ST phân suất tống máu bảo tồn, rối loạn chức năng tim phải-tăng huyết áp phổi tạo thành một kiểu hình được đặc trưng bởi sung huyết hệ thống nghiêm trọng và tiên lượng đáng lo ngại thường lấn át các đặc điểm rối loạn chức năng tim trái. Ngược lại, trong ST phân suất tống máu giảm, rối loạn chức năng tim phải có thể là biểu hiện của tình trạng suy tim tiến triển (21-23).
- Đánh giá sung huyết ngoài tim bằng siêu âm tại giường
Biểu đồ thể tích áp lực của tĩnh mạch cho thấy độ giãn nở cực kỳ cao ở khoảng áp suất thấp (hình 2). Nói cách khác, các tĩnh mạch không bị căng thẳng (unstressed veins) có thể tiếp nhận lượng máu tương đối lớn với một chút áp lực tích tụ (các bể chứa máu chức năng). Tuy nhiên, việc kéo dài thêm bán kính tĩnh mạch do quá tải thể tích và thay đổi trương lực tĩnh mạch do kích thích cơ trơn (tức là, co mạch qua trung gian thần kinh giao cảm) cuối cùng sẽ đạt đến giới hạn trên của điện dung tĩnh mạch hệ thống (khả năng đệm tối đa), gây ra sự gia tăng nhanh chóng áp lực tĩnh mạch và sức căng của thành (ở những tĩnh mạch bị căng) mà không làm tăng thêm diện tích lòng tĩnh mạch (giãn tối đa) (hình 2). Dù vậy, nghiên cứu các thành phần sinh lý của hệ thống tĩnh mạch ở người là xâm lấn và thách thức về mặt kỹ thuật, điều này làm hạn chế khả năng ứng dụng lâm sàng của nó. Vì vậy, ngày càng có nhiều sự quan tâm trong việc tìm kiếm các phương pháp thay thế không xâm lấn khác để ước tính dung tích tĩnh mạch.
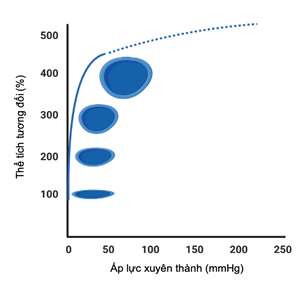
Hình 2. Sự đàn hồi của hệ thống tĩnh mạch.
Ở áp lực xuyên thành thấp, độ giãn nở rõ ràng là cực kỳ cao khi tĩnh mạch trở nên tròn hoàn toàn (đường liên tục). Tuy nhiên, ở áp lực xuyên thành cao không sinh lý, độ đàn hồi khá thấp (đường đứt nét).
Siêu âm tại điểm chăm sóc (POCUS – Point Of Care Ultrasound) gần đây đã nổi lên như một công cụ chẩn đoán đầy hứa hẹn tại giường bệnh để đánh giá tắc nghẽn cơ quan/mạch máu ngoài tim và theo dõi liệu pháp giảm sung huyết. POCUS là một xét nghiệm siêu âm giới hạn, tập trung và theo thời gian thực bao gồm đánh giá tập trung các mạch máu trung tâm (tĩnh mạch chủ dưới [IVC] và tĩnh mạch cảnh), khoang bụng (tĩnh mạch gan, tĩnh mạch cửa và tĩnh mạch thận) và phổi để tìm kiếm những dấu hiệu trên siêu âm có thể giúp các bác sĩ lâm sàng theo dõi gián tiếp lượng máu tĩnh mạch, dung tích tĩnh mạch và sung huyết phổi. Mô tả chi tiết về cách thực hiện POCUS được tóm tắt trong tài liệu bổ sung (24,25,26).
- Các mạch máu trung tâm
- Tĩnh mạch chủ dưới
Tĩnh mạch chủ (TMC) dưới là một mạch máu lớn có độ đàn hồi cao chuyển máu từ các cơ quan bên dưới cơ hoành về tim phải. Về bản chất, TMC dưới là sự tiếp nối về mặt giải phẫu của tâm nhĩ phải (RA). Do đó, khi áp lực nhĩ phải tăng lên, nó được truyền ngược vào TMC dưới, làm thay đổi kích thước và khả năng co lại của tĩnh mạch này.
Mặc dù một số nghiên cứu đã chỉ ra mối tương quan mức độ trung bình giữa đường kính và độ xẹp của TMC dưới với áp lực nhĩ phải, những thông số này mang lại kết quả chính xác hơn khi được sử dụng để phân biệt giữa áp lực tĩnh mạch trung tâm bình thường/thấp (TMC dưới có đường kính < 2,1 cm và độ xẹp > 50%) so với áp lực tĩnh mạch trung tâm cao ( đường kính > 2,1 cm với độ xẹp < 50%). Nói cách khác, kích thước và khả năng thu gọn của TMC dưới có thể dùng như một chỉ điểm để phát hiện áp lực nhĩ phải tăng cao, nhưng chúng không đủ chính xác để ước tính giá trị áp lực nhĩ phải. Hơn nữa, mặc dù những thay đổi về đường kính và độ xẹp của TMC dưới đã được chứng minh là hữu ích trong việc theo dõi đáp ứng lợi tiểu và phân tầng nguy cơ suy tim, các phương pháp tiếp cận điều trị dựa vào TMC dưới này vẫn cần các nghiên cứu sâu hơn để xác định liệu chúng có hiệu quả hơn các chăm sóc thông thường ở bệnh nhân suy tim cấp hay không (27-29).
- Siêu âm tĩnh mạch cảnh trong
Đường kính của tĩnh mạch cảnh trong (IJV) khá nhỏ ở người khỏe mạnh và bệnh nhân bình thể tích (0,10 – 0,15 cm), nhưng tăng lên nhiều lần trong nghiệm pháp Valsalva (thường lên đến 1 cm). Ở những bệnh nhân có áp lực nhĩ phải tăng hoặc sung huyết nội mạch, đường kính của tĩnh mạch cảnh trong tăng khi nghỉ ngơi, dẫn đến tỷ lệ tĩnh mạch cảnh trong giảm. Tỷ lệ này < 4 được coi là bất thường (tỷ lệ này có thể giảm < 2 trong trường hợp sung huyết nghiêm trọng) (hình 3) và dự báo tiên lượng xấu hơn mà không phụ thuộc vào giá trị natri peptide lợi niệu (30).
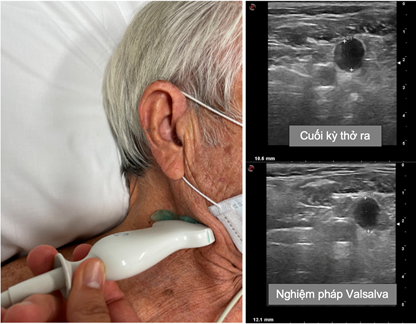
Hình 3. Đánh giá tĩnh mạch cảnh trong (30).
Tỷ lệ tĩnh mạch cảnh trong < 4 được coi là bất thường.
Tỷ lệ có thể giảm < 2 trong tình trạng sung huyết nghiêm trọng.
- Các tĩnh mạch trong khoang bụng
- Tĩnh mạch gan
Tĩnh mạch gan (HV) đổ vào nhĩ phải thông qua TMC dưới. Do đó, kiểu hình dòng chảy của TM gan có mối tương quan chặt chẽ với sự thay đổi áp lực trong nhĩ phải (tương tự như theo dõi xung tĩnh mạch cảnh) (hình 4). Dạng sóng TM gan bình thường có ba pha với 4 thành phần, bao gồm sóng A ngược (sóng tâm thu nhĩ), sóng S xuôi dòng (tâm thu thất), sóng V chuyển tiếp (sóng chuyển tiếp lấp đầy tâm nhĩ) và sóng D xuôi dòng (tâm trương tâm thất) (27).
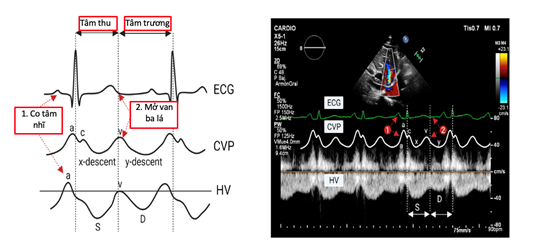
Hình 4. Sự thay đổi dạng sóng tĩnh mạch gan bình thường trong áp lực tĩnh mạch trung tâm (27). CVP, áp lực tĩnh mạch trung tâm; ECG, theo dõi điện tâm đồ; HV, tĩnh mạch gan
Ở những người có áp lực nhĩ phải thấp hoặc bình thường, lưu lượng TM gan chiếm ưu thế thì tâm thu. Ngược lại, ưu thế tâm thu này bị mất khi áp lực nhĩ phải tăng. Ở những bệnh nhân rối loạn chức năng thất phải hoặc hở van ba lá có ý nghĩa về mặt huyết động, có sự đảo ngược của sóng S thành sóng = D (S <D) hoặc thậm chí là sóng S ngược do hậu quả của sự trào ngược máu vào nhĩ phải và thất bại trong việc di chuyển vòng van ba lá về phía đỉnh tim. Tuy nhiên, mặc dù rối loạn chức năng van ba lá và thất phải thường cùng tồn tại, sóng S không nghịch hành khi không có hở van ba lá nặng. Do đó, nên thực hiện kiểm tra siêu âm tim chi tiết nếu tín hiệu TM gan trên Doppler cho thấy sóng S ngược (15, 31).
- Tĩnh mạch cửa
Sự thay đổi dòng chảy tĩnh mạch cửa đã được đề xuất như một dấu hiệu của sung huyết tĩnh mạch và rối loạn chức năng thất phải. Do áp lực tưới máu tương đối thấp (khoảng 10 mmHg), dòng máu vào tĩnh mạch cửa rất nhạy cảm với sự tăng áp lực hậu tải từ tim phải. Do đó, khi áp lực nhĩ phải tăng cao (như trong ST phải) và đạt được khả năng đệm tối đa của TMC dưới, sự thay đổi áp lực nhĩ phải trong chu chuyển tim sẽ được truyền vào hệ thống cửa, làm tăng nhịp đập của dòng chảy cửa (PPI – Portal pulsatility index chỉ số dao động cửa > 30%) (hình 5).
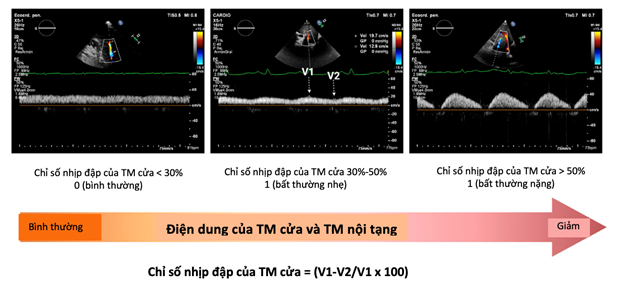
Hình 5. Chỉ số nhịp đập của tĩnh mạch cửa. Dạng sóng tĩnh mạch cửa bình thường và những thay đổi kèm theo khi có sung huyết tĩnh mạch. TM – tĩnh mạch (32)
Tương tự, việc giảm điện dung tĩnh mạch nội tạng do kích hoạt giao cảm cũng có thể góp phần làm thay đổi dòng vào tĩnh mạch cửa do hậu quả của sự thay đổi thể tích (truyền máu tự động) từ các mao mạch nội tạng. Điều thú vị là những phát hiện ban đầu cho thấy thuốc lợi tiểu có tác dụng rất tích cực và cải thiện đáng kể chỉ số dao động cửa. Mặc dù cần có những nghiên cứu sâu hơn để xác nhận tính hữu ích của việc đánh giá dòng chảy tĩnh mạch cửa bằng siêu âm Doppler ở bệnh nhân suy tim, các tác giả nhận thấy rằng siêu âm tĩnh mạch chủ dưới và siêu âm phổi có thể bổ sung những thông tin có giá trị cho các giao thức chẩn đoán và điều trị đã được thiết lập hiện nay (32-34) .
- Siêu âm tĩnh mạch thận
Sự gia tăng áp lực tĩnh mạch trung tâm và áp lực trong ổ bụng có thể truyền ngược dòng, làm tăng áp lực thủy tĩnh ở mô kẽ và ống thận bên trong biểu mô thận. Gần đây, kỹ thuật siêu âm đánh giá lưu lượng máu thận đã chứng minh tính hữu ích của đánh giá Doppler sóng xung trong việc xác định tình trạng sung huyết thận. Trong điều kiện bình thường, tĩnh mạch trong thận có dòng chảy liên tục không phụ thuộc vào chức năng thận. Tuy nhiên, các tĩnh mạch trong thận trở nên kém đàn hồi hơn khi áp lực tĩnh mạch trung tâm tăng, làm giảm dòng chảy liên tục thành dạng không liên tục. áp lực tĩnh mạch trung tâm tăng thêm cuối cùng có thể dẫn đến một pha dòng chảy trong tâm trương (mô hình dòng chảy tĩnh mạch nội thận đơn pha [IRVF]), trong đó dòng chảy ra từ tĩnh mạch thận có thể phụ thuộc hoàn toàn vào việc đổ đầy thất phải (hình 6).
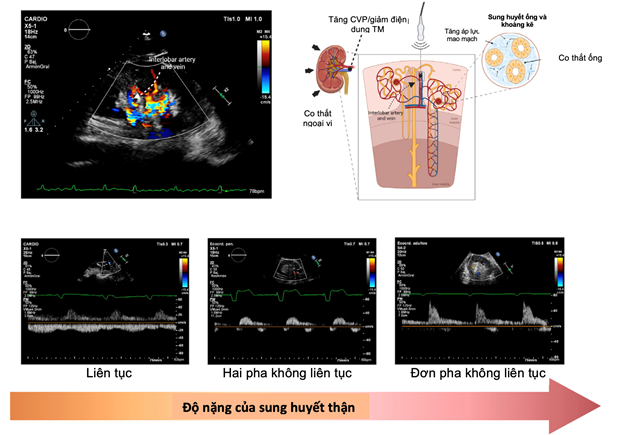
Hình 6. Dòng chảy tĩnh mạch trong thận bình thường và những thay đổi khi sung huyết tĩnh mạch và tăng áp lực trong ổ bụng. CVP – áp lực tĩnh mạch trung tâm, TM – tĩnh mạch (35)
Do mối liên quan giữa áp lực IRVF và ALTM trung tâm, một số tác giả lập luận rằng dạng sóng IRVF bị thay đổi chỉ đơn giản là một cách thức thay thế cho thấy ALTM trung tâm tăng cao. Tuy nhiên, vì thận là cơ quan có vỏ bọc nên dòng chảy ra từ tĩnh mạch thận không chỉ phụ thuộc vào ALTM trung tâm mà còn phụ thuộc vào các yếu tố bên ngoài có thể gây chèn ép ngoài thận (ví dụ cổ trướng, phù nội tạng, ứ máu tuần hoàn nội tạng). Hơn nữa, IRVF có thể bị gián đoạn do giảm điện dung tĩnh mạch trong thận và hệ thống qua trung gian giao cảm, bất kể nguyên nhân ảnh hưởng làm cho áp lực đổ đầy tim tăng lên. Thật vậy, một tỷ lệ cao bệnh nhân nhập viện mắc ST cấp có biểu hiện IRVF không liên tục khi nhập viện, điều này có tương quan một cách chặt chẽ với kết quả lâm sàng, mà không ảnh hưởng bởi các yếu tố tiên lượng thông thường, bao gồm cả ALTM trung tâm. Một điều thú vị là dữ liệu sơ bộ cho thấy các mẫu IRVF rất linh hoạt và có thể thay đổi khi điều trị giảm sung huyết, mở ra một con đường mới cho siêu âm tĩnh mạch thận như một dấu hiệu tiềm năng cho chẩn đoán và hướng dẫn điều trị. Tuy nhiên, cần có những nghiên cứu sâu hơn để làm sáng tỏ liệu chiến lược điều trị dựa trên mô hình IRVF kết hợp với các phát hiện liên quan đến sung huyết tĩnh mạch dựa trên siêu âm tim Doppler khác có liên quan đến kết quả lâm sàng được cải thiện ở bệnh nhân suy tim hay không (35-37).
3.4 Các dấu ấn sinh học
- Peptide natriuretic
Natri peptide natri lợi niệu não (BNP) và natri peptide lợi niệu loại Pro-b đầu tận N (NT-proBNP) là những dấu ấn sinh học hữu ích để chẩn đoán và phân tầng nguy cơ trong hội chứng suy tim. Cả hai đều là những yếu tố cho thấy sự tăng áp lực đổ đầy trái và áp lực động mạch phổi bít ở bệnh nhân suy tim. Tuy nhiên, tính hữu ích của chúng trong việc đánh giá và phân loại sự tích tụ dịch và sung huyết mô còn hạn chế. Ví dụ, thiếu máu cục bộ và rung nhĩ có liên quan đến việc tăng sức căng thành tâm thất mà không nhất thiết liên quan đến sung huyết. Tương tự như vậy, các yếu tố khác như tuổi tác, chỉ số khối cơ thể và chức năng thận ảnh hưởng mạnh mẽ đến nồng độ natri peptide lợi niệu (NP) trong huyết tương. Vì vậy, điều cần thiết là phải xem xét các yếu tố này khi diễn giải mức NP.
Nhìn chung, mức NP giảm nhiều hơn theo thời gian sẽ xác định bệnh nhân có tiên lượng tốt hơn. Ví dụ, trong ST cấp, mức giảm NP hơn 30% đã được coi là điểm dừng để xác định sự cải thiện về mặt lâm sàng và huyết động. Tuy nhiên, mặc dù có mối quan hệ rõ ràng giữa áp lực đổ đầy tim và tiên lượng, những thay đổi về NP có thể chỉ cho thấy một mối quan hệ yếu hoặc trung bình với các tác nhân làm giảm sung huyết trong ST cấp (2,38).
- ST2 hòa tan
Chất ức chế độc tính khối u dạng hòa tan loại 2 (ST2) là một thành viên của nhóm siêu thụ thể Toll-like/interleukin-1. Ở dạng hoà tan trong tuần hoàn (sST2), chất này đã được chứng minh là một dấu hiệu có giá trị để phân loại nguy cơ ở bệnh nhân suy tim cấp tính hoặc mãn tính. Là một dấu hiệu của tình trạng sung huyết, sST2 tương quan tích cực với các chỉ số siêu âm tim của suy tim bên phải và áp lực tĩnh mạch phổi và tĩnh mạch trung tâm được đo xâm lấn. Gần đây hơn, sST2 cũng được xác định là tác nhân thay thế cho tình trạng kháng thuốc lợi tiểu. Các cơ chế điều hoà đằng sau sự tăng sST2 trong ST cấp dường như có liên quan đến việc giải phóng ngoại vi các cytokine tiền viêm bởi các tế bào nội mô mạch máu và phổi được kích hoạt để đáp ứng với tình trạng tắc nghẽn huyết động và viêm. Tuy nhiên, cần có nhiều nghiên cứu hơn để đánh giá vai trò chính xác của dấu ấn sinh học này với tư cách là đại diện cho sự sung huyết và tiện ích của đánh giá nối tiếp trong việc theo dõi và hướng dẫn quá trình giảm sung huyết (39,40).
- CD146
Cụm biệt hóa 146 (CD146) là một glycoprotein được biểu hiện trên các tế bào nội mô, tế bào cơ trơn và tế bào ngoại vi trong toàn bộ hệ thống mạch máu. Protein này tương tác với nhiều phối tử khác nhau và điều hòa nhiều chức năng trong cân bằng nội môi mạch máu. Chất biệt hoá 146 có biểu hiện quá mức trong hội chứng suy tim cấp và có liên quan đến tình trạng viêm, tổn thương mạch máu và rối loạn chức năng nội mô.
Mức độ CD146 tăng cao quá mức đã được báo cáo ở những bệnh nhân bị ST cấp và có các nguyên nhân gây sung huyết khác trên lâm sàng. Một nghiên cứu về tăng áp lực tĩnh mạch ngoại biên được thực hiện bằng cách bơm căng các tĩnh mạch ở cẳng tay gây ra sự gia tăng nhanh chóng và rõ rệt lượng CD146 lưu thông ở cánh tay bị tắc nghẽn. Những dữ liệu này cho thấy rằng CD146 có khả năng là một chất đánh dấu sinh học đáng tin cậy về sung huyết tĩnh mạch. Tuy nhiên, bằng chứng ủng hộ mối liên hệ của dấu ấn sinh học này với các thông số sung huyết khác và tiện ích lâm sàng của nó trong việc mô tả đặc điểm sung huyết còn hạn chế (41-43).
4. ĐÁNH GIÁ SUNG HUYẾT MÔ
Quá tải thể tích thường là một hiện tượng diễn ra từ từ do ái lực với natri và nước trong ống thận, sự mất cân bằng giữa áp suất thủy tĩnh và áp lực keo giữa khoang nội mạch và khoảng kẽ, và giảm dự trữ của hệ thống bạch huyết.
Triệu chứng và dấu hiệu
- Tắc nghẽn mô hệ thống
Cổ trướng và phù ngoại biên thường là chỉ điểm của sự tích tụ dịch khoảng kẽ/khoang thứ ba. Phù ngoại biên có độ đặc hiệu cao để chẩn đoán sung huyết mô. Tuy nhiên, độ nhạy của nó thấp vì các bệnh đồng mắc khác như suy tĩnh mạch, suy thận và giảm albumin máu cũng có thể ảnh hưởng đến sự hiện diện của cổ trướng và phù ngoại biên. Tương tự như vậy, tràn dịch huyết thanh, bao gồm tràn dịch màng phổi, màng ngoài tim và phúc mạc, cũng được tìm thấy trong một số tình trạng khác ngoài suy tim.
- Sung huyết mô phổi
Các biểu hiện chính của sung huyết mô phổi là rales và tràn dịch màng phổi. Tuy nhiên, độ chuyên biệt của chúng trong việc ước tính sung huyết ở bệnh nhân suy tim còn hạn chế và sự vắng mặt của chúng không loại trừ sung huyết phổi ở bệnh nhân suy tim.
Đánh giá qua siêu âm
- Siêu âm phổi
Siêu âm phổi là một phương pháp định lượng, đơn giản và nhanh chóng để xác định và định lượng dịch phổi ngoài lòng mạch. Khi phổi được thông khí bình thường, đường màng phổi (đường A) sẽ là cấu trúc duy nhất có thể nhìn thấy được bằng siêu âm phổi. Các đường A được hình dung là các đường tăng âm, mỏng và nằm ngang, di chuyển theo nhịp thở do màng phổi tạng và thành trượt trong chu kỳ hô hấp. Ở những bệnh nhân nghi ngờ hoặc xác định mắc suy tim, lượng nước phổi ngoài mạch tăng lên và vách liên tiểu thùy phổi dày lên do phù nề tạo ra các tạo tác âm vang theo chiều dọc được gọi là ”đường B” (hình 7). Khi những đường B này nhiều, chúng hợp nhất và tạo thành các vùng hợp lưu, xác định các vùng phù phế nang (hình 7). Siêu âm phổi đã được sử dụng rộng rãi để chẩn đoán và tiên lượng trong các tình huống suy tim khác nhau. Hơn nữa, số lượng và vị trí của các đường B dường như thay đổi nhanh chóng sau khi điều trị sung huyết, khiến chúng trở thành một dấu hiệu hấp dẫn để theo dõi tình trạng sung huyết phổi (44-45).
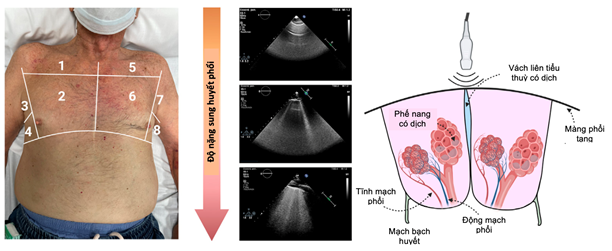
Hình 7. Siêu âm phổi qua phương pháp chia vùng ngực thành 8 phần (44).
Tuy nhiên, một số lưu ý cần cân nhắc khi sử dụng siêu âm phổi trong thực hành lâm sàng. Đầu tiên, đường B chỉ là biểu hiện của tình trạng phổi mất thông khí. Theo đó, siêu âm phổi không phân biệt giữa bản chất của dịch (dịch thấm và dịch tiết), nguyên nhân gây dày vách liên tiểu thùy (tức là xơ hóa, phù nề) hoặc cơ chế dẫn đến dịch thấm từ mạch máu vào khoảng kẽ (tăng áp lực thủy tĩnh hoặc tăng tính thấm thành mạch). Do đó, siêu âm phổi phải luôn được giải thích trong bối cảnh lâm sàng thích hợp và bên cạnh các dấu hiệu lâm sàng và sinh hóa khác. Thứ hai, các giá trị ngưỡng tối ưu để phân tầng nguy cơ trong các tình huống lâm sàng khác nhau cần được xác định trong các nghiên cứu tiến cứu lớn hơn. Cuối cùng, mặc dù các nghiên cứu nhỏ có đối chứng cho thấy lợi ích lâm sàng của liệu pháp hướng dẫn, cần có các thử nghiệm ngẫu nhiên lớn hơn để chứng minh rằng điều trị theo hướng dẫn của siêu âm phổi là an toàn, cải thiện các triệu chứng và chất lượng cuộc sống cũng như kết cục sức khoẻ lâu dài (46).
Các dấu ấn sinh học của hệ tuần hoàn
- Kháng nguyên carbohydrate 125
Kháng nguyên carbohydrate 125 (CA125) là một glycoprotein trọng lượng phân tử cao được mã hóa bởi gen MUC16 ở người. Nó được biểu hiện trên bề mặt tế bào huyết thanh dưới dạng protein gắn màng và được giải phóng vào tuần hoàn ở dạng hòa tan. Dấu ấn sinh học này được sử dụng rộng rãi để theo dõi bệnh ung thư buồng trứng. Tuy nhiên, CA125 cũng được điều hòa gia tăng trong các bệnh ung thư khác và các bệnh lành tính liên quan đến tăng thể tích. Nguyên nhân chính xác gây ra điều chỉnh tăng CA125 vẫn chưa được biết. Tuy nhiên, việc kích hoạt các tế bào trung biểu mô để đáp ứng với áp suất thủy tĩnh tăng cao, tăng áp lực cơ học và các kích thích viêm được coi là những yếu tố chính. Bằng chứng tích lũy hỗ trợ mối liên quan giữa mức CA125 tuần hoàn và các thông số về tắc nghẽn và quá tải chất lỏng, đặc biệt là các biến thể của sung huyết mô /tràn dịch huyết thanh. Ví dụ, trong một nghiên cứu lớn ở bệnh nhân suy tim cấp, sự hiện diện của tràn dịch màng phổi, mức độ nghiêm trọng của hở van 3 lá và phù ngoại biên là những yếu tố liên quan chặt chẽ đến nồng độ chất CA125. Ngoài ra, các nghiên cứu nhỏ gần đây cũng ủng hộ mối liên quan giữa glycoprotein này với sung huyết tĩnh mạch thận và tăng áp lực trong ổ bụng ở bệnh nhân suy tim cấp.
Dấu ấn sinh học này có một số đặc tính đáng chú ý. Đầu tiên, những thay đổi của mức CA125 có liên quan chặt chẽ với mức độ nghiêm trọng của bệnh và kết quả lâm sàng, đặc biệt là trong những tuần đầu tiên sau một đợt suy tim nặng hơn (giai đoạn chuyển tiếp). Một nghiên cứu dài hạn trên 946 bệnh nhân lần lượt xuất viện vì suy tim cấp cho thấy quỹ đạo dài hạn được mô tả bằng các đo lường lặp lại của CA125 nhằm dự đoán tỷ lệ tử vong dài hạn (nguy cơ thấp khi dấu ấn sinh học giảm và nguy cơ cao khi nó duy trì ở mức cao hoặc tăng trong quá trình theo dõi). Thứ hai, mức CA125 lưu hành trong máu không bị thay đổi đáng kể theo độ tuổi, chức năng thận, bệnh nguyên của thiếu máu cục bộ, rung nhĩ, hoặc phân suất tống máu thất trái. Những đặc tính thuận lợi này gợi ý một tiện ích lâm sàng trên toàn bộ bệnh nhân suy tim và để theo dõi diễn biến của bệnh. Ngoài ra, hai thử nghiệm lâm sàng ngẫu nhiên nhỏ cho thấy tiềm năng của dấu ấn sinh học này trong việc hướng dẫn điều trị bằng lợi tiểu ở những bệnh nhân có đợt suy tim nặng gần đây. Trong thử nghiệm CHANCE-HF, 380 bệnh nhân vừa mới mắc suy tim mất bù và có CA125 ³ 35 U/mL đã được phân nhóm điều trị ngẫu nhiên theo chăm sóc tiêu chuẩn so với điều trị liệu theo hướng dẫn CA125. Ở nhóm CA125, việc điều chỉnh tăng hoặc giảm thuốc lợi tiểu thường xuyên hơn, giúp giảm tỷ lệ nhập viện do suy tim trong vòng một năm.
Để giải thích chính xác mức CA125 trong suy tim, một số khía cạnh phải được chú ý. Đầu tiên, có một khoảng cách về thời gian giữa thời điểm bắt đầu sung huyết với việc tăng hoạt hoá và giải phóng CA125 (hiệu ứng muộn). Theo đó, những bệnh nhân bị quá tải dịch kéo dài có nhiều khả năng có nồng độ CA125 trong huyết tương tăng cao. Ví dụ, ở những bệnh nhân khởi phát cấp tính hơn (vài phút đến vài giờ), những bệnh nhân có tái phân bố chủ yếu trong mạch máu có thể sẽ không biểu hiện sự tăng nồng độ CA125. Thứ hai, CA125 có thời gian bán hủy kéo dài (7-12 ngày). Do đó, các đo lường CA125 liên tiếp để theo dõi quá trình giảm sung huyết nên được thực hiện trong những tuần đầu tiên chứ không phải trong những ngày đầu tiên mất bù (47).
- Adrenomedullin sinh học
Adrenomedullin (ADM) được cho là duy trì tính toàn vẹn của mạch máu và chức năng hàng rào thẩm thấu. Ở bệnh suy tim, bằng chứng hiện tại cho thấy công dụng của ADM ở dạng hoạt tính sinh học (bio-ADM) như một đại diện cho sung huyết và tích tụ dịch. Ví dụ, bio-ADM có liên quan tuyến tính với mức độ nghiêm trọng của điểm sung huyết lâm sàng ở bệnh nhân suy tim cấp. Hơn nữa, ở những bệnh nhân có suy tim phân suất tống máu giảm tiến triển ổn định, bio-ADM gia tăng khi các yếu tố đại diện cho áp lực nội mạch cao (áp lực mao mạch phổi bít, áp lực nhĩ phải trung bình và NT- proBNP). Tương tự như vậy, các nghiên cứu khác chỉ ra rằng bio-ADM cũng tương quan với các yếu tố biểu hiện của sung huyết mô (CA125, phù nề). Do đó, chúng tôi cho rằng bio-ADM có thể phản ánh đánh giá tổng hợp về các loại sung huyết mạch máu và mô như một dấu hiệu đánh giá tính thấm thành mạch. Điều thú vị là, ở những bệnh nhân có dấu hiệu lâm sàng của sung huyết tồn lưu 7 ngày sau khi nhập viện, nồng độ bio-ADM ở mức cao ở mức cơ bản và duy trì ở mức cao liên tục trong tuần đầu nhập viện này. Tuy nhiên, vai trò của dấu ấn sinh học này trong việc theo dõi và hướng dẫn điều trị bằng thuốc lợi tiểu đòi hỏi phải có đánh giá xa hơn và sâu sắc hơn (47-50).
5. CÁCH TÍCH HỢP CÁC KỸ THUẬT NÀY: MỘT PHƯƠNG PHÁP TIẾP CẬN ĐA THÔNG SỐ THỰC TIỄN
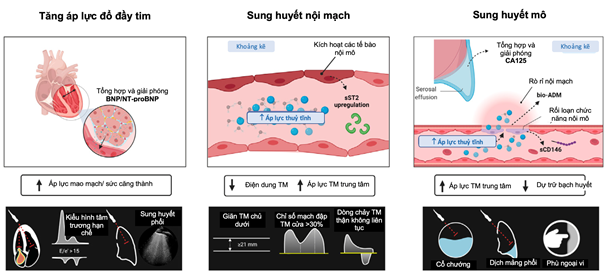
Hình 8. Phương pháp tiếp cận đa thông số và tích hợp để chẩn đoán tắc nghẽn.
Chuyển từ đánh giá lâm sàng truyền thống sang cách tiếp cận toàn diện và đa thông số hơn (Hình 8) có thể cho phép chúng ta xác định rõ hơn mức độ nghiêm trọng và sự phân bố của sung huyết. Hơn nữa, việc tích hợp các kỹ thuật hình ảnh và các dấu ấn sinh học tuần hoàn cùng với bệnh sử lâm sàng và khám thực thể có thể cải thiện độ chính xác trong chẩn đoán tình trạng sung huyết, tiết lộ kiểu hình sung huyết chiếm ưu thế. Do đó, chúng tôi đề xuất một phương pháp tích hợp sử dụng NP, CA125 và bio-ADM làm dấu ấn sinh học tuần hoàn, cùng với siêu âm tim và siêu âm tĩnh mạch làm kỹ thuật hình ảnh (Hình 9A). Bệnh nhân có thể được phân loại theo sự phân bố sung huyết theo khu vực (tức là phổi và hệ thống) và theo khoang (tức là trong mạch máu và mô). Ví dụ, chúng ta hình dung ra hai tình huống cực đoan. Một mặt, bệnh nhân suy tim phải có thể khởi phát lâm sàng từ từ hơn, với sự phân bố sung huyết toàn thân chiếm ưu thế, với nồng độ CA125 và bio-ADM trong huyết tương tăng cao là dấu hiệu thay thế của sung huyết mô và bằng chứng siêu âm về giảm dung tích tĩnh mạch (tức là giãn tĩnh mạch chủ dưới, chỉ số mạch cửa > 30%, dòng tĩnh mạch trong thận không liên tục). Mặt khác, những người có suy tim trái chủ yếu có thể có biểu hiện lâm sàng cấp tính hơn với sung huyết phổi được đánh giá bởi siêu âm phổi, nồng độ NP trong huyết tương cao hơn và E/e’ ³ 15 là dấu hiệu thay thế cho việc tăng áp lực đổ đầy phổi trái và các thông số CA125, bio-ADM và siêu âm tĩnh mạch bình thường hoặc bất thường nhẹ. Ở giữa, chúng ta sẽ thấy những mức độ chồng chéo khác nhau cũng có thể thay đổi theo thời gian (hình 9B). Việc xác định kiểu hình sung huyết chiếm ưu thế và những thay đổi theo thời gian bằng phương pháp đa thông số này có thể cho phép: a) phát hiện sớm sung huyết cận lâm sàng; b) giám sát chính xác hơn tình trạng sung huyết; và c) cải thiện việc ra quyết định lâm sàng để chuyển sang tình huống điều trị chính xác hơn. Về ý nghĩa điều trị, các tác giả cho rằng những bệnh nhân bị sung huyết nội mạch chủ yếu có thể được hưởng lợi nhiều hơn từ việc điều chỉnh trương lực mạch máu hơn là các chiến lược giảm sung huyết tích cực. Ngược lại, những người có tình trạng sung huyết mô/quá tải thể tích chiếm ưu thế có thể đủ điều kiện sử dụng phương pháp lợi tiểu mạnh hơn trong khi vẫn duy trì khả năng đổ đầy mạch máu. Các nghiên cứu sâu hơn cần được tiến hành để kiểm tra các định đề cho khuyến cáo cuối cùng.
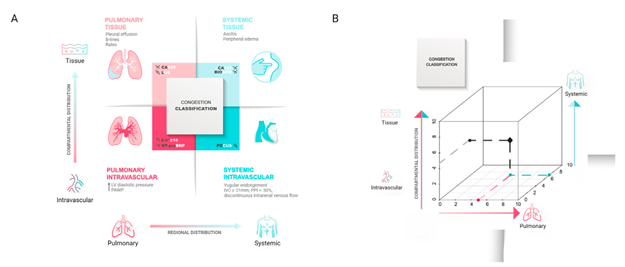
Hình 9. A: Sự phân bố sung huyết theo vùng và theo 2 chiều không gian (2D) bằng khám thực thể, dấu ấn sinh học tuần hoàn và kỹ thuật hình ảnh. B: biểu đồ có 3 trục, biểu thị mức độ sung huyết phổi và sung huyết hệ thống ngày càng tăng, ghi nhận các bước phân bố khác nhau trong khoang (sung huyết nội mạch và mô). Biểu diễn này thực tế là phiên bản 3 chiều (3D) của biểu đồ 2D được trình bày trong bảng A. Cách tiếp cận khái niệm 3D này cung cấp tọa độ sung huyết, do đó phân loại tất cả các chiều sung huyết cùng một lúc. Trong ví dụ được cung cấp ở đây, bệnh nhân chủ yếu bị sung huyết hệ thống (điểm 7/10) nhưng cũng có sung huyết phổi ở mức độ vừa phải (điểm 5/10). Trên trục Y, chúng ta có thể quan sát thấy bệnh nhân bị sung huyết nội mạch và đang chuyển sang sung huyết mô.
Bio-ADM, bioadrenomedullin; CA125, kháng nguyên carbohydrate 125; IVC, tĩnh mạch chủ dưới; LV, thất trái; LUS, siêu âm phổi; NT-proBNP, peptit natriuretic loại pro-b-terminal N-terminal; PAWP, áp lực động mạch phổi; PPI, chỉ số nhịp dòng chảy tĩnh mạch cửa; POCUS, siêu âm theo vùng chăm sóc.
Trong trường hợp không thực hiện được siêu âm, kết hợp CA125 và bio-ADM với khám lâm sàng và NP giúp có thể có được bức tranh tổng thể về mức độ nghiêm trọng, thời gian và sự phân bố tắc nghẽn ở hầu hết bệnh nhân. Nhìn chung, những bệnh nhân có nồng độ CA125 và bio-ADM trong huyết tương tăng cao thường biểu hiện nhiều hơn khởi phát lâm sàng dần dần với chủ yếu là sung huyết toàn thân/tràn dịch huyết thanh và có thể có lợi hơn từ phương pháp lợi tiểu chuyên sâu. Ngược lại, những người khởi phát cấp tính hơn, với sự tái phân bố phổi là kiểu hình sung huyết chiếm ưu thế, thường có nồng độ NP trong huyết tương cao hơn và các giá trị CA125 và ADM sinh học bình thường hoặc bất thường nhẹ. Những bệnh nhân này có thể được hưởng lợi nhiều hơn từ việc điều chỉnh trương lực mạch máu hơn là các chiến lược giảm tắc nghẽn tích cực . Ở giữa, các mức độ chồng chéo khác nhau có thể tồn tại, đảm bảo đánh giá đa tham số (hình 9) (47).

Hình 9. Dấu ấn sinh học để xác định kiểu hình tắc nghẽn chiếm ưu thế
6. KẾT LUẬN
Đánh giá chính xác tình trạng sung huyết vẫn là một thách thức trong thực hành lâm sàng hàng ngày. Đánh giá lâm sàng truyền thống có những hạn chế và khuyết điểm quan trọng. Một cách tiếp cận đa thông số bao gồm các kỹ thuật hình ảnh có sẵn rộng rãi và các dấu ấn sinh học tuần hoàn có thể cải thiện đặc tính của đánh giá lâm sàng và tối ưu hóa các phương pháp điều trị.
TÀI LIỆU THAM KHẢO
- Mullens W, Damman K, Harjola VP, et al. The use of diuretics in heart failure with congestion – a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2019; 21:137–155.
- McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021; 42:3599–3726
- Yaranov DM, et al. Discordance of. Pressure and Volume: Potential Implications for Pressure-Guided Remote Monitoring in Heart Failure. Journal of Cardiac Failure. 2022; 28:870–872
- Miller WL. Fluid Volume Overload and Congestion in Heart Failure: Time to Reconsider Pathophysiology and How Volume Is Assessed. Circ: Heart Failure. 2016;9: e002922.
- Fallick C, Sobotka PA, Dunlap ME. Sympathetically Mediated Changes in Capacitance: Redistribution of the Venous Reservoir as a Cause of Decompensation. Circ: Heart Failure. 2011; 4:669–675.
- Fudim M, Hernandez AF, Felker GM. Role of Volume Redistribution in the Congestion of Heart Failure. J Am Heart Assoc. 2017;6: e006817.
- Miller WL, et al. Contributions of cardiac dysfunction and volume status to central haemodynamics in chronic heart failure. Eur J Heart Fail. 2021; 23:1097–1105.
- Lindenfeld J, Zile MR, Desai AS, et al. Haemodynamic-guided management of heart failure (GUIDE-HF): a andomised controlled trial. Lancet. 2021; 398:991–1001
- Maurer MS, Packer M. Impaired systemic venous capacitance: the neglected mechanism in patients with heart failure and a preserved ejection fraction? Eur J Heart Fail. 2020;22: 173–176.
- Boorsma EM, Ter Maaten JM, Damman K, et al. Congestion in heart failure: a contemporary look at physiology, diagnosis and treatment. Nat Rev Cardiol. 2020; 17:641–655.
- Fudim M, Salah HM, Sathananthan J, et al. Lymphatic Dysregulation in Patients With Heart Failure: JACC Review Topic of the Week. J Am Coll Cardiol. 2021; 78:66–76
- Stevenson LW, Zile M, Bennett TD, et al. Chronic Ambulatory Intracardiac Pressures and Future Heart Failure Events. Circ: Heart Failure. 2010; 3:580–587.
- Gheorghiade M, Follath F, Ponikowski P, et al. Assessing and grading congestion in acute heart failure: a scientific statement from the Acute Heart Failure Committee of the Heart Failure Association of the European Society of Cardiology and endorsed by the European Society of Intensive Care Medicine. European Journal of Heart Failure. 2010; 12:423–433.
- Binanay C, Califf RM, Hasselblad V, et al. Evaluation study of congestive heart failure and pulmonary artery catheterization effectiveness: the ESCAPE trial. JAMA. 2005;294:1625–1633.
- Rudski LG, Lai WW, Afilalo J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of J Am Soc Echocardiogr. 2010; 23:685–713
- Breidthardt T, Moreno-Weidmann Z, Uthoff H, et al. How accurate is clinical assessment of neck veins in the estimation of central venous pressure in acute heart failure? Insights from a prospective study: How accurate is clinical assessment of neck veins in the estimation of central venous pressure in acute heart failure? Insights from a prospective stu. Eur J Heart Fail. 2018; 20:1160–1162
- Thibodeau JT, Turer AT, Gualano SK, et al. Characterization of a Novel Symptom of Advanced Heart Failure: Bendopnea. JACC: Heart Failure. 2014; 2:24–31
- Wynne J. The clinical meaning of the third heart sound. The American Journal of 2001; 111:157–158.
- Nagueh SF, Smiseth OA, Appleton CP, et al. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2016;2 9:277–314.
- Shah AM, Cikes M, Prasad N, et al. Echocardiographic Features of Patients With Heart Failure and Preserved Left Ventricular Ejection Fraction. J Am Coll Cardiol. 2019; 74:2858–2873
- Gorter TM, van Veldhuisen DJ, Bauersachs J, et al. Right heart dysfunction and failure in heart failure with preserved ejection fraction: mechanisms and management. Position statement on behalf of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2018; 20:16–37.
- Guazzi M, Bandera F, Pelissero G, et al. Tricuspid annular plane systolic excursion and pulmonary arterial systolic pressure relationship in heart failure: an index of right ventricular contractile function and prognosis. Am J Physiol Heart Circ Physiol. 2013; 305:H1373–H1381.
- Rosenkranz S, et al. Systemic Consequences of Pulmonary Hypertension and Right-Sided Heart Failure. Circulation. 2020; 141:678–693
- A et al. Ultrasound imaging of congestion in heart failure: a narrative review. Cardiovasc Diagn Ther 2025;15(1):233-250
- Beaubien-Souligny. W et al Extracardiac Signs of Fluid Overload in the Critically Ill Cardiac Patient: A Focused Evaluation Using Bedside Ultrasound. Can J Cardiol . 2017 Jan; 33 (1): 88-100.
- De la Esperiella.R. Assessment of filling pressures and fluid overload in heart failure: an updated perspective. Rev Esp Cardiol. 2023; 76 (1): 47–57
- Beigel R, et al. Noninvasive evaluation of right atrial pressure. J Am Soc Echocardiogr. 2013; 26:1033–1042
- Krishnan DK, et al. Point-of-Care Ultraportable Echocardiography Predicts Diuretic Response in
Patients Admitted with Acute Decompensated Heart Failure. Clin Med Insights Cardiol. 2016; 10:201–208 - Jobs A, Vonthein R, Ko¨nig IR, et al. Inferior vena cava ultrasound in acute decompensated heart failure: design rationale of the CAVA-ADHF-DZHK10 trial. ESC Heart Fail. 2020; 7:973–983
- Pellicori P, Kallvikbacka-Bennett A, Dierckx R, et al. Prognostic significance of ultrasound-assessed jugular vein distensibility in heart failure. Heart. 2015; 101:1149–1158.
- Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease: Developed by the Task Force for the management of valvular heart disease of the European Society of Cardiology
(ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Rev Esp Cardiol. 2022; 75:524 - Beaubien-Souligny W, Benkreira A, Robillard P, et al. Alterations in Portal Vein Flow and Intrarenal Venous Flow Are Associated With Acute Kidney Injury After Cardiac Surgery: A Prospective Observational Cohort Study. J Am Heart Assoc. 2018;7: e009961
- Singh NG, et al. Portal venous pulsatility fraction, a novel transesophageal echocardiographic marker for right ventricular dysfunction in cardiac surgical patients. Ann Card Anaesth. 2020; 23:39–42.
- Argaiz ER, Rola P, Gamba G. Dynamic Changes in Portal Vein Flow during Decongestion in Patients with Heart Failure and Cardio-Renal Syndrome: A POCUS Case Series. Cardiorenal Med. 2021; 11:59–66
- Iida N, Seo Y, Sai S, et al. Clinical Implications of Intrarenal Hemodynamic Evaluation by Doppler Ultrasonography in Heart Failure. JACC Heart Fail. 2016;4:674–682.
- Ter Maaten JM, Dauw J, Martens P, et al. The Effect of Decongestion on Intrarenal Venous Flow Patterns in Patients With Acute Heart Failure. J Card Fail. 2021; 27:29–34.
- Yamamoto M, Seo Y, Iida N, et al. Prognostic Impact of Changes in Intrarenal Venous Flow Pattern in Patients With Heart Failure. J Card Fail. 2021; 27:20–28.
- Mueller C, McDonald K, de Boer RA, et al. Heart Failure Association of the European Society of Cardiology practical guidance on the use of natriuretic peptide concentrations. Eur J Heart Fail. 2019; 21:715–731.
- Aimo A, Januzzi JL, Bayes-Genis A, et al. Clinical and Prognostic Significance of sST2 in Heart Failure: JACC Review Topic of the Week. J Am Coll Cardiol. 2019; 74:2193–2203
- Baye´s-Genis A, Gonza´lez A, Lupo´ n J. ST2 in Heart Failure. Circ Heart Fail. 2018; 11: e005582
- Bardin N, Moal V, Anfosso F, et al. Soluble CD146, a novel endothelial marker, is increased in physiopathological settings linked to endothelial junctional alteration. Thromb Haemost. 2003; 90:915–920
- Gayat E, Caillard A, Laribi S, et al. Soluble CD146, a new endothelial biomarker of acutely decompensated heart failure. Int J Cardiol. 2015; 199: 241–247.
- Arrigo M, Truong QA, Onat D, et al. Soluble CD146 Is a Novel Marker of Systemic Congestion in Heart Failure Patients: An Experimental Mechanistic and Transcardiac Clinical Study. Clin Chem. 2017; 63:386–393
- Domingo M, Lupo´ n J, Girerd N, et al. Lung ultrasound in outpatients with heart failure: the wet-to-dry HF study. ESC Heart Fail. 2021; 8:4506–4516.
- Pivetta E, Goffi A, Nazerian P, et al. Lung ultrasound integrated with clinical assessment for the diagnosis of acute decompensated heart failure in the emergency department: a randomized controlled trial. Eur J Heart Fail. 2019; 21:754–766.
- Rivas-Lasarte M, A´ lvarez-Garcı´a J, Ferna´ndez-Martı´nez J, et al. Lung ultrasoundguided treatment in ambulatory patients with heart failure: a randomized controlled clinical trial (LUS-HF study). Eur J Heart Fail. 2019; 21:1605–1613
- de la Espriella. R et al. Biomarkers to Improve Decision-making in Acute Heart Failure. Cardiac Failure Review 2023;9: e13. DOI: https://doi.org/10.15420/cfr.2023.08
- Voors AA, Kremer D, Geven C, et al. Adrenomedullin in heart failure: pathophysiology and therapeutic application. Eur J Heart Fail. 2019; 21:163–171.
- Ter Maaten JM, Kremer D, Demissei BG, et al. Bio-adrenomedullin as a marker of congestion in patients with new-onset and worsening heart failure. Eur J Heart Fail. 2019; 21:732–743.
- Goetze JP, Balling L, Deis T, Struck J, Bergmann A, Gustafsson F. Bioactive adrenomedullin in plasma is associated with biventricular filling pressures in patients with advanced heart failure. Eur J Heart Fail. 2021; 23:489–491







