ThS. BS. LÊ THỊ LAN HƯƠNG
PGS. TS. PHẠM NGUYỄN VINH
Bệnh viện đa khoa Tâm Anh
(…)
3. ĐÁNH GIÁ SỐNG CÒN CƠ TIM TRONG BỆNH ĐỘNG MẠCH VÀNH
Hiện nay, tái tưới máu động mạch vành vẫn còn có vai trò nhất định trong điều trị bệnh, nhưng việc lựa chọn bệnh nhân cũng như sang thương để tái tưới máu, đặc biệt ở những bệnh nhân mắc hội chứng động mạch vành mạn tính vẫn còn nhiều tranh cãi 2. Đứng trên quan điểm của tim mạch can thiệp, vị trí giải phẩu và mức độ thương tổn của động mạch vành dựa trên kết quả chụp mạch vành là mối quan tâm chính trước khi quyết định tái tưới máu. Tuy nhiên, cách tiếp cận này không thể đánh giá chính xác lưu lượng vành, tính sống còn của những vùng cơ tim bị rối loạn chức năng và vì vậy không tiên đoán được khả năng hồi phục chức năng của các vùng cơ tim bị rối loạn vận động trước khi can thiệp 27,28. Bệnh nhân với những tổn thương nhiều nhánh mạch vành, giải phẫu phức tạp, nhiều bệnh lý đồng mắc hoặc suy chức năng thất trái nặng, sẽ có nguy cơ cao khi can thiệp mạch vành 28. Đồng thời các tổn thương sẹo cơ tim, có thể gây ra rối loạn chức năng thất trái không đảo ngược được. Sự đảo ngược này thường chỉ xảy ra ở những vùng cơ tim còn sống nhưng bị rối loạn chức năng (cơ tim choáng vàng – stuning hoặc cơ tim ngủ đông – hibernating) 2. Nhiều các nghiên cứu đã cho thấy, việc đánh giá sống – còn cơ tim rất quan trọng trong chiến lược tái thông mạch vành. Nhờ tiến bộ kĩ thuật, hiện nay có rất nhiều phương tiện chẩn đoán hình ảnh không xâm lấn có thể dùng để đánh giá sống còn cơ tim như: Siêu âm tim bằng thuốc Dobutamine, siêu âm tim bằng chất cản âm, SPECT sử dụng tecneti hoặc thallium, chụp cắt lớp vi tính và đặc biệt là cộng hưởng từ với giá trị chẩn đoán cao.
3.1. Nguyên lý hình LGE8:
Gadolinium là một chất tương phản ngoại bào. Do tính toàn vẹn của màng tế bào cơ tim bình thường, sau khi vào hệ tuần hoàn và đến tế bào chất tương phản nhanh chóng bài xuất ra khỏi mạng lưới nội bào. Tuy nhiên, khi tế bào cơ tim hoại tử sau nhồi máu cơ tim, màng tế bào bị mất tính ổn định và toàn vẹn, làm chất tương phản khuếch tán vào khoảng kẽ và nội bào. Kết quả làm tăng nồng độ chất tương phản trong mô và tăng tín hiệu mô cơ tim. Ở những cơ tim tổn thương mạn tính, làm tăng tổ chức nền của tế bào và collagen, dẫn đến chất tương phản tích tụ với nồng độ cao trong khoảng kẽ, là cơ sở của LGE (Hình 11).
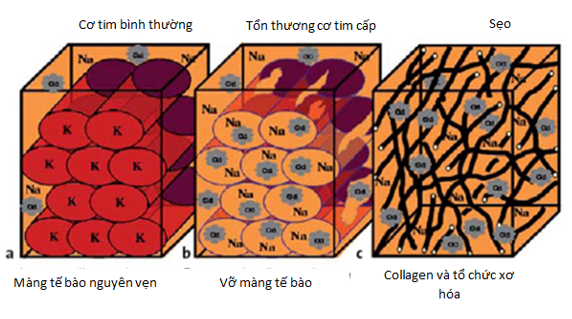
Hình 11: Cơ chế khuếch tán chất cản từ trong các mô cơ tim
Sau khi tiêm chất tương phản, ở những mô cơ tim bình thường sẽ bài xuất chất cản từ sau 5 – 10 phút. Tuy nhiên, ở những cơ tim tổn thương sau nhồi máu cơ tim, do sự khuếch tán vào mô kẽ nên có tình trạng tăng tín hiệu khi khảo sát trên CMR.
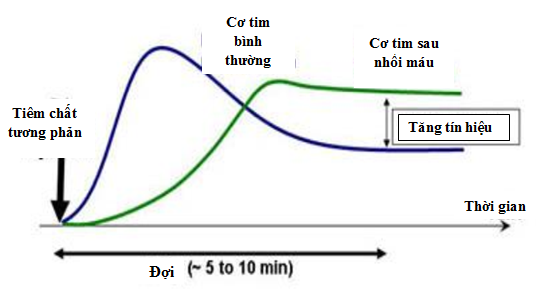
Hình 12: Sự thay đổi tín hiệu giữa cơ tim bình thường và cơ tim bị nhồi máu sau khi tiêm chất cản từ
3.2. Kĩ thuật CMR đánh giá sống còn cơ tim8
CMR trong đánh giá sống – còn cơ tim bao gồm: các chuỗi xung cine trên mặt cắt 4 buồng, ba buồng, 2 buồng và trục ngắn để đánh giá vận động vùng; sau đó dùng hình ảnh tăng tín hiệu muộn (LGE) cơ tim trên cùng mặt cắt đó để khảo sát sẹo và các vùng cơ tim còn sống. LGE phụ thuộc vào các xung ngược (inversion recovery pulse) để làm giảm tín hiệu cơ tim bình thường (nulling cơ tim), tạo độ tương phản để xác định sẹo cơ tim. Thời gian đảo ngược ( inversion time) được dùng để tối ưu hóa việc nulling cơ tim. Thời gian này thay đổi tùy từng trường hợp và phụ thuộc vào thời gian sau khi tiêm thuốc cản từ. Do đó, hình ảnh TI-scout phải được thực hiện ngay trước khi đánh giá hình ảnh tăng tín hiệu muộn để xác định đúng thời điểm TI, dựa vào đó xác định vùng cơ tim bình thường và sẹo cơ tim. Trên thực tế lâm sàng, nhiều khi nulling cơ tim không phải lúc nào cũng tối ưu, trong trường hợp đó, hình PSIR (phase-sensitive inversion recovery) khá hữu ích.
3.3. Giá trị CMR trong đánh giá cơ tim còn sống sau NMCT cấp8
- Thay đổi cường độ tín hiệu ( SI: signal intensity) trên hình T2W:
Nhồi máu cơ tim cấp gây phù nề cơ tim. Hiện tượng này chỉ xảy ra trong giai đoạn sớm ngay sau nhồi máu cơ tim ( trong vòng 10 ngày), và khi so sánh với những vùng cơ tim bình thường, vùng bị nhồi máu sẽ có tình trạng tăng tín hiệu trên hình T2W. Tuy nhiên, trên thực tế khi phân tích hình T2W phải luôn chú ý một số “cạm bẫy” sau: tình trạng tăng tín hiệu xảy ra khi dòng chảy chậm (nhất là ở những vùng nhồi máu), hoặc một số “xảo ảnh” tăng tín hiệu giả gây ra bởi hô hấp hay chuyển động của tim. Do đó, khi thực hiện kĩ thuật này, cần tối ưu hóa các thông số kĩ thuật để thu hình T2W tốt nhất (hình 13)
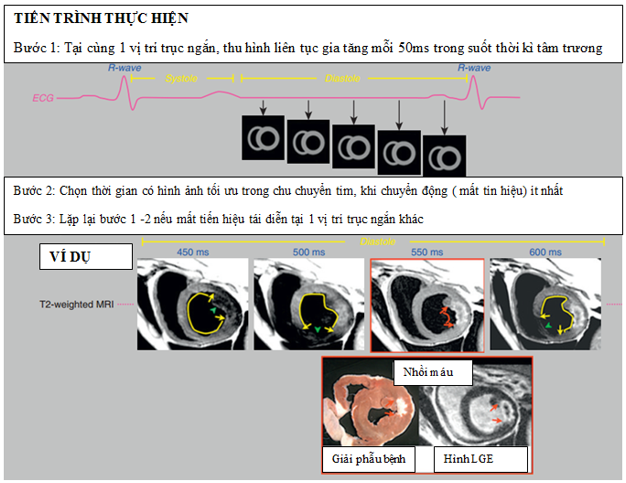
Hình 13: Tiến trình thu hình T2W
- Hình ảnh LGE với gadolinium trong giai đoạn sớm của NMCT:
Từ giữa thập niên 90, Kim và Judd đã phát hiện ra hình tăng tín hiệu muộn. Sau đó, trong thời gian ngắn, LGE được sử dụng rộng rãi do đơn giản, chất lượng hình ảnh tốt, độ phân giải cao cho phép phân biệt rõ ràng giữa mức độ xuyên thành của vùng hoại tử và sẹo. Đa số các trung tâm đều sử dụng chuỗi xung đảo ngược T1W (IR: inversion recovery) và thu hình ở giữa kì tâm trương khi chuyển động tim ít nhất. Thời gian bắt đầu tiên thuốc tương phản đến lúc thu hình rất quan trọng, để bộc lộ rõ rệt sự thay đổi nồng độ thuốc và tín hiệu khác nhau giữa các vùng. Ở cơ tim bình thường, thời gian thấm nhập và rửa trôi thuốc tương phản hằng định khoảng 2- 3 phút. Trong nhồi máu cơ tim, tại những vùng “tranh tối tranh sáng” (gray zone), do kéo dài thời gian wash-in và wash-out so với cơ tim bình thường, lõi (core) và rìa ( border) của vùng nhồi máu đều đen trong quá trình wash-in. Sau đó, vùng lõi nhồi máu và các cơ tim xung quanh đồng tín hiệu, nhưng vùng xám “gray zone” thì tín hiệu tăng. Sau 10 phút tiêm thuốc tương phản, do nồng độ thuốc đã rửa trôi hoàn toàn ở vùng cơ tim bình thường, tuy nhiên tại vùng nhồi máu sẽ có tăng tín hiệu muộn. Và sau đó, tại lõi nhồi máu tình trạng tăng tín hiệu sẽ kéo dài, trong khi vùng rìa (vùng xám) tín hiệu cơ tim sẽ giản dần và trở về gần như bình thường ( hình14)
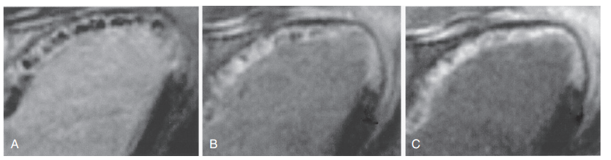
Hình 14: Đánh giá sống – còn cơ tim trên hình LGE sau NMCT cấp.8
Hình ảnh của BN nhồi máu cơ tim thành trước can thiệp 1 stent LAD. Chụp CMR sau can thiệp đánh giá sống còn cơ tim trên hình LGE. Đây là hình LGE tại vị trí 3 buồng; Hình A: sau tiên thuốc tương phản 2 phút, B: sau 10 phút, C: sau 30 phút.
- Hiện tượng không có dòng chảy (No- reflow)8
Trên hình CMR của những trường hợp nhồi máu cơ tim cấp tính, đôi khi chúng ta sẽ gặp trường hợp vùng trung tâm giảm tín hiệu (low intensity) bao quanh bởi “vùng sáng” điển hình của hoại tử cơ tim. Ở tại trung tâm vùng nhồi máu, do tình trạng thiếu máu cục bộ nặng và kéo dài các tế bào và mao mạch có thể đồng thời cùng bị hoại tử. Quá trình này dẫn đến sự chết tế bào và hồng cầu gây nên tình trạng tắc nghẽn trong các vi mạch. Vì vậy, sau đó dù có tiến hành tái tưới máu các mạch máu thượng tâm mạc, thì lõi nhồi máu cũng không hồi phục. Vùng tắc nghẽn vi mạch này gọi là “vùng không có dòng chảy” (no – reflow region). Tắc nghẽn vi mạch sau nhồi máu cơ tim cấp tỉ lệ với tổn thương cơ tim và chức năng co bóp thất trái trong giai đoạn sớm của nhồi máu. Vùng giảm tín hiệu trên hình CMR ngay sau khi tiêm thuốc cản quang 2-3 phút chính là “vùng không có dòng chảy”. Ở nhiều nghiên cứu khác nhau, “vùng không có dòng chảy” là yếu tố tiên lượng độc lập về thể tích thất trái sau 10 ngày sau tái tưới máu. Wu và cộng sự nghiên cứu trên 44 bệnh nhân nhồi máu cơ tim được tiêu sợi huyết hoặc PCI tiên phát, sau đó khảo sát bẳng CMR và theo dõi trong 6 tháng. Kết quả ghi nhận, nhóm có hiện tượng “không có dòng chảy” làm tăng nguy cơ xuất hiện biền cố nhiều gấp 5 lần so với nhóm còn lại (p= 0,02).
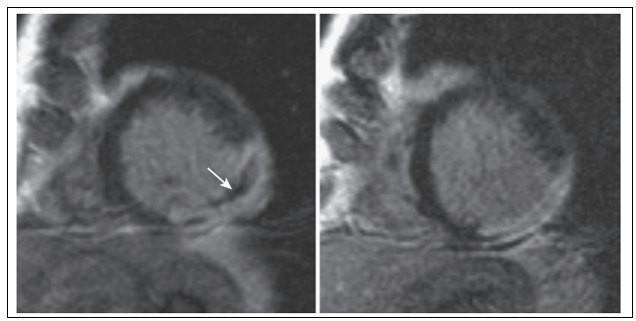
Hình 15: Hiện tượng “không có dòng chảy”
Vùng lõi trung tâm giảm tín hiệu bao quanh bởi vùng sáng điển hình của nhồi máu.
- Bề dày thành tim
Sau nhồi máu cơ tim, vùng cơ tim hoại tử thay đổi cấu trúc. Quá trình làm lành và tái cấu trúc cũng như sẹo hóa cơ tim có thể kéo dài đến 4 tháng. Cơ tim bị mỏng có thể diễn ra sớm sau nhồi máu, nhất là những trường hợp nhồi máu diện rộng, tuy nhiên tình trạng “cơ tim dày lên” thoáng qua do tình trạng phù nề cơ tim cũng được ghi nhận. Ở nhồi máu cơ tim xuyên thành hay không xuyên thành đều ghi nhận có tình trạng dày cơ tim thoáng qua trong giai đoạn nhồi máu cấp, và nếu tái thông sớm, tình trạng này sẽ thoái lui.
3.4. Đánh giá sống còn cơ tim trong bệnh mạch vành mạn
Các phương pháp CMR đánh giá sống còn cơ tim bao gồm: trắc nghiệm dobutamine liều thấp (low-dose dobutamine test) ( đánh giá chức năng), đánh giá sẹo cơ tim trên hình tăng tín hiệu muộn (LGE), và phối hợp cả 2 phương pháp2
- Phương pháp đánh giá
Có nhiều phương pháp đánh giá với các ưu nhược điểm khác nhau trong khảo sát sống còn cơ tim bằng Dobutamine (bảng 6).
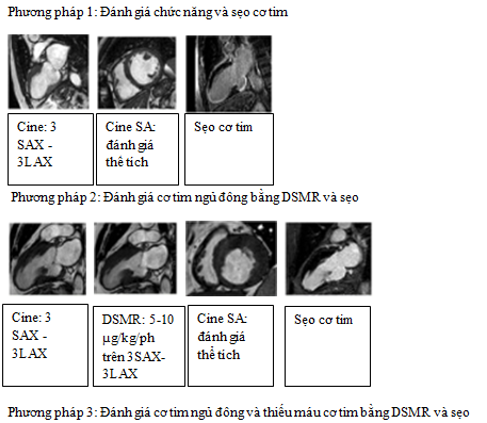
Bảng 6: Giá trị của các phương pháp khảo sát sống còn cơ tim bằng dobutamin
| Phương pháp | EF | Sẹo | Sống – còn
(cơ tim ngủ đông) |
Thiếu máu cục bộ cơ tim |
| Phương pháp 1 | ++ | ++ | – | – |
| Phương pháp 2 | ++ | ++ | + | – |
| Phương pháp 3 | ++ | ++ | ++ | ? |
| Phương pháp 4 | ++ | ++ | ++ | ? |
- Đánh giá bằng trắc nghiệm Dobutamine liều thấp
Dobutamine đầu tiên được sử dụng kết hợp với siêu âm tim trong đánh giá sống còn cơ tim dựa trên hồi phục chức năng co bóp dưới dobutamine liều thấp. Dendale và cộng sự sau đó đã chứng minh sử dụng CMR với Dobutamine liều thấp (LD-CMR) là một chọn lựa thay thế. Tác giả chỉ ra rằng LD-CMR có thể chỉ định sau nhồi máu cơ tim tuần thứ 2 trên bệnh nhân nhồi máu cơ tim cấp không biến chứng. Khi so sánh với siêu âm dobutamine (DSE), 2 phương pháp có kết quả gần tương đương nhau trong đánh giá dự trữ co bóp: 79% với DCMR và 83% DSE. Sau đó, tác giả Saito và cộng sự thực hiện nghiên cứu so sánh giá trị co bóp dự trự của DSE và DCMR bằng phương pháp định lượng. Kết quả cho thấy, DCMR vượt trội hơn so với DSE, với độ nhạy lần lượt là: 75.9% và 65.5%, và độ chính xác lần lượt là 78% và 72%. Tác giả Sayad và cộng sự đánh giá sống còn cơ tim trên 10 bệnh nhân nguy cơ cao bằng DCMR và sau đó chụp mạch vành29. Kết quả cho thấy, độ nhạy và độ đặc hiệu của DCMR là 89% và 93%, trong đó, giá trị tiên đoán âm là 82% , giá trị tiên đoán dương là 96%.
Bên cạnh khảo sát tính sống còn, DCMR còn có khả năng khảo sát cơ tim “ngủ đông”. Chúng ta biết rằng, với Dobutamine liều thấp có thể khảo sát chức năng co bóp dự trữ của cơ tim, và ở liều cao sẽ đánh giá thiếu máu cục bộ. Với cơ tim ngủ đông, chúng ta sẽ có đáp ứng 2 pha (biphasic response) với dobutamine, đó là: tăng co bóp dưới dobutamine liều thấp và bất thường vận động xấu đi dưới dobutamine liều cao. Tác giả Wellnhofer và cộng sự nghiên cứu trên 29 bệnh nhân mắc bệnh động mạch vành, cho thấy LD-CMR ưu thế hơn so với LGE trong đánh giá sống còn cơ tim30. Bởi vì LGE chỉ đánh giá độ xơ hóa, sẹo cơ tim (cơ tim chết). Trong khi đó, LD-CMR khảo sát được chức năng của các vùng cơ tim lân cận (hibernating).
- Đánh giá sẹo cơ tim trên LGE
Trong y văn, các tác giả đã nhấn mạnh vai trò quan trọng của mức độ xuyên thành trong đánh giá cơ tim còn sống. Năm 2004, nghiên cứu của Kim và cộng sự trên 50 bệnh nhân bệnh mạch cành chuẩn bị PCI hoặc phẫu thuật CABG29. Theo tác giả, nhồi máu cơ tim có thể phần nào liên quan đến bề dày thành cơ tim, do đó, dựa vào mức độ xuyên thành có thể dự đoán hồi phục chức năng co bóp của cơ tim sau tái tưới máu. Tất cả bệnh nhân đều được chụp MRI với gadolinium trước và sau can thiệp. Kết quả nghiên cứu đã chứng minh mức độ xuyên thành của vùng nhồi máu có thể giúp đánh giá hiệu quả tái thông dựa trên sự phục hồi chức năng co bóp sau điều trị tái thông. Mức độ xuyên thành được chia làm 4 nhóm: 0-25, 25-50, 50-75 và 75- 100. Có sự khác biệt có ý nghĩa thống kê giữa 2 nhóm < 50% và > 50%. Các tác giả đã kết luận, tái thông mạch vành chỉ nên thực hiện khi mức độ xuyên thành < 50% do chức năng co bóp sẽ hồi phục sau điều trị tái thông.
Ngoài ra, CMR làm thay đổi cách nhìn của chúng ta về thành mỏng (wall thining) trong cơ tim ngủ đông. Đây là hệ quả của tổn thương mạn tính sau nhồi máu cơ tim. Các giả thuyết về sinh lý bệnh của bề dày thành tim mỏng, bao gồm sự trượt của các bó cơ, sự tái cấu trúc cơ tim trong quá trình chữa lành sau nhồi máu, tạo cơ sở cho kết luận thành tim mỏng trong nhồi máu xuyên thành là vùng cơ tim không còn sống. Mặc dù giả thuyết là vậy, nhưng thực tế lâm sàng vẫn có báo cáo nhiều trường hợp cơ tim mỏng đi sau tái cấu trúc vẫn còn sống. Kim và Shal có báo cáo ca lâm sàng, bề dày thành trước cuối thì tâm trương chỉ có 5mm, nhưng trên hình LGE vùng sẹo chỉ có 1.5mm, và vùng cơ tim này còn sống 29. Gần đây, một nghiên cứu đa trung tâm của Shal và cộng sự quan sát trên 1050 bệnh nhân mắc bệnh mạch vành thực hiện LGE CMR 30. Kết quả ghi nhận 201 bệnh nhân (19%) có mỏng thành tim, trong số đó 72% có sẹo trên hình LGE, nhưng có đến 18% là sẹo giới hạn <50% bề dày thành. Sau đó, có 42 bệnh nhân được can thiệp tái thông và theo dõi bằng CMR. Kết quả sau những phân tích gộp cho thấy, mức độ tổn thương lan tỏa của sẹo liên quan tỉ lệ nghịch với cải thiện co bóp và hồi phục thành tim (p <0,001). Và những vùng cơ tim mỏng nhưng mức độ sẹo giới hạn <50% bề dày thành thì đều hồi phục bề dầy sau tái tưới máu với: bề dày thành thất trái cuối tâm trương trung bình tăng từ 4.4mm (CI 4.1 – 4.7) thành 7.5mm ( CI 6.9 – 8.1mm). Nghiên cứu này cho thấy thành tim mỏng vẫn có thể hồi phục sau tái tưới máu cũng như vai trò quan trọng của đánh giá sống còn cơ tim bằng LGE.
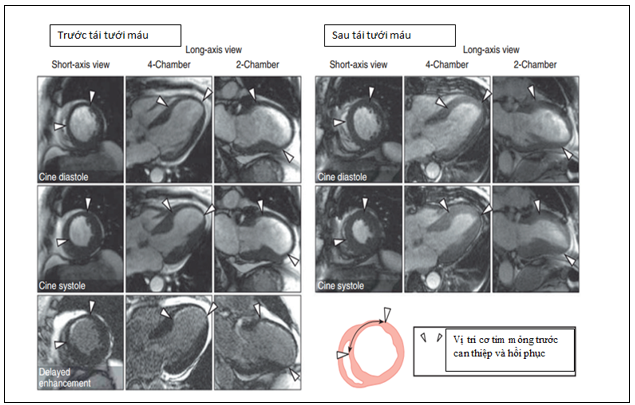
Hình 16: Đánh giá sống còn cơ tim bằng LGE và hồi phục sau tái tưới máu8
(Bệnh nhân NMCT có sẹo dưới nội mạc và thành mỏng, giảm động thành trước vách, thành trước và vùng mỏm). Hình LGE ghi nhận sẹo với mức xuyên thành < 50%. Sau can thiệp ghi nhận cơ tim hồi phục co bóp. Bề dày thành cơ tim cuối tâm thu tăng từ 4.5 mm đến 9.5mm
4. KẾT LUẬN:
Hiện nay, dựa vào hướng dẫn và đồng thuận của các hội tim mạch mạch Châu Âu và Hoa Kỳ, chẩn đoán bệnh động mạch vành bằng các phương tiện chẩn đoán hình ảnh không xâm lấn được khuyến cáo mạnh. Trong đó, DCMR và tưới máu cơ tim là một trong những kĩ thuật đáng tin cậy trong chẩn đoán, phát hiện bệnh tim thiếu máu cục bộ. Mặc dù giá thành cao hơn các phương pháp khác, nhưng ưu điểm của CMR là an toàn, không tiếp xúc tia xạ, tính lặp lại cao. Bên cạnh đó sự phát triển của hình ảnh tăng tín hiệu muộn đã tạo bước ngoặt trong đánh giá sống còn cơ tim. Nhờ đó, giúp giảm thiểu các can thiệp tái tưới máu không cần thiết cho bệnh nhân.
TÀI LIỆU THAM KHẢO
- Hendel RC, Friedrich MG, Schulz-Menger J, et al. CMR first-pass perfusion for suspected inducible myocardial ischemia. JACC: Cardiovascular imaging. 2016;9(11):1338-1348.
- Morton G, Schuster A, Perera D, Nagel E. Cardiac magnetic resonance imaging to guide complex revascularization in stable coronary artery disease. European heart journal. 2010;31(18):2209-2215.
- Pohost GM. The history of cardiovascular magnetic resonance. JACC: Cardiovascular Imaging. 2008;1(5):672-678.
- Kim RJ, Wu E, Rafael A, et al. The use of contrast-enhanced magnetic resonance imaging to identify reversible myocardial dysfunction. New England Journal of Medicine. 2000;343(20):1445-1453.
- Vrints C, Andreotti F, Koskinas KC, et al. 2024 ESC guidelines for the management of chronic coronary syndromes: developed by the task force for the management of chronic coronary syndromes of the European Society of Cardiology (ESC) endorsed by the European Association for Cardio-Thoracic Surgery (EACTS). European heart journal. 2024;45(36):3415-3537.
- Members WC, Gulati M, Levy PD, et al. 2021 AHA/ACC/ASE/CHEST/SAEM/SCCT/SCMR guideline for the evaluation and diagnosis of chest pain: executive summary: a report of the American college of cardiology/American heart association joint committee on clinical practice guidelines. Journal of the American College of Cardiology. 2021;78(22):2218-2261.
- Wolk MJ, Bailey SR, Doherty JU, et al. ACCF/AHA/ASE/ASNC/HFSA/HRS/SCAI/SCCT/SCMR/STS 2013 multimodality appropriate use criteria for the detection and risk assessment of stable ischemic heart disease: a report of the American College of Cardiology foundation appropriate use criteria task force, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic Resonance, and Society of Thoracic Surgeons. Journal of the American College of Cardiology. 2014;63(4):380-406.
- Warren J Manning DJP. Elsevier, ed. “Cardiovascular Magnetic Resonace, A companison to Braunwald’s Heart Disease”. 2019.
- Nagel E, Lehmkuhl HB, Bocksch W, et al. Noninvasive diagnosis of ischemia-induced wall motion abnormalities with the use of high-dose dobutamine stress MRI: comparison with dobutamine stress echocardiography. Circulation. 1999;99(6):763-770.
- Pennell DJ, Underwood SR, Manzara CC, et al. Magnetic resonance imaging during dobutamine stress in coronary artery disease. The American journal of cardiology. 1992;70(1):34-40.
- Baer F, Theissen P, Smolarz K, et al. Dobutamine versus dipyridamole magnetic resonance tomography: Safety and sensitivity in the detection of coronary stenoses. Zeitschrift fur Kardiologie. 1993;82(8):494-503.
- Van Rugge FP, Van Der Wall EE, Spanjersberg SJ, et al. Magnetic resonance imaging during dobutamine stress for detection and localization of coronary artery disease. Quantitative wall motion analysis using a modification of the centerline method. Circulation. 1994;90(1):127-138.
- Hundley WG, Hamilton CA, Thomas MS, et al. Utility of fast cine magnetic resonance imaging and display for the detection of myocardial ischemia in patients not well suited for second harmonic stress echocardiography. Circulation. 1999;100(16):1697-1702.
- Wahl A, Paetsch I, Roethemeyer S, Klein C, Fleck E, Nagel E. High-dose dobutamine-atropine stress cardiovascular MR imaging after coronary revascularization in patients with wall motion abnormalities at rest. Radiology. 2004;233(1):210-216.
- Schneeweis C, Qiu J, Schnackenburg B, et al. Value of additional strain analysis with feature tracking in dobutamine stress cardiovascular magnetic resonance for detecting coronary artery disease. Journal of Cardiovascular Magnetic Resonance. 2014;16(1):72.
- Hundley WG, Morgan TM, Neagle CM, Hamilton CA, Rerkpattanapipat P, Link KM. Magnetic resonance imaging determination of cardiac prognosis. Circulation. 2002;106(18):2328-2333.
- Abebe W, Makujina SR, Mustafa SJ. Adenosine receptor-mediated relaxation of porcine coronary artery in presence and absence of endothelium. American Journal of Physiology-Heart and Circulatory Physiology. 1994;266(5):H2018-H2025.
- Mustafa S, Askar A. Evidence suggesting an Ra-type adenosine receptor in bovine coronary arteries. Journal of Pharmacology and Experimental Therapeutics. 1985;232(1):49-56.
- Iskandrian A. Myocardial ischemia during pharmacological stress testing. Circulation. 1993;87(4):1415-1417.
- Sakuma H, Suzawa N, Ichikawa Y, et al. Diagnostic accuracy of stress first-pass contrast-enhanced myocardial perfusion MRI compared with stress myocardial perfusion scintigraphy. American Journal of Roentgenology. 2005;185(1):95-102.
- Greenwood JP, Maredia N, Younger JF, et al. Cardiovascular magnetic resonance and single-photon emission computed tomography for diagnosis of coronary heart disease (CE-MARC): a prospective trial. The Lancet. 2012;379(9814):453-460.
- Schwitter J, Wacker C, Wilke N, Al-Saadi N, Hoebel N, Simor T. Magnetic resonance imaging for myocardial perfusion assessment in coronary artery disease trial (MR-IMPACT II): A phase III multicenter, multivendor trial comparing perfusion cardiac magnetic resonance versus single photon emission computed tomography for the detection of coronary artery disease. Am Heart Assoc; 2006.
- Giang T, Nanz D, Coulden R, et al. Detection of coronary artery disease by magnetic resonance myocardial perfusion imaging with various contrast medium doses: first European multi-centre experience. European heart journal. 2004;25(18):1657-1665.
- Bettencourt N, Chiribiri A, Schuster A, et al. Cardiac magnetic resonance myocardial perfusion imaging for detection of functionally significant obstructive coronary artery disease: a prospective study. International journal of cardiology. 2013;168(2):765-773.
- Watkins S, McGeoch R, Lyne J, et al. CLINICAL PERSPECTIVE. Circulation. 2009;120(22):2207-2213.
- Jose Luis Zomarano JB, Eike Nagel. edition, ed. The ESC textbook of Cardiovascular Imaging. 2015.
- Meijboom WB, Van Mieghem CA, van Pelt N, et al. Comprehensive assessment of coronary artery stenoses: computed tomography coronary angiography versus conventional coronary angiography and correlation with fractional flow reserve in patients with stable angina. Journal of the American College of Cardiology. 2008;52(8):636-643.
- Silber S, Albertsson P, Avilés FF, et al. Guidelines for percutaneous coronary interventions: the Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. European heart journal. 2005;26(8):804-847.
- Kim R, Shah D. Fundamental concepts in myocardial viability assessment revisited: when knowing how much is “alive” is not enough. Heart. 2004;90(2):137-140.
- Shah DJ, Kim HW, James O, et al. Prevalence of regional myocardial thinning and relationship with myocardial scarring in patients with coronary artery disease. Jama. 2013;309(9):909-918.







