TRỊNH NGỌC THẠNH1
HOÀNG VĂN SỸ1,2
1 Khoa Nội Tim mạch, Bệnh viện Chợ Rẫy, TP. Hồ Chí Minh
2 Bộ môn Nội Tổng quát, Đại học Y Dược TP. Hồ Chí Minh
TÓM TẮT:
Việc sử dụng thuốc kháng đông ở bệnh nhân hồi sức tích cực đặt ra nhiều thách thức do sự phức tạp trong tình trạng bệnh, sự biến thiên dược động học – dược lực học, cùng nguy cơ cao chảy máu và huyết khối. Các khuyến cáo hiện hành thường không đầy đủ hoặc đôi khi không phù hợp để áp dụng cho các bệnh nhân đặc biệt này. Do đó, tiếp cận cá thể hóa trong điều trị kháng đông đang được quan tâm nhằm tối ưu hóa hiệu quả điều trị và hạn chế tác dụng bất lợi. Nhà lâm sàng cần hiểu được các nguyên tắc và chiến lược trong xây dựng kế hoạch điều trị kháng đông dựa trên cá thể hóa, bao gồm lựa chọn thuốc, liều dùng, cách theo dõi và điều chỉnh liều theo diễn tiến lâm sàng. Các yếu tố ảnh hưởng như tình trạng suy cơ quan, tương tác thuốc – bệnh, hiện diện của thiết bị hỗ trợ tuần hoàn, thay đổi huyết động học và yếu tố di truyền đều được phân tích để cá thể hóa phác đồ điều trị. Ngoài ra, luôn có vai trò quan trọng của các công cụ đánh giá nguy cơ, xét nghiệm cận lâm sàng đặc hiệu và sự phối hợp đa chuyên khoa trong việc xây dựng và cập nhật kế hoạch điều trị. Cách tiếp cận dựa trên cá thể hóa này nhằm giảm thiểu biến chứng liên quan đến thuốc kháng đông và hướng đến kết cục lâm sàng tốt hơn cho bệnh nhân hồi sức tích cực.
Từ khoá: Tiếp cận cá thể hóa, thuốc kháng đông, hồi sức tích cực.
1. ĐẶT VẤN ĐỀ
Thuốc kháng đông là nhóm thuốc thiết yếu trong điều trị và phòng ngừa huyết khối ở bệnh nhân nội khoa và phẫu thuật, đặc biệt là tại các đơn vị hồi sức tích cực. Tuy nhiên, việc sử dụng thuốc kháng đông ở nhóm bệnh nhân này đặt ra nhiều thách thức do sự phức tạp về bệnh lý nền, thay đổi sinh lý bệnh cấp tính và biến thiên lớn trong đáp ứng thuốc giữa các cá thể. Các yếu tố như suy đa cơ quan, sự hiện diện của các thiết bị hỗ trợ tuần hoàn cơ học, tương tác thuốc, cũng như đặc điểm di truyền đều ảnh hưởng đến hiệu quả và tính an toàn của liệu pháp kháng đông. Trong bối cảnh đó, nhiều nghiên cứu đã chỉ ra rằng các hướng dẫn điều trị hiện hành, vốn được xây dựng từ các thử nghiệm lâm sàng với tiêu chí chọn bệnh nhân nghiêm ngặt, thường không áp dụng được toàn diện cho quần thể bệnh nhân nặng vốn rất đa dạng và thường bị loại trừ khỏi các nghiên cứu gốc [1].
Tình trạng chảy máu, huyết khối hoặc các phản ứng bất lợi không dự đoán được như giảm tiểu cầu do heparin (HIT) tiếp tục là những nguyên nhân hàng đầu gây biến chứng nghiêm trọng liên quan đến thuốc kháng đông. Các biến cố này thường xảy ra ở giai đoạn đầu điều trị và có thể gây hậu quả nghiêm trọng nếu không được theo dõi và điều chỉnh kịp thời. Do đó, xu hướng cá thể hóa điều trị – tức xây dựng kế hoạch dùng thuốc dựa trên đặc điểm riêng của từng bệnh nhân – đang được chú trọng, với mục tiêu cân bằng giữa hiệu quả chống huyết khối và nguy cơ chảy máu. Tiếp cận này bao gồm lựa chọn loại thuốc, liều lượng, khoảng cách liều và chiến lược theo dõi phù hợp với các yếu tố như đặc điểm di truyền, cân nặng, tuổi, chức năng gan thận, mức độ đáp ứng với thuốc, cũng như các bệnh lý đi kèm [2]. Trong bối cảnh chi phí y tế ngày càng tăng, các biến chứng do thuốc ngày càng được quan tâm và mục tiêu tối ưu hóa kết cục lâm sàng ngày càng được chú trọng, việc áp dụng tiếp cận cá thể hóa trong quản lý điều trị thuốc kháng đông ở bệnh nhân hồi sức tích cực là một xu hướng tất yếu.
2. TIẾP CẬN CÁ THỂ HÓA: NGUYÊN TẮC VÀ CHIẾN LƯỢC
Chiến lược cá thể hóa trong điều trị thuốc kháng đông cho bệnh nhân hồi sức tích cực được xây dựng trên nền tảng nhận thức rằng mỗi cá thể là một hệ sinh học riêng biệt với các đặc điểm di truyền, sinh lý bệnh và hoàn cảnh lâm sàng khác nhau. Nguyên tắc cốt lõi đầu tiên của tiếp cận cá thể hóa là không áp dụng một mô hình điều trị chuẩn hóa cho tất cả bệnh nhân, đặc biệt trong môi trường hồi sức, vốn là nơi các yếu tố sinh lý học thay đổi theo từng giờ và bệnh nhân thường không phù hợp với các tiêu chí của các thử nghiệm lâm sàng vốn được dùng để xây dựng hướng dẫn hiện hành. Các nghiên cứu đã cho thấy rằng đa số bệnh nhân nặng thường bị loại trừ khỏi các nghiên cứu kiểm chứng hiệu quả kháng đông do họ có nguy cơ cao chảy máu, tổn thương đa cơ quan, hoặc cần can thiệp thủ thuật khẩn cấp, trong khi chính nhóm này lại có tỷ lệ huyết khối và biến chứng cao nhất. Nguyên tắc cá thể hóa đòi hỏi bác sĩ phải thường xuyên đánh giá và điều chỉnh kế hoạch điều trị theo thời gian thực. Bệnh nhân hồi sức thường có cửa sổ điều trị hẹp, trong đó chỉ một sự sai lệch nhỏ về liều hoặc lựa chọn thuốc cũng có thể dẫn đến biến chứng nghiêm trọng như chảy máu đe dọa tính mạng hoặc thuyên tắc huyết khối tiến triển. Do đó, thay vì áp dụng cố định một phác đồ, bác sĩ cần xem xét liên tục các yếu tố như chức năng gan thận, chỉ số huyết học, dấu hiệu sinh tồn, diễn tiến viêm và đáp ứng với thuốc – từ đó cập nhật lộ trình điều trị phù hợp. Sự thay đổi này không chỉ dựa trên xét nghiệm đông máu truyền thống mà còn cần đến các chỉ số chuyên biệt như anti-Xa, thrombin time, hoặc các kỹ thuật đánh giá huyết động và đông máu động như đo độ đàn hồi huyết khối [1, 3].
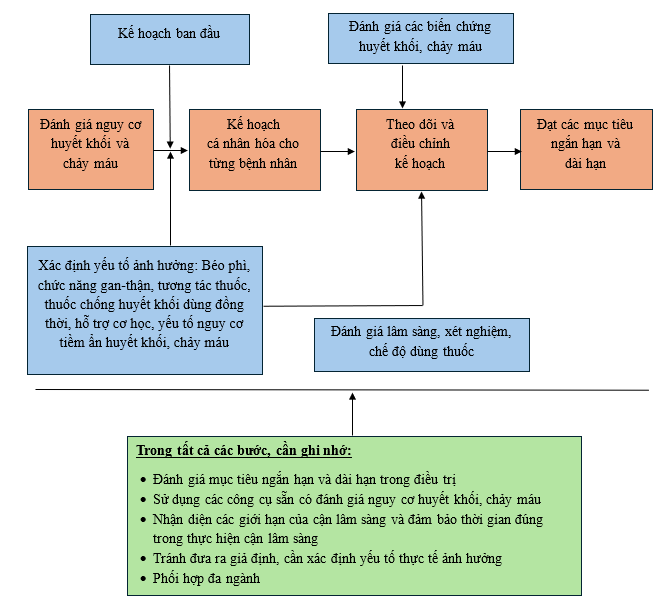
Tiếp cận cá thể hóa cần đặt bệnh nhân vào bối cảnh đa yếu tố. Bệnh nhân không chỉ khác nhau về mặt sinh học mà còn về tình trạng bệnh nền, tương tác thuốc, yếu tố di truyền và khả năng dung nạp thuốc. Những yếu tố như đột biến gen VKORC1, CYP2C9 hoặc CES1 ảnh hưởng đến chuyển hóa và đáp ứng với warfarin hoặc dabigatran là ví dụ tiêu biểu cho việc biến thể di truyền có thể tạo ra khác biệt đáng kể trong nhu cầu liều và nguy cơ biến chứng giữa các cá thể. Các yếu tố môi trường như chế độ ăn, hút thuốc, sử dụng thuốc đồng thời (như amiodarone, rifampin, thuốc ức chế P-glycoprotein), cũng cần được tích hợp vào quy trình đánh giá toàn diện này [2]. Nguyên tắc nền tảng không thể thiếu trong cá thể hóa điều trị là sự phối hợp liên chuyên khoa và minh bạch trong ra quyết định lâm sàng. Bác sĩ lâm sàng, dược sĩ lâm sàng, chuyên gia huyết học, và điều dưỡng hồi sức cần cùng tham gia vào quá trình xây dựng và theo dõi kế hoạch điều trị. Mỗi sự thay đổi trong thuốc, liều, thời điểm ngưng hoặc đảo ngược tác dụng kháng đông cần được cân nhắc kỹ lưỡng, đặc biệt là khi người bệnh có nguy cơ tiến hành thủ thuật xâm lấn hoặc có dấu hiệu xuất huyết. Giao tiếp hiệu quả giữa các thành viên trong nhóm chăm sóc là điều kiện bắt buộc để duy trì an toàn điều trị. Việc chủ động ghi nhận diễn tiến lâm sàng và phản hồi kịp thời giữa các chuyên khoa giúp hạn chế sai sót do định kiến chủ quan hoặc thiếu thông tin, đồng thời tạo nền tảng cho quy trình cá thể hóa điều trị trở nên linh hoạt và thích ứng với thực tiễn [1].
3. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CHIẾN LƯỢC CÁ THỂ HÓA QUẢN LÝ THUỐC KHÁNG ĐÔNG
Chiến lược cá thể hóa trong điều trị thuốc kháng đông cho bệnh nhân hồi sức tích cực phải đối mặt với nhiều yếu tố tác động đồng thời và biến thiên liên tục trong quá trình chăm sóc. Những yếu tố này ảnh hưởng đến sự lựa chọn thuốc, liều dùng, cách theo dõi và thời điểm điều chỉnh. Yếu tố đầu tiên và quan trọng nhất là chức năng cơ quan, đặc biệt là gan và thận – hai cơ quan giữ vai trò chính trong chuyển hóa và thải trừ thuốc kháng đông. Bệnh nhân suy gan có thể giảm tổng hợp các yếu tố đông máu, thay đổi gắn kết protein huyết tương, trong khi bệnh nhân suy thận có thể giảm thải trừ các thuốc như enoxaparin, fondaparinux, dabigatran hoặc rivaroxaban, dẫn đến tích lũy thuốc và tăng nguy cơ xuất huyết. Bên cạnh đó, thay đổi về huyết động học, toan chuyển hóa, hội chứng viêm toàn thân hoặc tình trạng tăng tính thấm mao mạch cũng có thể ảnh hưởng đến thể tích phân bố và dược động học của thuốc. Yếu tố di truyền học cũng góp phần đáng kể trong biến thiên đáp ứng thuốc giữa các cá thể. Các biến thể gen như VKORC1 và CYP2C9 ảnh hưởng đến liều warfarin cần thiết và tăng nguy cơ chảy máu trong giai đoạn đầu điều trị. Gen CES1 và ABCB1 đã được chứng minh ảnh hưởng đến nồng độ đỉnh và đáy của dabigatran, trong khi đó sự hiện diện của các yếu tố như CYP3A4, P-glycoprotein có thể làm thay đổi sinh khả dụng của các thuốc kháng đông đường uống tác động trực tiếp. Trong khi ứng dụng lâm sàng của dược lý học di truyền còn đang phát triển, thì việc ghi nhận tiền sử đáp ứng thuốc hoặc biến cố chảy máu của người bệnh vẫn là chỉ dấu lâm sàng quan trọng để định hướng cá thể hóa kế hoạch điều trị [1, 2].
Các yếu tố liên quan đến bệnh lý cấp tính và thiết bị can thiệp cũng cần được lưu ý. Bệnh nhân có lọc máu liên tục, oxy hóa máu bằng màng ngoài cơ thể (ECMO), Impella hoặc các dụng cụ cơ học khác đều có nguy cơ tạo dòng chảy hỗn loạn, tổn thương nội mô và gây ra những rối loạn đông máu đặc trưng. Các thiết bị này không chỉ làm thay đổi mức tiêu thụ hoặc gắn kết thuốc, mà còn gây rối loạn đông máu nội sinh, đòi hỏi bác sĩ phải liên tục điều chỉnh liều và loại thuốc kháng đông theo diễn tiến bệnh. Những biến đổi này thường không được đề cập trong các khuyến cáo điều trị thông thường, vì vậy việc theo dõi sát tình trạng lâm sàng và sử dụng các công cụ đánh giá đông máu động là quan trọng. Các yếu tố liên quan đến tương tác thuốc – thuốc và thuốc – bệnh cũng cần được cân nhắc kỹ lưỡng. Nhiều bệnh nhân hồi sức tích cực được dùng đồng thời nhiều loại thuốc có khả năng tương tác làm thay đổi hấp thu, chuyển hóa hoặc thải trừ thuốc kháng đông, chẳng hạn như thuốc kháng sinh, thuốc kháng nấm, thuốc vận mạch, corticoid hoặc các thuốc ảnh hưởng đến enzym chuyển hóa tại gan. Bên cạnh đó, các yếu tố môi trường như chế độ ăn uống, sử dụng thảo dược, hút thuốc lá cũng có thể làm thay đổi đáp ứng thuốc một cách khó dự đoán. Do đó, một chiến lược cá thể hóa hiệu quả cần phải có cơ chế đánh giá thường xuyên và tích hợp được tất cả các yếu tố này vào quy trình ra quyết định điều trị [1, 2].
Enoxaparin, một heparin trọng lượng phân tử thấp (LMWH), là một trong những thuốc kháng đông được sử dụng rộng rãi nhất để điều trị và phòng ngừa huyết khối ở bệnh nhân nội khoa và phẫu thuật. Một xu hướng đang tăng lên hiện nay là việc sử dụng các liệu pháp sinh học tương đương (biosimilar), nhờ vào hiệu quả tương đương, đảm bảo an toàn và chi phí thấp hơn, giúp tối ưu hóa chi phí, tăng khả năng tiếp cận của bệnh nhân, enoxaparin biosimilar cũng không phải là ngoại lệ. Trong xu hướng mở rộng tiếp cận điều trị kháng đông hiệu quả, các biosimilar enoxaparin như Chemi enoxaparin (enoxaparin biosimilar hiện có tại Việt Nam) đã được nghiên cứu về tính tương đương dược lực học với biệt dược gốc. Một nghiên cứu lâm sàng ngẫu nhiên, bắt chéo, nhãn mở do Febbraro và cộng sự (2021) thực hiện đã so sánh sinh khả dụng của Chemi enoxaparin (80 mg/0.8 mL) với enoxaparin phát minh (Clexane® 80 mg/0.8 mL) ở người tình nguyện khỏe mạnh. Đây là nghiên cứu được thiết kế phù hợp với khuyến cáo của cơ quan dược phẩm châu Âu để chứng minh tính tương đương sinh học của các thuốc LMWH. Nghiên cứu đánh giá dược lực học qua hoạt tính anti-Xa. Kết quả nghiên cứu cho thấy: Về anti-Xa, Cmax đạt 0,840 IU/mL (Chemi) so với 0,845 IU/mL (Clexane); tỉ lệ trung bình tối thiểu Cmax: 99,42% (95% CI: 96,28–102,65%); AUC0–t: 9,484 với 9,218 h×IU/mL; tỉ lệ trung bình tối thiểu AUC0–t: 102,89% (95% CI: 100,67–105,15%). Các thông số trên nằm trong ngưỡng tương đương sinh học do cơ quan dược phẩm châu Âu quy định (80–125%) [4].
4. CÁC CÔNG CỤ ĐÁNH GIÁ
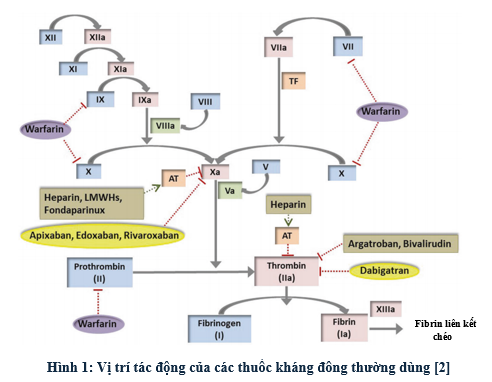
Hiểu được cơ chế tác động của các thuốc kháng đông là cơ sở cho việc chọn công cụ đánh giá hiệu quả của thuốc. Hình 1 thể hiện vị trí tác động của các thuốc kháng đông thường dùng. Công cụ cổ điển đầu tiên được sử dụng rộng rãi là PT (Prothrombin time) và INR (International Normalized Ratio). Đây là phương pháp tiêu chuẩn để theo dõi điều trị bằng thuốc kháng vitamin K như warfarin. Tuy nhiên, INR có thể bị ảnh hưởng bởi nhiều yếu tố như chế độ ăn, bệnh gan, các thuốc dùng kèm và yếu tố di truyền như đột biến VKORC1, CYP2C9, từ đó gây ra sự biến thiên lớn giữa các cá thể. Mặc dù các thang điểm như SAMe-TT2R2 giúp tiên lượng khả năng kiểm soát INR, chúng vẫn chưa thể thay thế việc theo dõi liên tục bằng xét nghiệm đông máu trong giai đoạn khởi trị hoặc khi có yếu tố nguy cơ thay đổi [2]. Mục tiêu INR là 2-3 trong đa phần các chỉ định điều trị thuyên tắc huyết khối tĩnh mạch, dự phòng đột quỵ do rung nhĩ. Trong thuyên tắc huyết khối tĩnh mạch tái phát hoặc thay van tim cơ học, mục tiêu INR có thể cao hơn, thường ở mức 2,5 – 3,5 [5, 6].
Bảng 1: Mục tiêu Anti-Xa trong quản lý điều trị enoxaparin [7]
| Chỉ định | Mục tiêu Anti-Xa (UI/mL) |
| Dự phòng thuyên tắc huyết khối tĩnh mạch | 0,2 – 0,4 |
| Điều trị liều 1 mg/kg/12 giờ | 0,5 – 1 |
| Điều trị liều 1,5 mg/kg/24 giờ | 1 – 2 |
Đối với heparin không phân đoạn, hai công cụ phổ biến là thời gian thromboplastin hoạt hóa từng phần (aPTT) và xét nghiệm anti-Xa. Mục tiêu aPTT cần đạt 1.5 – 2 lần giới hạn bình thường trên. Tuy nhiên, anti-Xa đang dần được ưu tiên hơn trong môi trường hồi sức do ít bị ảnh hưởng bởi các yếu tố sinh lý hoặc tình trạng viêm toàn thân như aPTT. Anti-Xa đo lường gián tiếp nồng độ heparin bằng cách đánh giá mức độ ức chế yếu tố Xa. Một số hướng dẫn khuyến cáo sử dụng anti-Xa để theo dõi cả heparin không phân đoạn và heparin trọng lượng phân tử thấp, đặc biệt trong các tình huống như bệnh nhân suy thận, béo phì, phụ nữ mang thai hoặc bệnh nhân điều trị với ECMO. Bảng 1 thể hiện mục tiêu Anti-Xa trong điều trị enoxaparin [7].
Đối với thuốc kháng đông đường uống tác động trực tiếp (DOACs), như dabigatran, rivaroxaban hay apixaban, mặc dù các nghiên cứu ban đầu cho thấy không cần theo dõi thường quy, nhưng trong một số tình huống lâm sàng, việc đo lường nồng độ thuốc là cần thiết. Ví dụ bao gồm xuất huyết nghiêm trọng, cần can thiệp phẫu thuật cấp cứu, suy gan hoặc thận tiến triển, nghi ngờ quá liều, tuân thủ điều trị kém hoặc khi dùng kèm các thuốc ảnh hưởng đến P-glycoprotein hoặc CYP3A4. Trong những tình huống này, xét nghiệm chuyên biệt như thời gian thrombin, thời gian thrombin pha loãng (dTT), thời gian đông máu ecarin (ECT), xét nghiệm yếu tố anti-Xa bằng phương pháp sinh sắc dành riêng cho từng loại DOAC có thể hỗ trợ đánh giá nồng độ thuốc và đưa ra quyết định điều trị chính xác hơn [8].
Bên cạnh các xét nghiệm định lượng truyền thống, một số công cụ tiên tiến như thăm dò chức năng đông máu động học, ví dụ như đo độ đàn hồi huyết khối (TEG) và đo độ đàn hồi huyết khối quay (rotational thromboelastometry – ROTEM) – cho phép đánh giá toàn bộ quá trình hình thành cục máu đông trong thời gian thực. Những công cụ này đặc biệt hữu ích trong bối cảnh bệnh nhân có rối loạn đông máu phức tạp hoặc đang dùng phối hợp nhiều loại thuốc kháng đông, giúp xác định nguyên nhân tiềm ẩn gây chảy máu hoặc huyết khối không rõ ràng trên xét nghiệm truyền thống. Ngoài ra, trong chiến lược cá thể hóa hiện đại, cần cân nhắc việc ứng dụng xét nghiệm di truyền học, đặc biệt là với warfarin và dabigatran. Các đột biến như CYP2C9, VKORC1 có thể được xét nghiệm sớm để tiên lượng liều khởi đầu và nguy cơ xuất huyết. Dù chưa phổ biến rộng rãi trong thực hành lâm sàng do hạn chế về thời gian và chi phí, nhưng đây là công cụ hứa hẹn trong tương lai, đặc biệt ở những bệnh nhân có tiền sử đáp ứng bất thường với kháng đông hoặc biến chứng nặng không rõ nguyên nhân [2].
5. THÁCH THỨC VÀ ĐỊNH HƯỚNG TƯƠNG LAI
Mặc dù chiến lược cá thể hóa trong điều trị thuốc kháng đông được xem là hướng tiếp cận đầy hứa hẹn nhằm tối ưu hóa hiệu quả và giảm thiểu biến chứng ở bệnh nhân hồi sức tích cực, nhưng việc triển khai thực tế vẫn còn đối mặt với nhiều thách thức. Một trong những rào cản lớn nhất hiện nay là thiếu các bằng chứng lâm sàng chất lượng cao từ các thử nghiệm ngẫu nhiên có đối chứng áp dụng riêng cho nhóm bệnh nhân hồi sức. Hầu hết các khuyến cáo hiện hành về liều lượng, cách sử dụng và theo dõi thuốc kháng đông đều được rút ra từ các nghiên cứu trên bệnh nhân ổn định hoặc không thuộc nhóm nặng, dẫn đến khoảng cách giữa bằng chứng khoa học và thực hành lâm sàng trong hồi sức vẫn còn rất lớn [1]. Ngoài ra, bệnh nhân hồi sức có đặc điểm sinh lý bệnh biến động liên tục, khó dự đoán và thường xuyên thay đổi do can thiệp thủ thuật, nhiễm trùng, tổn thương đa cơ quan hoặc sử dụng thiết bị hỗ trợ tuần hoàn. Điều này khiến cho các công cụ theo dõi thông thường như INR, thời gian thromboplastin hoạt hóa từng phần hay xét nghiệm anti-Xa có thể không phản ánh chính xác hiệu quả kháng đông thực tế, dẫn đến sai lệch trong điều chỉnh liều hoặc thay đổi phác đồ điều trị. Bên cạnh đó, các công cụ hiện đại hơn như thromboelastography hoặc xét nghiệm định lượng đặc hiệu DOACs tuy có giá trị nhưng chưa phổ biến rộng rãi do chi phí cao, yêu cầu kỹ thuật và nhân lực chuyên môn.
Một thách thức khác là tính sẵn có và thời gian trả kết quả của các xét nghiệm dược lý học di truyền. Mặc dù các đột biến gen như VKORC1, CYP2C9 hay CES1 đã được chứng minh ảnh hưởng rõ rệt đến liều và đáp ứng thuốc, nhưng phần lớn bệnh viện hồi sức tại các quốc gia thu nhập trung bình chưa có điều kiện triển khai xét nghiệm di truyền một cách thường quy. Ngay cả ở các cơ sở có điều kiện, thời gian chờ kết quả thường không phù hợp với bối cảnh lâm sàng cần quyết định điều trị trong vài giờ đầu nhập viện [2]. Từ những thách thức nêu trên, các định hướng tương lai cho cá thể hóa điều trị thuốc kháng đông ở bệnh nhân hồi sức cần tập trung vào một số điểm then chốt. Trước hết, cần đẩy mạnh nghiên cứu lâm sàng chuyên biệt trên nhóm bệnh nhân nặng, đặc biệt là nghiên cứu đa trung tâm có kiểm soát nhằm xác định lợi ích rõ rệt của từng chiến lược cá thể hóa. Song song đó, phát triển các mô hình dự đoán đáp ứng thuốc dựa trên học máy, trí tuệ nhân tạo và tích hợp dữ liệu đa tầng (bao gồm lâm sàng, sinh hóa, hình ảnh và di truyền) sẽ giúp phân tầng nguy cơ và lựa chọn phác đồ tối ưu cho từng người bệnh. Bên cạnh đó, cần đơn giản hóa và chuẩn hóa các xét nghiệm theo dõi kháng đông, đặc biệt là các công cụ như anti-Xa hoặc định lượng DOACs, để phù hợp hơn với thực tế triển khai tại đơn vị hồi sức. Hướng đến việc phát triển các bộ kit xét nghiệm tại giường cho phép đánh giá nhanh nồng độ thuốc kháng đông và mức độ ức chế yếu tố đông máu là một ưu tiên cần thiết trong tương lai gần. Cuối cùng, việc xây dựng quy trình điều trị liên chuyên khoa và đào tạo chuyên sâu cho đội ngũ nhân viên y tế về cá thể hóa điều trị sẽ là nền tảng để đảm bảo hiệu quả, tính khả thi và an toàn trong thực hành lâm sàng.
6. KẾT LUẬN
Cá thể hóa điều trị thuốc kháng đông ở bệnh nhân hồi sức tích cực là một xu hướng tất yếu nhằm tối ưu hóa hiệu quả chống huyết khối và giảm thiểu nguy cơ chảy máu. Chiến lược này đòi hỏi đánh giá toàn diện các yếu tố lâm sàng, sinh học và di truyền, kết hợp với các công cụ theo dõi phù hợp và phối hợp liên chuyên khoa. Mặc dù còn nhiều thách thức, việc phát triển các xét nghiệm chuyên sâu, ứng dụng công nghệ và tăng cường nghiên cứu sẽ là định hướng quan trọng trong việc hiện thực hóa y học chính xác trong điều trị kháng đông.
TÀI LIỆU THAM KHẢO
- Dager WE, Trujillo TC, Gilbert BW. Approaches to Precision-based Anticoagulation management in the critically Ill. Pharmacotherapy. 2023;43(11):1221-36. Epub 2023/08/22. doi: 10.1002/phar.2868. PubMed PMID: 37604646.
- Cross B, Turner RM, Zhang JE, Pirmohamed M. Being precise with anticoagulation to reduce adverse drug reactions: are we there yet? The pharmacogenomics journal. 2024;24(2):7. Epub 2024/03/06. doi: 10.1038/s41397-024-00329-y. PubMed PMID: 38443337; PubMed Central PMCID: PMCPMC10914631 and EU Commission. He has also received partnership funding for the MRC Clinical Pharmacology Training Scheme (cofunded by MRC and Roche, UCB, Eli Lilly and Novartis). He is member of the Innovative Health Initiative, ARDAT (www.ardat.org). RMT is now an employee of GSK; his work on this review started before this employment. The remaining authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
- Neuenfeldt FS, Weigand MA, Fischer D. Coagulopathies in Intensive Care Medicine: Balancing Act between Thrombosis and Bleeding. Journal of clinical medicine. 2021;10(22). Epub 2021/11/28. doi: 10.3390/jcm10225369. PubMed PMID: 34830667; PubMed Central PMCID: PMCPMC8623639.
- Febbraro S, Leal Martínez-Bujanda J, Nieto Magro C, Bettica P. Bioavailability study of Enoxaparin Sodium Chemi (80 mg/0.8 mL) and Clexane (80 mg/0.8 mL) subcutaneous injection in healthy adults. International journal of clinical pharmacology and therapeutics. 2021;59(11):734-44. Epub 2021/08/18. doi: 10.5414/cp204022. PubMed PMID: 34402789; PubMed Central PMCID: PMCPMC8554289.
- Witt DM. Is It Time to Reevaluate Current International Normalized Ratio Targets for Asian Patients Following Mechanical Heart Valve Replacement? JAMA network open. 2022;5(2):e2146034. Epub 2022/02/02. doi: 10.1001/jamanetworkopen.2021.46034. PubMed PMID: 35103796.
- Klamroth R, Riess H, Beyer-Westendorf J, Linnemann B. Recurrent Venous Thromboembolism in Patients on Anticoagulation: An Update Based on the Revised AWMF S2k Guideline. Hamostaseologie. 2024;44(2):150-4. Epub 2024/05/01. doi: 10.1055/a-2173-7729. PubMed PMID: 38688270.
- Sikes L, Charles K, Antigua A, Patel R, Imboywa S, Cherian P. Anti-Factor Xa Level Monitoring for Enoxaparin Prophylaxis and Treatment in High-Risk Patient Groups. HCA healthcare journal of medicine. 2023;4(2):105-9. Epub 2023/07/10. doi: 10.36518/2689-0216.1464. PubMed PMID: 37424985; PubMed Central PMCID: PMCPMC10324872.
- Kumano O, Akatsuchi K, Amiral J. Updates on Anticoagulation and Laboratory Tools for Therapy Monitoring of Heparin, Vitamin K Antagonists and Direct Oral Anticoagulants. Biomedicines. 2021;9(3). Epub 2021/04/04. doi: 10.3390/biomedicines9030264. PubMed PMID: 33799956; PubMed Central PMCID: PMCPMC7998518.







