1. Đặt vấn đề
Bệnh cơ tim thất phải gây loạn nhịp (ARVC) hay còn gọi là loạn sản thất phải gây loạn nhịp (ARVD) là một trong những bệnh cơ tim nguyên phát hiếm gặp, với biểu hiện lâm sàng đặc trưng là rối loạn nhịp tim nguy hiểm đe dọa tính mạng, gây ra do sự thay thế tế bào cơ tim bằng mô xơ – mỡ [4],[10],[13].
ThS. LÊ THỊ LAN HƯƠNG
TS. NGUYỄN THI MỸ HẠNH
Bệnh viện Nhân dân 115
Theo các thống kê, tỉ lệ mắc bệnh dao động quanh khoảng từ 1/5000 người trong dân số chung đến khoảng 1/2000 người đối với một số nước Châu Âu như Ý, Đức. Trong đó, khoảng 50% bệnh nhân có tiền căn gia đình liên quan đến bệnh [7]. Hiện nay với nhiều công cụ chẩn đoán như: siêu âm tim 2D, chụp cộng hưởng từ tim, xét nghiệm di truyền học…nhiều bệnh nhân rối loạn nhịp thất đã được chẩn đoán bệnh ARVC. Đặc biệt trong những năm gần đây, với khả năng đánh giá hình thái, thể tích, chức năng thất phải vượt trội so với siêu âm, MRI tim đã trở thành một trong những công cụ hữu hiệu trong chẩn đoán bệnh. Tuy nhiên, việc theo dõi quản lý những bệnh nhân này, nhất là nhóm bệnh nhân không triệu chứng rất phức tạp bao gồm: phân tầng yếu tố nguy cơ, giáo dục thay đổi lối sống và sàng lọc về di truyền. Cho đến nay, ARVC chưa được nghiên cứu nhiều trong nước và các bác sĩ lâm sàng đôi khi sẽ lúng túng trong chẩn đoán và theo dõi bệnh [6].. Trên cơ sở đó, nhân hai trường hợp lâm sàng, chúng tôi xin trình bày một vài vấn đề cơ bản về bệnh lý nguy hiểm này.
Đặc điểm sinh bệnh học của bệnh lý ARVC là mất các tế bào cơ tim, và được thay thế bằng mô xơ và mô mỡ. Tổn thương thâm nhiễm dạng viêm ( chủ yếu là tế bào Lympho T) thường liên quan với hiện tượng chết tế bào, cho thấy tiến trình của bệnh có thể liên quan trung gian miễn dịch. Mô sẹo dạng xơ – mỡ tiến triển từ thượng mạc vào nội mạc cơ tim, tập trung chủ yếu ở thành thất phải. Kết quả thành thất phải mỏng dần và tạo các túi phình. Tổn thương điển hình của bệnh ARVC chủ yếu tập trung ở vùng “tam giác loạn sản” (triangle of dysplasia) gồm: buồng tống, buồng nhận và mỏm thất phải, thất trái ít bị ảnh hưởng. Tuy nhiên, ngày nay khái niệm trên đã thay đổi do ARVC còn có thể gặp dạng tổn thương thất trái hoặc dạng liên quan 2 thất. Tổn thương dạng mô xơ – mỡ trong ARVC là nguyên nhân gây ra những rối loạn nhịp thất thường gặp trên lâm sàng, do làm chậm dẫn truyền nội thất và hoạt động như chất nền gây ra loạn nhịp qua cơ chế vòng vào lại tương tự như sẹo cơ tim sau nhồi máu [9].
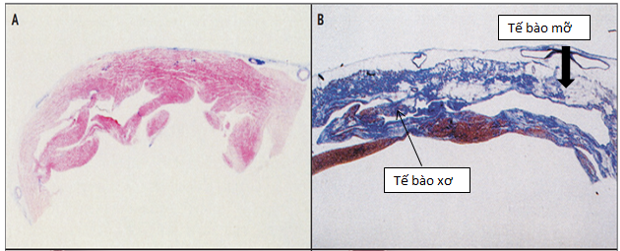
Hình1: Sinh bệnh học ARVC: A: tế bào cơ tim bình thường
B: tế bào cơ tim bệnh ARVC: với tế bào xơ ( màu xanh), tế bào mỡ ( màu trắng)[7]
Đứng về khía cạnh sinh học phân tử, ARVC là bệnh lý xảy ra tại vùng gian bào (desmosome). Vùng này thường tập trung nhiều tại da và mô cơ tim, góp phần tạo nên những liên kết cơ học giữa các tế bào và là chất trung gian quan trọng của dẫn truyền tín hiệu nội bào. Trong đa số các trường hợp, ARVC gây ra bởi đột biến gen mã hóa cho những protein gian bào như: plakoglobin (JUP), desmoplakin (DSP), plakophilin – 2 (PKP2), desmoglein – 2 (DSG2), và desmocollin – 2 (DSC2) [2]. Rất ít các trường hợp gây ra bởi đột biến gen không phải vùng gian bào. ARVC là bệnh lý di truyền trên nhiễm sắc thể trội. Bất thường di truyền trên nhiễm sắc thể lặn rất hiếm gặp, thường gặp ở hội chứng da – tim như Carvajal hoặc Naxos.
Năm 1982, Marcus và cộng sự lần đầu tiên mô tả có hệ thống 24 trường hợp lâm sàng, sau đó đã phác thảo sơ lược về bệnh loạn sản thất phải là bệnh lý cơ tim nguyên phát ảnh hưởng chủ yếu lên thất phải và đặc trưng bởi thay thế một phần hoặc toàn bộ cơ tim thất phải bằng tế bào xơ hoặc mỡ. Tác giả đã phân biệt tình trạng thiếu hụt hoàn toàn cơ thất phải và tình trạng thay thế một phần cơ thất phải bằng tế bào xơ và mỡ. Dạng đầu tiên thường gây ra dãn buồng tim và đặc điểm lâm sàng là suy tim sung huyết. Dạng thứ 2 thường gây ra tình trạng rối loạn cấu trúc thất phải và chức năng cơ tim mức độ nhẹ. Khi lâm sàng đi kèm nhịp nhanh thất, tình trạng này được định nghĩa là bệnh loạn sản thất phải. Sau đó, các tác giả đã mô tả thêm 34 trường hợp lâm sàng khác và cung cấp thêm nhiều dữ kiện lâm sàng trong chẩn đoán bệnh bao gồm:đặc điểm lâm sàng: nhịp nhanh thất, nhịp nhanh trên thất, suy tim phải hoặc dãn buồng tim không triệu chứng, điện tâm đồ: sóng T đảo ở các chuyển đạo trước ngực phải, xét nghiệm hình ảnh học, tăng kích thước buồng tim phải (thời kỳ tâm trương), thường khởi phát ở người trẻ, nam thường gặp hơn nữ.
Năm 1988, nghiên cứu trên 12 bệnh nhân trẻ đột tử, Thiene và cộng sự đã mô tả thêm về đặc điểm hình thái học của bệnh, bao gồm;khối lượng cơ thất bình thường hoặc tăng nhẹ, thay thế mỡ hoặc xơ – mỡ ở thành tự do thất phải, đôi khi có tình trạng thoái hóa hoặc hoại tử cơ tim, kèm hoặc không kèm tình trạng thâm nhiễm dạng viêm.
Năm 1994, các Hiệp hội toàn cầu đưa ra tiêu chuẩn chẩn đoán lâm sàng của bệnh cơ tim thất phải gây loạn nhịp[1]. Những tiêu chuẩn này với mục đích chẩn đoán và giải thích rõ ràng các đặc điểm lâm sàng cũng như sinh bệnh học của ARVC, và được phân thành 3 nhóm như sau:đặc điểm bất thường về cấu trúc hoặc mô bệnh học, bất thường trên ECG hoặc loạn nhịp tim, tiền căn gia đình.
Những đặc điểm này được phân nhóm và chia thành các tiêu chuẩn chính và phụ dựa vào mức độ liên quan chặt chẽ với bệnh. Tuy nhiên, tiêu chuẩn này có độ đặc hiệu cao, nhưng độ nhạy thấp [1].
Và trong vòng hơn 15 năm nay, những hiểu biết về bệnh ARVC ngày càng rõ hơn. Những đặc điểm trên ECG được bổ sung, các cơ sở về dữ liệu di truyền về phân tích đột biến gen ngày càng được phát triển. Đồng thời các tiêu chí đánh giá về hình ảnh ngày càng cải thiện nhờ sự tiến bộ của các kỹ thuật mới như: siêu âm tim tương phản, siêu âm tim 3D, và đặc biệt là cộng hưởng từ tim và kỹ thuật 3D – mapping trong thăm dò điện sinh lý [19],[22].
Vì thế, năm 2010, các Hiệp hội toàn cầu tiếp tục đưa ra các hướng dẫn mới nhằm mục đích cải thiện chẩn đoán và quản lý bệnh. Các tiêu chuẩn được sửa đổi, kết hợp những kiến thức về cơ sở di truyền, nhằm mục đích tăng độ nhạy, đồng thời duy trì độ đặc hiệu trong chẩn đoán bệnh [12].
|
|
Tiêu chuẩn cũ 1994 |
Tiêu chuẩn mới 2010 |
|
SỰ THAY ĐỔI VỀ CẤU TRÚC HOẶC RỐI LOẠN CHỨC NĂNG TỪNG VÙNG/ TOÀN BỘ |
||
|
Chính |
§ Dãn nặng hoặc giảm phân suất tống máu thất phải, không kèm suy chức năng thất trái ( hoặc suy nhẹ) § Túi phình khu trú thất phải § Dãn nặng từng vùng thất phải
|
1. Siêu âm tim: Vô động, giảm động hoặc phình vách thất phải, kèm 1 trong những tiêu chuẩn sau: § Đường kính buồng tống thất phải trên mặt cắt trục dọc cạnh ức (tâm trương) ≥ 32 mm, hoặc ≥ 19 mm/m2) § Đường kính buồng tống thất phải trên mặt cắt trục ngắn cạnh ức (tâm trương) ≥ 36 mm hoặc ≥ 21 mm/m2). § Phân suất diện tích thất phải (Fractional area change) ≤ 33% 2. MRI tim: Thất phải vô động, giảm động hoặc co bóp không động đồng bộ, kèm 1 trong những tiêu chuẩn sau: § Tỉ số thể tích thất phải cuối thì tâm trương: ≥ 110 ml/m2 (nam) hoặc ≥ 100 ml/m2 (nữ) § Phân suất tống máu thất phải (RVEF) ≤ 40% 3. Chụp thất đồ bằng DSA: Giảm động, vô động hoặc phình vách thất phải |
|
Phụ |
Dãn nhẹ toàn bộ thất phải và/ hoặc chức năng co bóp thất trái bình thường Dãn nhẹ khu trú từng vùng của thất phải Giảm động từng vùng thất phải |
Trên siêu âm 2D: Giảm động hoặc vô động thất phải, kèm 1 trong những tiêu chuẩn sau: § Đường kính buồng tống thất phải trên mặt cắt trục dọc cạnh ức (tâm trương) trong khoảng từ 29 – 32 mm, hoặc từ 16 – 19 mm/m2 diện tích da). § Đường kính buồng tống thất phải trên mặt cắt trục ngắn cạnh ức (tâm trương) trong khoảng từ 32 – 36 mm, hoặc từ 18 -21 mm/m2 diện tích da). § 33%< FAC ≤ 40% Trên MRI: Thất phải vô động, giảm động hoặc co bóp không động đồng bộ, kèm 1 trong những tiêu chuẩn sau: § Thể tích thất phải cuối thì tâm trương trong khoảng 100- 109 ml/m2 (nam) hoặc 90 – 99 ml/m2 (nữ). § RV EF trong khoảng từ 40 – 45% |
|
ĐẶC ĐIỂM MÔ HỌC |
||
|
Chính |
Sinh thiết cơ tim ghi nhận sợi xơ – mỡ thay thế tế bào cơ tim. |
Tế bào cơ tim còn lại < 60% trên hình thái học (hoặc ước lượng < 50%), kèm xơ hóa cơ tim ≥ 1 mẫu sinh thiết của thành tự do thất phải, tế bào mỡ thay thế +/- |
|
Phụ |
|
Tế bào cơ tim còn lại: 60 – 75% trên hình thái học (hoặc ước lượng < 50 – 65%), kèm xơ hóa cơ tim ≥ 1 mẫu sinh thiết của thành tự do thất phải, tế bào mỡ thay thế +/- |
|
BẤT THƯỜNG VỀ TÁI CỰC |
||
|
Chính |
|
– T đảo ở các chuyển đạo trước ngực phải (V1, V2, V3) ở BN > 14 tuổi không có block nhánh phải hoàn toàn |
|
Phụ |
T đảo ở chuyển đạo V2-V3 (bệnh nhân > 12 tuổi và không có block nhánh phải) |
– T đảo ở các chuyển đạo V1-V2 ở BN > 14 tuổi không có block nhánh phải hoàn toàn, hoặc T đảo ở V4-V5 hoặc V6 – BN > 14 tuổi và kèm block nhánh phải hoàn toàn: T đảo từ V1 – V4 |
|
BẤT THƯỜNG VỀ KHỬ CỰC VÀ DẪN TRUYỀN |
||
|
Chính |
Sóng epsilon hoặc QRS dãn (>110ms) ở các chuyển đạo trước tim phải (V1-V3) |
Sóng epsilon ở các chuyển đạo trước tim phải (V1-V3) |
|
Phụ |
Điện thế trễ trên signal – averaged (S-A ECG) |
– Điện thế trễ trên S-A ECG có ở ≥1/3 chuyển đạo không có QRS dãn ≥110ms ở chuyển đạo ECG chuẩn – fQRS (filtered QRS) ≥114ms – Thời gian của những điện thế QRS < 40µV là ≥38ms – Tổng bình phương điện thế của những đoạn 40ms là ≤20µV – Tổng thời gian hoạt động của QRS≥ 55ms: được đo từ chân sóng S đến hết sóng R, bao gồm cả R’ ở các chuyển đạo V1- V3 khi không có block nhánh phải hoàn toàn. |
|
LOẠN NHỊP |
||
|
Chính |
|
Nhịp nhanh thất kéo dài hoặc cơn nhanh thất ngắn dạng block nhánh trái với trục hướng lên trên (QRS âm/ vô định ở D2-D3-aVF và QRS dương aVL) |
|
Phụ |
Nhịp nhanh thất kéo dài hoặc nhịp nhanh thất ngắn, dạng block nhánh trái trục hướng lên (trục QRS âm hoặc vô định ở chuyển đạo D2 – D3 – aVF và dương ở chuyển đạo aVL) |
– Nhịp nhanh thất kéo dài hoặc cơn nhanh thất ngắn dạng buồng tống thất phải hoặc dạng block nhánh trái kèm trục hướng xuống dưới (QRS dương D2-D3-aVF và QRS âm aVL) – Holter ECG 24 giờ: > 500 ngoại tâm thu thất |
|
TIỀN CĂN GIA ĐÌNH |
||
|
Chính |
Tiền căn gia đình có thành viên có quan hệ huyết thống trực hệ thứ 1 mắc bệnh ARVC được xác định qua khám nghiệm tử thi hoặc phẫu thuật |
– Những thành viên có quan hệ huyết thống trực hệ thứ 1 thỏa tiêu chuẩn chẩn đoán ARVC (Task Force criteria) – Chẩn đoán ARVC ở những thành viên có quan hệ huyết thống F1 qua sinh thiết hoặc phẫu thuật – Mang gen đột biến có khả năng mắc ARVC |
|
Phụ |
– Đột tử < 35 tuổi nghi do ARVD – Tiền căn gia đình mắc bệnh: qua chẩn đoán lâm sàng. |
– Tiền căn gia đình được chẩn đoán ARVC (trực hệ thứ 1) nhưng không thỏa tiêu chuẩn hoặc không rõ. – Có thành viên gia đình liên quan huyết thống thuộc trực hệ thứ 1 bị đột tử < 35 tuổi nghi do ARVC. – Thỏa tiêu chuẩn chẩn đoán ARVC ở thành viên thế hệ thứ 2 |
Theo tiêu chuẩn mới năm 2010: chẩn đoán chắc chắn khi có 2 tiêu chuẩn chính; hoặc 1 tiêu chuẩn chính kèm 2 tiêu chuẩn phụ; hoặc 4 tiêu chuẩn phụ ở 4 nhóm khác nhau. Chẩn đoán mắc ARVC ngưỡng ranh giới (bordeline) gồm: 1 tiêu chuẩn chính và 3 tiêu chuẩn phụ ở 3 nhóm khác nhau. Và có khả năng ARVC khi: 1 tiêu chuẩn chính hoặc 2 tiêu chuẩn phụ ở 2 nhóm.
4. Cộng hưởng từ tim trong chẩn đoán bệnh
Trong hơn một thập kỷ qua, đã có nhiều bước tiến trong kỹ thuật MRI như: cuộn thu và phát sóng, tốc độ hình ảnh nhanh hơn, và độ tương phản tuyệt vời giữa máu và cơ tim với chuỗi xung tạo ảnh nhanh (SSFP) làm MRI trở thành công cụ hữu hiệu trong chẩn đoán bệnh lý tim mạch. Mặc dù MRI không phải là tiêu chuẩn vàng trong chẩn đoán, nhưng đây là công cụ chẩn đoán hình ảnh không xâm lấn quan trọng nhất cho chẩn đoán ARVC. Bởi vì MRI tim là có thể đánh giá hoàn chỉnh đặc điểm hình thái, chức năng thất phải cũng như đặc tính mô học của cơ thất phải [21].
Một nghiên cứu gần đây so sánh giá trị giữa MRI và siêu âm tim trong chẩn đoán bệnh ARVC. Kết quả ghi nhận, trong những bệnh nhân thỏa tiêu chuẩn chẩn đoán bằng MRI, chỉ có 50% thỏa tiêu chuẩn siêu âm tim [18]
|
Cộng hưởng từ |
Tiêu chuẩn |
Độ nhạy % |
Độ đặc hiệu % |
|
Tiêu chí chính: § Thể tích thất phải cuối thì tâm trương: o Nam o Nữ § RV EF |
≥ 110 ml/m2 ≥ 100 ml/m2 ≤ 40% |
76 % 68 % |
90% 98% |
|
Tiêu chí phụ: § Tỉ số thể tích thất phải cuối thì tâm trương /BSA: o Nam o Nữ § RV EF |
≥ 100 ml/m2 ≥ 90 ml/m2 ≤ 45% |
79 % 89 % |
85% 97% |
Bảng2 : Độ nhạy và độ đặc hiệu của MRI tim trong chẩn đoán ARVC[12]
Dựa vào những đánh giá đặc điểm mô học trên MRI và khi theo dõi dài hạn, bệnh ARVC chia làm 3 dạng [18]: điển hình là tổn thương thất phải ưu thế, kèm ít hoặc không kèm bất thường thất trái; dạng ưu thế thất trái: chủ yếu tổn thương thất trái, thất phải tổn thương ít; dạng liên quan cả hai thất: thất trái và thất phải đều ảnh hưởng như nhau.
MRI tim còn cho thấy hình ảnh vùng mỏm thất phải, và cùng với buồng tống và buồng nhận đã từng được mô tả kinh điển là “ tam giác loạn sản” [11], thường chỉ gặp ở giai đoạn tiến triển nặng của bệnh. [20].
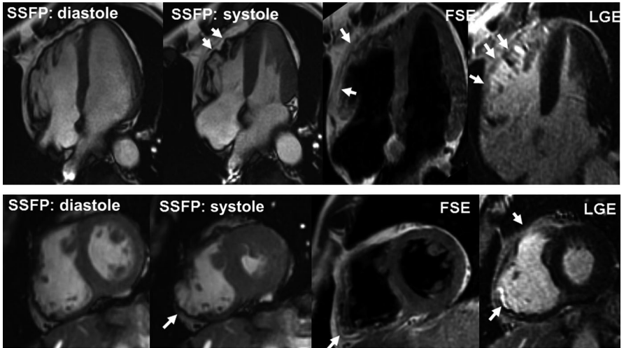
Hình 2: MRI của bệnh nhân mắc ARVC. Trên hình SSFP ghi nhận loạn động nhiều vùng (mũi tên). Trên hình FSE ghi nhận thâm nhiễm mô mỡ trong mô cơ tim (mũi tên) và trên hình LGE ghi nhận thâm nhiễm mô xơ (mũi tên) [3].
Mặc dù là phương tiện chẩn đoán tốt, tuy nhiên khi phân tích hình ảnh thất phải cần lưu ý một số lỗi thường gặp bao gồm: đọc sai các biến thể bình thường của cử động thất phải ( ví dụ như vận động thành tự do thất phải tại nơi bám của dải điều hòa thường kém hơn so với những vùng xuang quanh), giải thích không chính xác thâm nhiễm mỡ trong mô cơ tim, nhầm lớp mỡ ở màng ngoài tim. Và đặc biệt lưu ý trên đối tượng trẻ em, việc thâm nhiễm mỡ, hoặc tế bào sợi thường ít khi phát hiện được bằng MRI [17].
5. Điều trị
Mục tiêu điều trị bệnh là làm giảm nguy cơ đột tử, cải thiện chất lượng cuộc sống bằng cách làm giảm triệu chứng loạn nhịp tim và suy tim. Hạn chế những hoạt động thể thao cường độ cao kể cả những bệnh nhân có biểu hiện lâm sàng hay người lành mang gen đột biến nhằm mục đích ngừa những rối loạn nhịp thất liên quan gắng sức [8]. Do diễn tiến tự nhiên của ARVC, cho nên bệnh nhân cần được theo dõi lâm sàng ít nhất mỗi 2 năm bằng các xét nghiệm không xâm lấn.
Mặc dù còn thiếu nhiều dữ kiện lâm sàng, nhưng thuốc ức chế beta được khuyến cáo sử dụng đối với bệnh nhân có biểu hiện lâm sàng, nhằm mục đích ngừa rối loạn nhịp cũng như giảm sức căng thành thất phải. Ở những bệnh nhân có rối loạn nhịp thất, các thuốc chống loạn nhịp khác cũng giúp cải thiện triệu chứng, tuy nhiên không có bằng chứng lâm sàng cho thấy các thuốc này có khả năng ngăn ngừa đột tử. Aminodarone đơn trị hoặc kết hợp với nhóm ức chế beta và sotalol là những thuốc chống loạn nhịp hiệu quả nhất, mặc dù cần lưu ý tác dụng phụ lâu dài khi dùng aminodarone, nhất là đối với bệnh nhân trẻ tuổi [8].
Cắt đốt là một trong những chọn lựa điều trị đối với những bệnh nhân có cơn nhanh thất kéo dài đơn dạng (sustained monomorphic VT). Trong quá trình theo dõi các bệnh nhân cắt đốt, mặc dù phương pháp này không làm giảm tỉ lệ loạn nhịp gây tử vong, nhưng có thể cải thiện triệu chứng, đặc biệt ở những bệnh nhân có bão điện [16]. Việc sử dụng bản đồ 3D, và cắt đốt ở vùng thượng mạc có thể cho một vài kết quả khả quan. Tuy nhiên, nhiều dữ liện hiện nay cho thấy nguy cơ khi cắt đốt thượng tâm mạc là khá đáng kể.
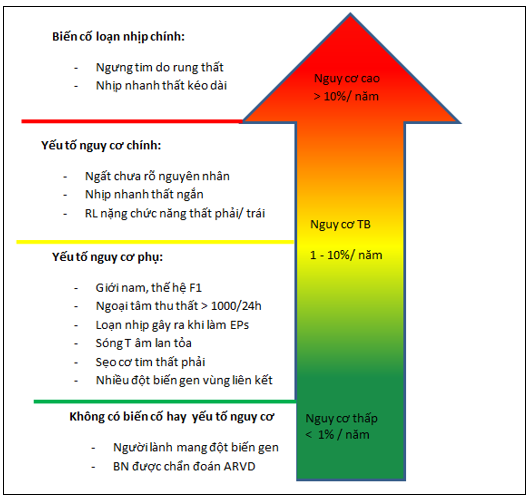
Hiện nay, cấy ICD là phương pháp duy nhất giúp phòng ngừa đột tử ở bệnh nhân ARVC. Quyết định điều trị quan trọng nhất vẫn là bệnh nhân mắc ARVC có cần cấy ICD hay không [5]. Do kết quả của các nghiên cứu về ARVC rất khác nhau, nên khuyến cáo phòng ngừa tiên phát bằng cấy ICD cũng rất thay đổi [15]. Loạn nhịp gây ra khi thăm dò điện sinh lý và nhịp nhanh thất ngắn được xem là những yếu tố dự đoán độc lập, và thích hợp để cấy ICD phòng ngừa tiên phát [5]. Một nghiên cứu gần đây cho thấy 47% bệnh nhân đặt ICD để ngừa đột tử có sốc điện khi theo dõi trong vòng 5.8 năm. Trên một phân tích gộp với cỡ mẫu lớn khoảng 610 bệnh nhân ARVC có đặt ICD để phòng ngừa tiên phát hoặc thứ phát, tỉ lệ can thiệp trên các bệnh nhân có chỉ định đặt ICR rõ ràng và không rõ ràng lần lượt là 9.5% / năm và 3.7% / năm. Đối với những bệnh nhân đột tử được cứu sống, VT kháng trị, hoặc ngất nguy cơ đột tử cao, nên khuyến cáo đặt ICD. Phân tích gộp này cho thấy bệnh ARVC cấy ICD làm giảm tỉ lệ tử vong chung cũng như tỉ lệ tử vong do tim mạch [14].
6. Tiên lượng
Đặc điểm lâm sàng của bệnh là những loạn nhịp nguy hiểm hoặc suy thất phải hoặc suy cả hai thất nặng có thể dẫn đến tử vong. Tỉ lệ tử vong ước tính chung dao động trong khoảng 0.08 – 3.6% mỗi năm [8]. Tuy nhiên, tỉ lệ này có thể bị ước tính quá mức vì đa số dựa trên các nghiên cứu thực hiện trên những đối tượng bệnh nhân nằm viện nguy cơ cao. Những nghiên cứu đoàn hệ gần đây dựa trên dân số chung cho thấy kết quả điều trị khá khả quan với tỉ lệ tử vong chung hàng năm < 1%. Hiện nay, việc tiên lượng bệnh phụ thuộc chủ yếu vào loạn nhịp nguy hiểm và rối loạn chức năng 2 thất [7],[8].
7. Ca lâm sàng
Chúng tôi xin minh họa 2 ca lâm sàng ARVC tổn thương liên quan 2 thất. Trong đó, MRI tim là công cụ hỗ trợ rất nhiều cho chẩn đoán bệnh.
CA 1:
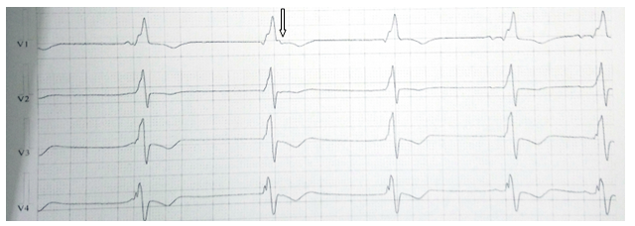
Bệnh nhân nam, 67 tuổi, không có tiền sử bệnh lý gì. Khoảng 1 tháng nay, bệnh nhân thường lên cơn khó thở tăng dần, có lúc khó thở về đêm, khó thở phải ngồi, không kèm đau ngực, không hồi hộp, không ngất. Bệnh nhân nằm điều tri tại BV tỉnh Bình Dương 2 tuần, xuất viện với chẩn đoán: Suy tim – Bệnh tim thiếu máu cục bộ, uống thuốc theo toa gồm: Micardis, Verospirone, Clopidogrel, Atorvastatin. Sau xuất viện bệnh nhân còn mệt nhiều, khó thở kèm phù chân nên nhập viện Nhân dân 115 để tiếp tục điều trị. Tại đây khám lâm sàng ghi nhận: BN tỉnh táo, than khó thở, không đau ngực, nhịp tim chậm 50 lần/ phút, huyết áp ổn 100/60 mmHg, tĩnh mạch cổ nổi và phù mềm 2 chân, gan mấp mé bờ sườn, phổi ran ẩm 2 đáy, tim đều chậm, âm thổi tâm thu 2/6 ở liên sườn IV bờ trái ức. Điện tâm đồ ghi nhận nhịp bộ nối 50 lần/ phút, block nhánh phải hoàn toàn với phức bộ QRS dãn 160ms, sóng T âm từ V1-V4 (Hình 3)
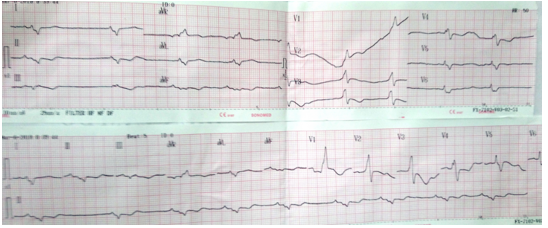
Hình 3: Điện tâm đồ ghi nhận nhịp bộ nối 50 lần/ phút, block nhánh phải hoàn toàn với phức bộ QRS dãn 160ms, sóng T âm từ V1-V4
XQ ngực tại thời điểm nhập viện ghi nhận: bóng tim to với chỉ số tim – lồng ngực # 0.6 , xơ hóa đỉnh phổi phải nghi do lao phổi cũ (Hình 4)
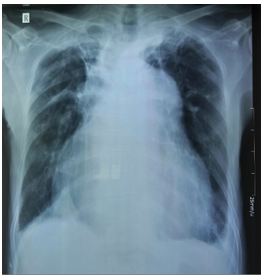
Hình 4: XQ ngực tại thời điểm nhập viện
Troponin I –hs được làm ngay lập tức và cho kết quả bình thường 19.4 pg/mL (ngưỡng 34.2 pg/ml), chức năng thận và điện giải đồ cũng trong giới hạn bình thường.Siêu âm tim (Hình 5) ghi nhận: dãn lớn buồng tim phải (RV = 60mm), dãn động mạch phổi và 2 nhánh. Chức năng tâm thu thất trái bảo tồn EF 55%. Vô động thành tự do thất phải. Hở 2 lá nhẹ, hở 3 lá mức độ trung bình, không tăng áp động mạch phổi.
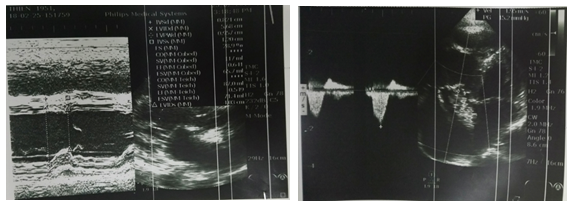
Hình 5: Siêu âm tim
Trong quá trình nằm viện, Bn được gắn Holter ECG. Kết quả trên Holter (Hình 6) ghi nhận: ghi nhận sóng epsilon ở V1-V3 (mũi tên), ngoại tâm thu thất thưa (30 nhịp/24 giờ # 0.05), nhịp chậm xoang liên tục trong ngày tần số dao động # 37-56 lần/ phút, đồng thời ghi nhận có cơn nhanh thất ngắn.
Hình 6: Kết quả trên Holter ECG
Bệnh nhân nghi ngờ bệnh ARVD, nên tiếp tục chụp MRI tim để chẩn đoán. Kết quả MRI tim (Hình 7) như sau: Tăng nhẹ thể tích buồng thất trái (LVEDi = 114ml/m2), chức năng tâm thu thất trái giảm nặng LVEF 26%, vách liên thất vận động nghịch thường, giảm động nặng vùng giữa mỏm các thành thất trái. Tăng thể tích thất phải nặng (RVEFi = 341ml/m2), chức năng tâm thu thất phải giảm nặng RVEF 13% với giảm động nặng toàn bộ các thành thất phải. Không ghi nhận hình ảnh tăng tín hiệu muộn trên LGE.
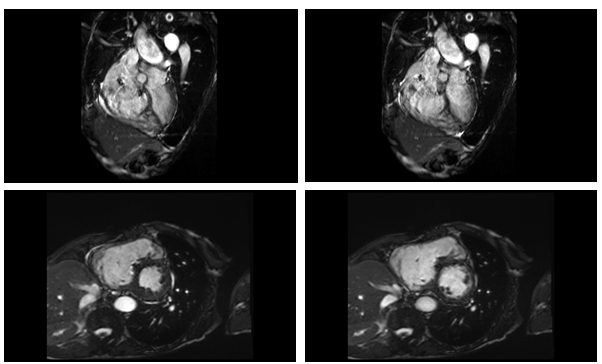
Hình 7a: Hình cine 4 buồng và trục ngang qua cơ trụ ghi nhận dãn lớn buồng tim phải
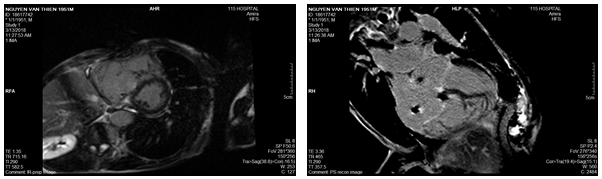
Hình 7b: Hình LGE 4 buồng và trục ngang không ghi nhận hình ảnh tăng tín hiệu muộn
Tổng hợp tất cả biểu hiện lâm sàng của bệnh nhân này thỏa tiêu chuẩn chẩn đoán chắc chắn bệnh ARVC gồm: bất thường về cấu trúc, chức năng thất phải, bất thường về khử cực, tái cực và kèm loạn nhịp. Theo thang điểm tính nguy cơ đối với bệnh nhân này có nguy cơ trung bình. Như vậy, đây là một trường hợp ARVC gây rối loạn nặng chức năng tâm thu hai thất với biểu hiện lâm sàng là bệnh cảnh suy tim và nhịp chậm.
CA 2:
Bệnh nhân nữ, 24 tuổi, tiền căn khỏe mạnh. Trong vòng 2 tháng nay, bệnh nhân thấy khó thở, khi gắng sức, khó thở tăng dần, không kèm đau ngực, không ngất, không phù. 1 tuần trước nhập viện, bệnh nhân khó thở nhiều, đi lại khoảng 50m là mệt, ảnh hưởng tới hoạt động sinh hoạt thường ngày, có lúc khó thở về đêm. Bệnh nhân đi khám ở y tế địa phương ghi nhận Troponin I tăng cao, siêu âm tim dãn các buồng tim kèm phân suất tống máu thất trái kém chuyển bệnh viện Nhân dân 115 điều trị tiếp. Tại đây, khám lâm sàng ghi nhận: mạch nhanh 110 lần/ phút, huyết áp = 90/60 mmHg, mỏm tim ở liên sườn V đường trung đòn trái, âm thổi 2/6 ở liên sườn III-IV bờ trái ức, các cơ quan khác chưa ghi nhận bất thường. Điện tâm đồ ghi nhận nhịp nhanh xoang, trục tim lệch phải, lớn nhĩ phải (Hình 8).
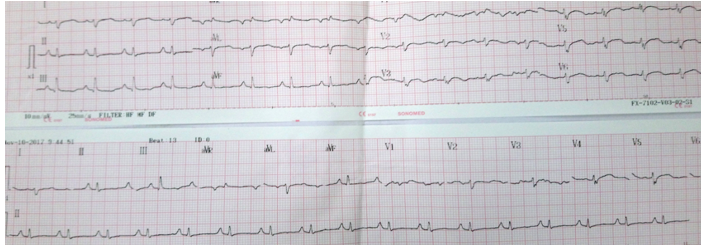
Hình 8: Điện tâm đồ ghi nhận nhịp nhanh xoang, trục tim lệch phải, lớn nhĩ phải
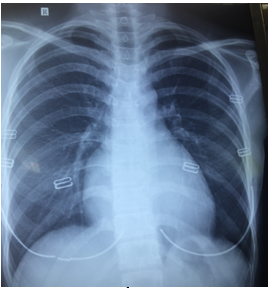
XQ thời điểm nhập viện (hình 9) ghi nhận bóng tim không to, RC/T # 0.5, không ghi nhận tổn thương nhu mô phổi.
Hình 9: XQ thời điểm nhập viện
Bệnh nhân được làm men tim ghi nhận men tim tăng không hiệu giá 654 – 660 pg/mL (cách nhau 06 giờ). Siêu âm tim tại thời điểm nhập viện (hình 10) ghi nhận: dãn lớn buồng tim phải (RV = 45mm, chức năng tâm thu thất trái giảm EF 25% với giảm động hầu hết thành tự do thất trái, chức năng thất phải giảm nặng TAPSE = 9mm kèm giảm động thành tự do thất phải), nhiều túi phình ở mỏm, huyết khối mỏm 2 thất. Hở 3 lá nặng ¾ do dãn vòng van, không kèm tăng áp phổi với PAPS = 23mmHg.
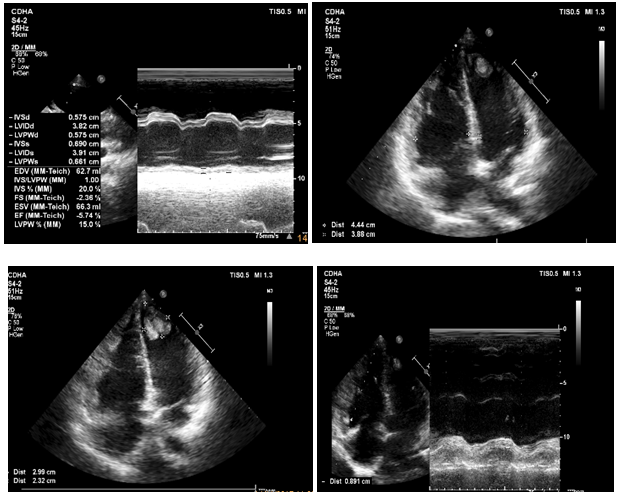
Hình 10: Siêu âm tim tại thời điểm nhập viện
Với bệnh cảnh lâm sàng chưa loại trừ thuyên tắc phổi với định lượng D-Dimer tăng cao 1.67 µg/mL (ngưỡng tham chiếu < 0.25µg/mL). Kết quả chụp MSCT ngực có cản quang: dãn buồng tim phải nhưng không ghi nhận huyết khối động mạch phổi, không tồn thương nhu mô phổi (hình 11)

Hình 11: Kết quả chụp MSCT ngực có cản quang
Trong quá trình nằm viện, bệnh nhân được làm siêu âm tim qua thực quản vì nghi ngờ luồng thông trong tim. Tuy nhiên, kết quả ETO ghi nhận như sau: dãn lớn buồng tim phải, PFO kích thước 2mm, vách liên nhĩ nguyên vẹn, không ghi nhận luồng thông trong tim, không bất thường tĩnh mạch phổi trở về tim. Bệnh nhân được gắn holter ECG trong 24 giờ, kết quả ghi nhận ngoại tâm thu thất thưa (PVC = 26 nhịp/24 giờ # 0.02%), không ghi nhận loạn nhịp khác. Vì vậy, với bệnh cảnh lâm sàng như vậy, chẩn đoán nghi ngờ ARVD được đặt ra, và bệnh nhân tiếp tục được làm MRI tim. Kết quả MRI tim (hình 12) : suy chức năng thất trái nặng với EF # 20%, thể tích trất trái bình thường. Giảm động toàn bộ các thành thất trái với phần giữa và mỏm gần như vô động. Huyết khối mỏm thất trái với d = 1.9 x 4 cm. Tăng thể tích thất phải V = 163ml/m2, suy chức năng thất phải nặng với RVEF = 7.5%. Toàn bộ các thành thất phải giảm động nặng đến vô động, có một số ổ phình vách ở buồng tống và gần mỏm thất phải. Đặc biệt trên hình LGE ghi nhận tăng tín hiệu muộn phân bố kiểu mid – wall ở thành dưới và thành bên thất trái, dạng patchy ở vách liên thất và thành tự do thất phải. Kết luận: ARVD dạng liên quan 2 thất.
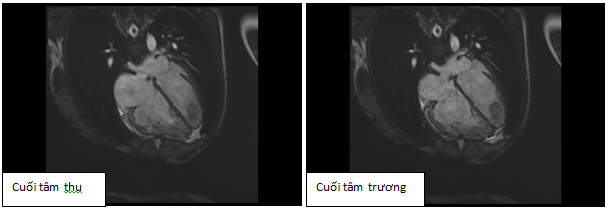
Hình 12a: Hình cine 4 buồng cho thấy dãn lớn buồng tim phải, kèm huyết khối 2 thất
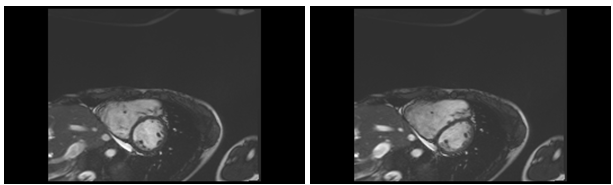
Hình 12b: Hình trục ngang (short axis) cho thấy dãn lớn buồng tim phải và tràn dịch màng tim
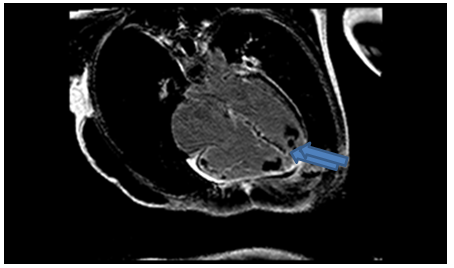
Hình 12c: Hình LGE cho thấy huyết khối mỏm 2 thất ( mũi tên), hình ảnh tăng tín hiệu muộn ở thành tự do thất phải, vách liên thất và thành bên thất trái
Như vậy, trường hợp bệnh nhân này thỏa tiêu chuẩn chẩn đoán ARVC gồm: bất thường về cấu trúc và chức năng thất phải (trên MRI tim) và bất thường tái cực. Và tương tự như ca lâm sàng thứ nhất, đây cũng là ARVC dạng liên quan 2 thất – nguy cơ trung bình với biểu hiện lâm sàng suy tim nổi bật.
8. Kết luận:
ARVC là bệnh lý hiếm gặp nhưng là một trong những nguyên nhân có thể dẫn đến đột tử ở người trẻ. Biểu hiện lâm sàng của bệnh rất đa dạng, có thể không điển hình, việc chẩn đoán có thể là một thách thức với các bác sĩ lâm sàng. Như 2 trường hợp lâm sàng trên đây, bệnh cảnh lâm sàng nổi bật là suy tim, đặc biệt là tổn thương cả 2 thất. Quá trình chẩn đoán phụ thuộc nhiều vào các phương tiện hình ảnh không xâm lấn, đặc biệt là MRI đã hỗ trở rất nhiều cho chẩn đoán bệnh.
TÀI LIỆU THAM KHẢO
1. McKenna W. J., Thiene G., Nava A., et al. (1994), “Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Task Force of the Working Group Myocardial and Pericardial Disease of the European Society of Cardiology and of the Scientific Council on Cardiomyopathies of the International Society and Federation of Cardiology”, British heart journal, 71 (3), pp. 215.
2. Ackerman M. J., Priori S. G., Willems S., et al. (2011), “HRS/EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies: this document was developed as a partnership between the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA)”, Heart Rhythm, 8 (8), pp. 1308-1339.
3. Aquaro G. D., Barison A., Todiere G., et al. (2016), “Usefulness of combined functional assessment by cardiac magnetic resonance and tissue characterization versus task force criteria for diagnosis of arrhythmogenic right ventricular cardiomyopathy”, American Journal of Cardiology, 118 (11), pp. 1730-1736.
4. Basso C., Corrado D., Marcus F. I., et al. (2009), “Arrhythmogenic right ventricular cardiomyopathy”, The Lancet, 373 (9671), pp. 1289-1300
5. Bhonsale A., James C. A., Tichnell C., et al. (2011), “Incidence and predictors of implantable cardioverter-defibrillator therapy in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy undergoing implantable cardioverter-defibrillator implantation for primary prevention”, J Am Coll Cardiol, 58 (14), pp. 1485-1496.
6. Cho Y. (Arrhythmogenic right ventricular cardiomyopathy”, J Arrhythm, 0 (0).
7. Corrado D., Link M. S., Calkins H. (2017), “Arrhythmogenic Right Ventricular Cardiomyopathy”, New England Journal of Medicine, 376 (1), pp. 61-72.
8. Corrado D., Wichter T., Link M. S., et al. (2015), “Treatment of arrhythmogenic right ventricular cardiomyopathy/dysplasia: an international task force consensus statement”, Eur Heart J, 36 (46), pp. 3227-3237.
9. Fontaine G., Frank R., Tonet J., et al. (1984), “Arrhythmogenic right ventricular dysplasia: a clinical model for the study of chronic ventricular tachycardia”, Japanese circulation journal, 48 (6), pp. 515-538.
10. Haugaa K. H., Haland T. F., Leren I. S., et al. (2015), “Arrhythmogenic right ventricular cardiomyopathy, clinical manifestations, and diagnosis”, EP Europace, 18 (7), pp. 965-972
11. Marcus F. I., Fontaine G. H., Guiraudon G., et al. (1982), “Right ventricular dysplasia: a report of 24 adult cases”, Circulation, 65 (2), pp. 384-398.
12. Marcus F. I., McKenna W. J., Sherrill D., et al. (2010), “Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the task force criteria”, Eur Heart J, 31 (7), pp. 806-814
13. Marcus F. I., Zareba W., Calkins H., et al. (2009), “Arrhythmogenic right ventricular cardiomyopathy/dysplasia clinical presentation and diagnostic evaluation: results from the North American Multidisciplinary Study”, Heart Rhythm, 6 (7), pp. 984-992
14. Mazzanti A., Ng K., Faragli A., et al. (2016), “Arrhythmogenic right ventricular cardiomyopathy: clinical course and predictors of arrhythmic risk”, J Am Coll Cardiol, 68 (23), pp. 2540-2550.
15. Members A. T. F., Priori S. G., Blomström-Lundqvist C., et al. (2015), “2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC) Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC)”, EP Europace, 17 (11), pp. 1601-1687.
16. Philips B., Madhavan S., James C., et al. (2012), “Outcomes of Catheter Ablation of Ventricular Tachycardia in Arrhythmogenic Right Ventricular Dysplasia/CardiomyopathyClinical Perspective”, Circulation: Arrhythmia and Electrophysiology, 5 (3), pp. 499-505.
17. Rastegar N., Burt J. R., Corona-Villalobos C. P., et al. (2014), “Cardiac MR findings and potential diagnostic pitfalls in patients evaluated for arrhythmogenic right ventricular cardiomyopathy”, Radiographics, 34 (6), pp. 1553-1570.
18. Sen-Chowdhry S., Syrris P., Ward D., et al. (2007), “Clinical and genetic characterization of families with arrhythmogenic right ventricular dysplasia/cardiomyopathy provides novel insights into patterns of disease expression”, Circulation, 115 (13), pp. 1710-1720 %@ 0009-7322.
19. Tandri H., Friedrich M. G., Calkins H., et al. (2004), “MRI of arrhythmogenic right ventricular cardiomyopathy/dysplasia”, Journal of Cardiovascular Magnetic Resonance, 6 (2), pp. 557-563.
20. Te Riele A. S., James C. A., Philips B., et al. (2013), “Mutation‐Positive Arrhythmogenic Right Ventricular Dysplasia/Cardiomyopathy: The Triangle of Dysplasia Displaced”, J Cardiovasc Electrophysiol, 24 (12), pp. 1311-1320.
21. Wang W., James C. A., Calkins H. (2018), “Diagnostic and therapeutic strategies for arrhythmogenic right ventricular dysplasia/cardiomyopathy patient”, EP Europace.
22. Yoerger D. M., Marcus F., Sherrill D., et al. (2005), “Echocardiographic findings in patients meeting task force criteria for arrhythmogenic right ventricular dysplasia: new insights from the multidisciplinary study of right ventricular dysplasia”, J Am Coll Cardiol, 45 (6), pp. 860-865







