(Management of Myocarditis-Related Cardiomyopathy in Adults)
Bs. Trương Phan Thu Loan*, Bs. Nguyễn Thanh Hiền, Bs Trần Thị Xuân Anh**
* BV Nhân dân 115
** BV ĐHYD Tp Hồ Chí Minh
- CA LÂM SÀNG.
Bệnh nhân (BN) nữ 70 tuổi, nhập viện trong tình trạng phù hai chi dưới, khó thở khi gắng sức và tăng dần trong một tháng nay. BN không có tiền căn bệnh lý tim mạch. Yếu tố nguy cơ tim mạch: tăng huyết áp và hút thuốc lá. BN chỉ uống 1 viên đa sinh tố mỗi ngày. Khám lâm sàng cho thấy: BN không sốt, mạch và huyết áp bình thường, tĩnh mạch cảnh không nổi, nhịp tim bình thường, nghe rale nổ ở 2 đáy phổi, bụng không chướng và gan lách không sờ chạm, phù hai chi dưới nhẹ. Điện tâm: nhịp xoang đều, trục trung gian thỉnh thoảng có ngoại tâm thu thất. Xquang phổi: bóng tim to nhẹ và có hình ảnh phù phổi mô kẽ. Siêu âm tim: đường kính thất trái tâm trương dãn nhẹ và chức năng tâm thu thất trái giảm nặng EF=21%. Xạ hình tưới máu tim và chụp động mạch vành bình thường. BN được sinh thiết thất phải qua tĩnh mạch cảnh trong phải. Sau khi lấy mẫu sinh thiết BN đột ngột tụt huyết áp và mất ý thức. BN được đặt nội khí quản và siêu âm tim cấp cứu ghi nhận có tràn dịch màng ngoài tim lượng nhiều, không thể dẫn lưu màng ngoài tim do có nhiều huyết khối. Mở ngực BN cấp cứu ghi nhận có nhiều máu bắn ra từ thành tự do cùa thất phải, và đã khâu lại chổ mô bị vỡ. Tuy nhiên BN vẫn tử vong và không làm tử thiết. Kết quả sinh thiết nội mạch cơ tim (Endomyocardial Biopsy-EMB) không tìm thấy tác nhân gây bệnh đặc biệt. Nhưng trong bệnh cơ tim, EMB vẫn đang được cân nhắc như là một công cụ giúp chẩn đoán và hướng dẫn điều trị [52].
- ĐẶT VẤN ĐỀ.
Viêm cơ tim là tình trạng tăng các đáp ứng miễn dịch tế bào hoặc thể dịch trong tim kèm với những đặc điểm mô học và lâm sàng khác nhau theo mức độ từ đau ngực hay khó thở nhẹ đến sốc tim cấp. Trên 20% BN viêm cơ tim có thể tiến triển thành bệnh cơ tim dãn nở do tình trạng viêm mạn tính [48]. Mặc dù viêm cơ tim là hậu quả của nhiễm nhiều loại virus, vi khuẩn, kí sinh trùng hoặc do nấm, nhưng sự kích hoạt nhiều nhất được chứng minh trên một số virus đặc biệt. Bên cạnh nhiễm trùng, viêm cơ tim có thể bị do trực tiếp độc chất hoặc do các phản ứng trung gian miễn dịch đối với thuốc bao gồm: các chất ức chế miễn dịch những rối loạn miễn dịch hệ thống như: bệnh sarcoidosis hoặc lupus ban đỏ hệ thống [11][47].
Hầu hết các BN được chẩn đoán viêm cơ tim cấp thường bình phục không biến chứng. Trong một nghiên cứu (NC) khảo sát đa trung tâm gần đây ghi nhận 684 BN viêm cơ tim cấp không biến chứng có kết cục lâm sàng ngắn hạn và dài hạn tốt. Tuy nhiên, đặc điểm lâm sàng của viêm cơ tim cấp có thể thay đổi nhanh chóng trong những ngày đầu của bệnh, vì vậy BN nghi ngờ chẩn đoán viêm cơ tim cấp, tăng troponin hay có thay đổi trên điện tâm đồ nên được nhập viện theo dõi. Trong giai đoạn cửa sổ này nhiều BN sẽ có các dấu hiệu suy tim, sốc tim sớm hay rối loạn nhịp tim (các dữ liệu từ những nghiên cứu y tế liên kết với những thử nghiệm lâm sàng ghi nhận). Sinh thiết nội mạc cơ tim ở BN viêm cơ tim cấp có thể giúp tiên lượng và xác định các tác nhân gây bệnh đặc biệt, ngay cả ở những trường hợp ban đầu không được chẩn đoán bệnh cơ tim [38].
Bệnh cơ tim sau viêm đặc trưng bởi dãn tâm thất trái, rối loạn chức năng tâm thu và giảm co bóp cơ tim trên BN có tiền căn viêm cơ tim trước đó. Tỷ lệ tử vong ở bệnh cơ tim dãn nở trong 5 năm từ 20-50% [24]. Bệnh thường xảy ra ở nam tuổi trung niên với tần suất 5-8/100000 người/năm. Nhiều NC ghi nhận tầm quan trọng của phản ứng viêm trong tim có liên quan với bệnh cơ tim. Thông qua việc xác định bệnh học của viêm cơ tim do virus, người ta ghi nhận cơ chế viêm cơ tim do virus có thể là nguyên nhân dẫn đến bệnh cơ tim dãn [15][29].
Trong bài viết này, chúng tôi sẽ phác họa những khuyến cáo hiện tại và chiến lược điều trị những nguyên nhân đặc biệt ở những BN viêm cơ tim mạn tính có biến chứng bệnh cơ tim (bệnh cơ tim dãn nở do viêm mạn tính> 3 tháng), cũng như những hướng tiếp cận mới trong tương lai. Hy vọng bài viết này sẽ cung cấp những thông tin cần thiết giúp các nhà lâm sàng có thêm các công cụ chẩn đoán và hướng điều trị thích hợp nhằm giảm chi phí điều trị, giảm biến chứng và kéo dài cuộc sống của bệnh nhân.
- SINH LÝ BỆNH
Viêm cơ tim do virus có thể biểu hiện tình trạng viêm rất đột ngột đặc trưng bằng tẩm nhuận tế bào viêm, thoái hóa và hoại tử tế bào cơ tim và cuối cùng là quá trình xơ hóa cơ tim. Vật chất di truyền của virus là ARN và ADN có thể tồn tại lâu dài trong cơ tim. Cơ thể chống lại bằng những phản ứng miễn dịch thông qua hoạt hóa các tế bào lympho độc tế bào (cytotoxic lymphocytes) và tế bào giết tự nhiên (natutal killer cells). Những phản ứng miễn dịch này cùng với sự phát triển không bình thường của virus làm suy giảm chức năng cơ tim mà không có sự tiêu tế bào rõ rệt. Hơn nữa, sự tồn tại của virus có thể làm thay đổi biểu hiện kháng nguyên của phức hợp hòa hợp tổ chức chính (major histocompatibility complex) tạo nên sự phơi nhiễm của hệ miễn dịch với những kháng nguyên tân tạo. Sự giải phóng các cytokine và interleukin-1 khởi động các đáp ứng miễn dịch của cơ thể. Hậu quả cuối cùng của các quá trình bệnh lý phức tạp trên thường là bệnh cơ tim dãn nở [24][29]
Tiến trình viêm cơ tim tiến triển qua 3 giai đoạn: giai đoạn tổn thương cơ tim ban đầu, giai đoạn tổn thương cơ tim miễn dịch và cuối cùng là bệnh cơ tim dãn nở. Hầu hết BN không có dấu hiệu suy tim ở giai đoạn I do đó giai đoạn này ít được chú ý. Sau tổn thương viêm đầu tiên là giai đoạn II sẽ khởi phát các đáp ứng miễn dịch sau tổn thương. Triệu chứng lâm sàng bắt đầu tiến triển là hậu quả của tổn thương cơ tim nặng. Ở giai đoạn III là hình ảnh và triệu chứng điển hình của bệnh cơ tim dãn nở sau viêm sẽ rầm rộ mặc dù tiến trình viêm đã chấm dứt [12][45] (hình 1).
Trong pha đầu tiên, ghi nhận có bằng chứng của nhiễm virus trong hầu hết các trường hợp, ngoài ra bệnh sử có thể liên quan nhiễm độc hoặc hóa chất. Điều trị trong giai đoạn này là loại bỏ các tác nhân gây bệnh, điều trị thuốc kháng virus và nâng đỡ hệ miễn dịch. Trong pha II, nhiều nghiên cứu ghi nhận có sự đáp ứng miễn dịch với từng tác nhân gây bệnh và là nguyên nhân gây rối loạn chức năng thất trái. EMB ghi nhận có sự tẩm nhuận tế bào viêm, thay đổi mô học do hoạt hóa hệ miễn dịch. Chưa có NC nào ghi nhận hiệu quả vĩnh viễn của các thuốc ức chế miễn dịch. Tuy nhiên chưa có kỹ thuật chẩn đoán nào mới hơn để điều chỉnh chế độ của bệnh và các tác nhân gây bệnh đặc biệt. Pha III là hậu quả của tiến trình viêm và đáp ứng miễn dịch, bệnh tiến triển theo hướng bệnh cơ tim dãn nở vô căn. Bệnh được chẩn đoán chủ yếu qua phương pháp hình ảnh học. Điều trị chủ yếu là phòng ngừa và đảo ngược tái cấu trúc của cơ tim.

Hình 1: Tiến trình 3 pha của bệnh cơ tim sau viêm.
- CHIẾN LƯỢC CHẨN ĐOÁN TRƯỜNG HỢP NGHI NGỜ VIÊM CƠ TIM CẤP TRONG SUY TIM CẤP VÀ MẠN.
Nên thực hiện xét nghiệm Troponin và siêu âm tim trong trường hợp viêm cơ tim cấp (IC). Mặc dù hình ảnh cộng hưởng từ tim (cMRI) dùng những kỹ thuật chụp native mapping giúp chẩn đoán tình trạng viêm của cơ tim tốt hơn (AUC 90% của đường cong ROC), nhưng việc sử dụng CMR/cMRI thường bị hạn chế do tình trạng rối loạn nhịp và thở máy ở những BN có rối loạn huyết động. Ở những BN ổn định về lâm sàng nghi ngờ viêm cơ tim cấp, cMRI có thể giúp xác định chẩn đoán và đánh giá nguy cơ tử vong do rối loạn nhịp hoặc tử vong do bệnh mạch máu tim dựa vào sự có hay không có tăng tính hiệu Gadolium muộn. cMRI là phương tiện chẩn đoán chính xác nhất viêm cơ tim cấp < 2-3 tuần từ khi khởi phát triệu chứng do sẹo hay hiện tượng viêm xuất hiện khác nhau tùy từng giai đoạn [26][40][41]. Hơn nữa, cMRI cũng hữu ích trong phân tầng nguy cơ của bệnh. Giá trị chẩn đoán của cMRI thấp nếu triệu chứng khởi phát quá 3 tháng. Điều này ghi nhận ở những BN có suy tim kéo dài > 3 tháng và có liên quan đến dãn thất trái. Những BN này điều trị suy tim thường không hiệu quả trên lâm sàng [3][19].
Ở những BN viêm cơ tim cấp biểu hiện suy tim cấp với sốc tim, bloc AV cao độ hoặc nhịp nhanh thất có triệu chứng, việc tiếp cận chẩn đoán qua sinh thiết nội mac cơ tim (EMB) được Hiệp hội tim mạch Châu Âu (ESC) và Hiệp hội tim mạch Hoa Kỳ (AHA) khuyến cáo mức Class IB. Trong những thể lâm sàng này, sử dụng EMB có thể cung cấp những thông tin đặc biệt như hướng chẩn đoán (bảng 1), tình trạng viêm, hướng điều trị thích hợp, khả năng hồi phục bệnh, chỉ định ghép tim, và đề nghị chiến lược can thiệp.[13][27]
Bảng 1: Các dạng đặc biệt của viêm cơ tim được chẩn đoán qua EMB.
| Các dạng viêm cơ tim:
• Viêm cơ tim do Adenovirus. • Viêm cơ tim do Enterovirus. • Viêm cơ tim do Herpesvirus 6 ở người. • Viêm cơ tim do tăng nhạy cảm. • Viêm cơ tim liên quan đến các tác nhân ức chế đặc biệt. • Viêm cơ tim tế bào Eosinophile. • Viêm cơ tim tế bào khổng lồ ( GMC: Giant cell myocarditis). • Viêm cơ tim giảm u hạt vô căn (cardiac sarcoidosis) |
- VAI TRÒ CỦA EMB TRONG LỰA CHỌN ĐIỀU TRỊ TỐI ƯU Ở VIÊM CƠ TIM.
EMB là tiêu chuẩn vàng để chẩn đoán viêm cơ tim và bệnh cơ tim do viêm. Các nguyên nhân gây viêm cơ tim bao gồm: độc chất, nhiễm trùng, bệnh lý tự miễn hay tẩm nhuận tế bào xảy ra tùy mức độ trong tế bào (bảng 1). Không có công cụ chẩn đoán nào có thể đánh giá triệt để các tác nhân gây bệnh. Với việc phát hiện các gen virus và chứng minh các phản ứng viêm trong các giai đoạn của viêm cơ tim, EMB góp phần quan trọng cung cấp những thông tin để các nhà lâm sàng theo dõi và đưa ra hướng điều trị hiệu quả cho BN. Năm 2007 AHA và ESC khuyến cáo EMB (Class I) thực hiện ở những BN suy tim không giải thích được< 2 tuần liên quan dãn thất trái, rối loạn nhịp hoặc rối loạn dẫn truyền mới xuất hiện. Lý do chính giới hạn thực hiện EMB là sự an toàn. Tuy nhiên, nếu thực hiện thủ thuật tại các trung tâm chuyên khoa nhiều kinh nghiệm, biến chứng trên thất phải và thất trái xảy ra rất thấp. Chimenti và CS ghi nhận trong 28 năm thực hiện EMB trên 400 BN, biến chứng xuất hiện chỉ 0.33% BN [17][31].
Vai trò của EMB được hướng dẫn trong điều trị nhưng không được thực hiện trong các thử nghiệm lâm sàng lớn. Tuy nhiên, các hiệp hội chuyên ngành bao gồm ESC và AHA đều tán thành với các khuyến cáo dựa trên sự đồng thuận trong việc chỉ định EMB nên được thực hiện ở những BN không tiến triển bệnh nhanh, không có rối loạn nhịp mới xảy ra, không có bệnh lý thứ phát gây nên bệnh cơ tim và điều trị suy tim không cải thiện dù đã điều trị nội khoa tối ưu.
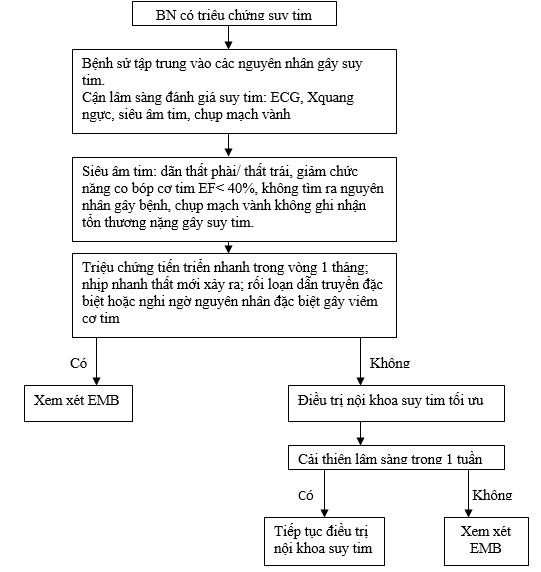
Hình 2: Lược đồ đánh giá trên BN bệnh cơ tim dãn nở [32][52]
Hiệp hội tim mạch Hoa Kỳ cũng khuyến cáo về đặc điểm của các phản ứng viêm, đánh giá ảnh hưởng của virus trên cơ tim từ đó đưa ra hướng điều trị hợp lý. Bắt đầu liệu trình điều trị viêm cơ tim dựa vào các giả thuyết vẫn đang được tiến hành trong các thử nghiệm lâm sàng. Mặc dù vẫn còn thiếu những thông tin từ các thử nghiệm lâm sàng ngẫu nhiên, chỉ định EMB vẫn được lựa chọn cân nhắc ở các trung tâm lâm sàng (hình 2). Phần tiếp theo sẽ cung cấp các kết luận hiện tại về diễn biến và tiên lượng của một số thử nghiệm lâm sàng. Đây sẽ là công cụ hướng dẫn điều trị các tác nhân đặc biệt gây viêm cơ tim [31] (hình 3).
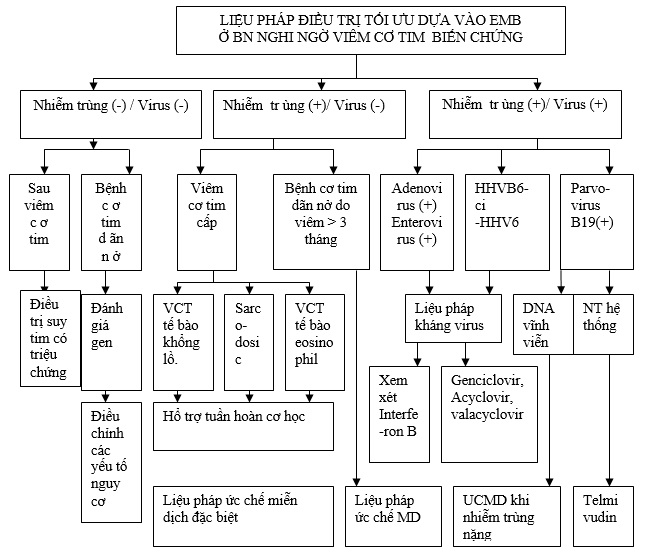
Hình 3. Gợi ý chọn lựa điều trị trong viêm cơ tim có biến chứng dựa vào EMB và các đặc điểm lâm sàng.
Phân tích hóa mô miễn dịch và bộ gen virus có thể xác định các tác nhân gây bệnh đặc biệt. Các công cụ chẩn đoán mới đây thay thế cho tiêu chuẩn Dallas (với sai số 25%) đã làm thay đổi góc nhìn của chúng ta và giá trị tiên lượng [23]. Phân biệt viêm cơ tim tế bào khổng lồ được đặc trưng bởi sự tẩm nhuận viêm lan tỏa của cơ tim so với tế bào lympho và tế bào đa nhân khổng lồ mà không có bạch cầu hạt. Phương pháp này nhuộm Hematoxylin và Eosin thông thường cho độ nhạy 80% do sự tẩm nhuận phản ứng viêm vào tế bào cơ tim. Hóa mô miễn dịch sử dụng phổ kháng thể đơn dòng và đa dòng (bao gồm kháng CD3, kháng CD 68 và kháng nguyên chống tế bào bạch cầu ở người- DR) được khuyến cáo là đặc trưng của tẩm nhuận phản ứng viêm [5].
Vì viêm cơ tim có tính chất từng mảng (patchy), nên cần ít nhất 6 mẩu sinh thiết. Tỉ lệ âm tính giả có thể giảm hơn nếu sử dụng cMRI hay PET tim mạch để xác định vùng viêm cho những BN chọn lọc.
Độ an toàn của sinh thiết nội mạc cơ tim được đồng thuận 20 năm nay với mẫu sinh thiết nhỏ hơn [14]. Biến chứng của EMB tại các trung tâm chuyên khoa thấp hơn chụp mạch vành (<0.05%). Việc thực hiện rộng rãi EMB bị giới hạn do hóa mô miễn dịch và phân tích phân tử đòi hỏi phải được giám định bởi các chuyên gia và các trang thiết bị hiện đại (bị giới hạn bởi các trung tâm khác nhau). Chiến lược đồng thuận trong những hướng dẫn của EMB còn hạn chế do các hướng dẫn điều trị và kết quả dựa vào EMB có mẫu quá nhỏ [28][48]. Lựa chọn EMB và MRI nêu ở bảng 2.
Bảng2. Lựa chọn MRI tim mạch và sinh thiết nội mạc cơ tim (EMB) dựa vào sự đồng thuận của các chuyên gia [39].
| MRI tim | Sinh thiết nội mạc cơ tim | |
| Sốc tim | – | ++ |
| Viêm cơ tim cấp không biến chứng | + | – |
| Viêm cơ tim cấp biến chứng rối loạn nhịp | – | + |
| Bệnh cơ tim do viêm (> 3 tháng) | +/- (Kết quả âm tính không loại trừ tình trạng viêm khu trú) | ++/ BN được chọn lọc |
| Đánh giá đáp ứng điều trị | + | Liệu pháp thất bại/ không đáp ứng |
- ĐIỀU TRỊ HIỆN TẠI VÀ MỚI TRONG VIÊM CƠ TIM CẤP.
Tất cả các BN viêm cơ tim cấp nên được điều trị nội khoa theo hướng dẫn điều trị suy tim và rối loạn nhịp nếu có thể [33][52]. Trong thời gian 3 đến 6 tháng, BN cần hạn chế các môn thể thao có tính đối kháng để giảm nguy cơ tái cấu trúc cơ tim và phòng ngừa đột tử. Điều trị viêm cơ tim do các tác nhân đặc biệt, phụ thuộc vào đặc điểm lâm sàng, bệnh sử, thời điểm khởi phát bệnh và chẩn đoán dựa vào sinh học phân tử. Trong một khảo sát ở 187 BN trưởng thành bị viêm cơ tim cấp, kết quả ghi nhận phần lớn BN có triệu chứng > 1 tháng và chỉ có 55/187 BN (29%) đòi hỏi phải điều trị thuốc vận mạch (Inotrop) và hỗ trợ tuần hoàn cơ học (mechanical circulatory support- MCS) [39]. Các biện pháp này rất cần thiết cho BN thất bại với điều trị thông thường. Tương tự, những BN bị bệnh cơ tim cấp có biến chứng rối loạn huyết động và rối loạn nhịp tim nên được xem xét EMB sớm để xác định nguyên nhân gây bệnh và các yếu tố thúc đẩy gây suy tim [10].
Các dạng đặc biệt của viêm cơ tim cấp bao gồm : viêm cơ tim tế bào khổng lồ (GCM) và viêm cơ tim tăng bạch cầu ái toan (Eosinophil) có thể được chẩn đoán phân biệt bởi EMB. Dựa vào đặc điểm mô học trên EMB, GCM có thể phân biệt với bệnh tim sarcoidosis, viêm cơ tim tăng bạch cầu ái toan. Điều trị GMC bao gồm các thuốc ức chế miễn dịch với cyclosporin và prednison, thỉnh thoảng kết hợp với azathioprine. Thời gian điều trị tối thiểu 2 năm để tránh tái phát và tử vong. Bệnh tim do tăng bạch cầu ái toan (Eosinophilic heart disease ) thường lâm sàng rất nặng (clinically fulminant: viêm cơ tim mới khở phát kèm suy tim nặng đòi hỏi dùng thuốc vận mạch và MCS) và đặc trưng bởi gia tăng sản xuất quá mức eosinophil gây độc tế bào. Tỷ lệ tử vong, ghép tim và MCS tăng đến 46% trong viêm cơ tim eosinophil do tăng phản ứng nhạy cảm. Chế độ điều trị phổ biến nhất trong bệnh cơ tim tăng bạch cầu ái toan bao gồm: corticoid, thỉnh thoảng kết hợp với azathioprine, Gegylated IFN (interferon)-alpha-2a hoặc mepolizumab tùy thuộc vào nguyên nhân gây bệnh [4].
Bảng 3: Lựa chọn điều trị trong viêm cơ tim tế bào khổng lồ và bệnh cơ tim do viêm tự miễn [3][17].
| THỂ BỆNH | THUỐC VÀ LIỀU DÙNG | |
| Viêm cơ tim tế bào không lồ |
♦ Liều 275mg/ 500ml dung dịch salin truyền 12h/24h ♦ Thời gian: 1-5 ngày. ♦ Theo dõi chặt chẽ trên monitor.
♦ Liều dùng: bắt đầu 200mg/24h (100mg/12h), liều điều trị: 100 – 200µg/ml ♦ Thời gian: 1 năm
♦ Liều khởi đầu: 1mg/kg. ♦ Sau 4 tuần: giảm liều 10mg, sau đó giảm 10mg/2 tuần cho đến khi đạt liều duy trì 5-10mg. ♦ Thời gian điều trị: 1 năm |
|
| Viêm cơ tim sarcoidosis |
♦ Liều khởi đầu: 1mg/kg. ♦ Sau 4 tuần: giảm liều 10mg, sau đó giảm 10mg/2 tuần cho đến khi đạt liều duy trì 5-10mg. ♦ Thời gian điều trị: 6 tháng |
|
| Viêm cơ tim mạn/tự miễn (bệnh cơ tim do viêm), viêm cơ tim tế bào Eosinophile. | · Azathioprine
♦ Liều dùng: 50mg/12h trong 6 tháng. ♦ Theo dõi: kiểm tra công thức máu và men gan mỗi tuần trong tháng đầu tiên. ♦ Xem xét thay đổi điều trị nếu BC< 3000 · Methylprednisolone ♦ Liều khởi đầu: 1mg/kg. ♦ Sau 4 tuần: giảm liều 10mg, sau đó giảm 10mg/2 tuần cho đến khi đạt liều duy trì 5-10mg. ♦ Thời gian điều trị: 6 tháng |
|
| Điều trị bổ sung cho tất cả các trường hợp: Omeprazole, Pantoprazole 20mg/24h; calcium 1g/24h. | ||
Ngược với những lợi ích của liệu pháp ức chế miễn dịch cho những trường hợp bệnh lý không thường gặp này, không khuyến cáo sử dụng thuốc ức chế miễn dịch truyền tĩnh mạch trong những trường hợp viêm cơ tim cấp tăng tế bào lympho không do virus. Những thử nghiệm lâm sàng phủ định, thực hiện từ thập niên 1980-1990, đều dựa tiêu chuẩn mô học hoặc tiêu chuẩn Dallas để xác định phản ứng viêm mà không có hiện tượng nhiễm virus. Những hạn chế này dẫn tới thúc đẩy phương pháp và nghiên cứu xác đnh viêm cơ tim tốt hơn và cố gắng xác định virus có ý nghĩa về lâm sàng. Chẩn đoán viêm cơ tim tăng lympho ở BN đòi hỏi sự hỗ trợ tuần hoàn dường như làm tăng cầu nối cho bệnh hồi phục [7][16].
Trường hợp sốc tim do viêm cơ tim cấp, các thuốc vận mạch như Milrinone, Levosimendane, Dobutamine hoặc MCS bao gồm cả hỗ trợ tuần hoàn ngoài cơ thể động tĩnh mạch (ECMO) là cầu nối để MCS dài hạn, ghép tim và hồi phục. ECMO làm gia tăng hậu tải của thất trái , nếu không mở lỗ thoát thất trái (LV venting), có thể gây dãn thất và phù phổi. Tăng hậu tải hoạt hóa con đường dẫn truyền cơ học trong tim (cardiac mechanotransduction pathways), integrins và protein liên quan integrin, viêm cơ tim. Sự kết hợp của tăng gánh và tăng tình trạng viêm làm bất lợi cho quá trình tái cấu trúc cơ tim. Những NC quan sát cho thấy chiến lược MCS làm giảm hậu tải có thể làm tăng sự hồi phục của tâm thất và thuyên giảm bệnh. Bóng dội ngược động mạch chủ (IABP) hay máy hỗ trợ thất lưu lượng từ mỏm như hệ thống Impella có thể hỗ trợ tuần hoàn ngoại biên với mức độ khác nhau và làm cầu nối cho bệnh hồi phục. các chiến lược dựa trên Impella có thể sử dụng đơn độc, hay phối hợp với ECMO (ECMO +Impella: ECMELLA ), phối hợp với Impella thất phải (Bi-PELLA), hoặc sử dụng Impella thất trái kéo dài (PROPELLA) [18][37].
- TẦM NHÌN TỪ NHỮNG THỬ NGHIỆM TRONG XỬ TRÍ BỆNH CƠ TIM DO VIÊM.
Điều trị dựa vào EMB dự kiến sẽ thay đổi bởi sự hiện diện của chủng virus, loại virus và lượng virus. Nghiên cứu đoàn hệ định nghĩa viêm cơ tim dựa vào EMB được ghi nhận và đề xuất trong các thử nghiệm lâm sàng bao gồm: virus(-)/ bệnh cơ tim tự miễn; BN dương tính với Enterovirus và Adenovirus, HPV6 và Parvovirus B19 được sắp xếp theo sự tán thành về lâm sàng.
- Bệnh cơ tim tự miễn do viêm/virus (-).
- Chế độ điều trị corticoid.
Đối lập với những nghiên cứu trước đây về bệnh cơ tim cấp nhưng tác nhân gây bệnh không được xác định. Những nghiên cứu gần đây ghi nhận ở những BN virus (-)/bệnh cơ tim dãn nở do viêm được thực hiện EMB khuyến cáo nên dùng thuốc ức chế miễn dịch với prednison và azathioprin có thể cải thiện chức năng tim. Một nghiên cứu gần đây sử dụng tiêu chuẩn hóa mô miễn dịch cho BN bệnh cơ tim dãn nỡ do viêm ghi nhận có hiệu quả trong liệu pháp ức chế miễn dịch với prednison và azathioprine. Tuy nhiên thời gian theo dõi ngắn <1 năm làm hạn chế ảnh hưởng và khả năng ứng dụng trong thực hành lâm sàng. Giới hạn khác của nghiên cứu này là thiếu nhóm chứng. Những nghiên cứu hồi cứu lớn hơn từ Trung tâm chuyên khoa về bệnh cơ tim Innsbruck và Maastricht cũng chứng minh mối liên quan giữa liệu pháp ức chế miễn dịch và tỉ lệ sống sót không cần ghép tim với điều trị suy tim chuẩn đơn thuần [8]. Nghiên cứu này bao gồm số BN bệnh cơ tim dãn nở lớn nhất cả về số lượng và thời gian (bao gồm cả nhóm chứng) cho tới nay với thời gian theo dõi 100 tháng. Quan điểm của AHA và ESC khác biệt về độ mạnh của các khuyến cáo trong việc sử dụng liệu pháp miễn dịch trên lâm sàng. Các chế độ điều trị có thể bao gồm: steroid kết hợp cyclosporine hoặc mycophenolat-mofetil hoặc sử dụng IgG miễn dịch thay thế ( immuno-adsorption with IgG substitution) [21]. Nguyên nhân thất bại trong điều trị ức chế miễn dịch ở bệnh cơ tim dãn nở do viêm vẫn còn đang được nghiên cứu bao gồm các nghiên cứu về hoạt động của virus, quá trình thay đổi của những phản ứng viêm không đúng mục tiêu của hướng điều trị đầu tiên [25].
Chúng ta đã biết tế bào lympho CD20B góp phần vào cơ chế bệnh sinh phá hủy cơ tim do độc chất trực tiếp, tăng cơ chế ảnh hưởng của tế bào lympho T, tăng hoạt tính của tế bào mono. Corticoid không có hiệu quả để ngăn chặn tế bào Lympho CD20B. Trong một nghiên cứu đơn trung tam, mối liên quan của tế bào CD20B trong giảm chức năng tim thường được miêu tả trong bệnh thấp tim, giống viêm khớp dạng thấp, viêm mô cơ (myositis) và tiếp theo là tình trạng tim mạch cải thiện sau điều trị với rituximab, là một kháng thể đơn dòng chống lại bề mặt tế bào lympho CB20B, ở những BN viêm cơ tim do lupus và thải ghép sau ghép tim. Dựa trên quan sát sự hiện diện Lympho CD20B trên EMB ở BN bệnh cơ tim dãn nở, với 63% BN không đáp ứng với corticoid là dương tính với tế bào Lympho CD20B, các nhà nghiên cứu giả thuyết rằng BN bị bệnh cơ tim dãn nở do viêm và dương tính với tế bào Lympho CD20B mà không ghi nhận tác nhân viêm cơ tim thì rituximab có thể cải thiện chức năng tim, cải thiện triệu chứng và dấu hiệu suy tim. Và các nghiên cứu tiếp theo vẫn đang được thực hiện [20].
- Bệnh cơ tim do viêm với virus (+):
- Enterovirus và Adenovirus.
– Interferon beta:
Các dữ liệu lâm sàng và kinh nghiệm cho thấy Enterovirus, Coxsackie B là các tác nhân gây viêm cơ tim cấp. Tuy nhiên, các thử nghiệm lâm sàng ngẫu nhiên của điều trị kháng virus chưa được ban hành trong liệu trình điều trị viêm cơ tim cấp. Vài kết quả thu được từ thử nghiệm pha 2: Betaferon trong bệnh cơ tim do virus mạn tính (BICC: Betaferon in chronic viral cardiomyopathy). NC so sánh điều trị ngẫu nhiên giữa 2 nhóm BN bệnh cơ tim do viêm với giả dược và IFN-β. Tất cả BN được chỉ định làm EMB chẩn đoán Enterovirus, Adenovirus hoặc B19V. 15 BN trong nghiên cứu dương tính với Enterovirus và Adenovirus qua EMB được điều trị khỏi hoàn toàn với INF-β [41]. Tuy nhiên, IFN-β không điều trị được virus B19-DNA. Kết quả này ghi nhận BN có nhiễm Enterovirus hoặc Adenovirus thì INF-β có vai trò thúc đẩy làm sạch virus. Hiệu quả này được chứng minh trên mục tiêu làm sàng nhưng về tử vong và ghép tim vẫn còn chưa chắc chắn [12].
- BN dương tính Human Herpesvirus type 6.
– Ganciclovir/Acyclovir/Valacyclovir:
Human Herpesvirus 6 (HHV-6) type A và B là những virus mang Lympho có đời sống dai dẳng và chủ yếu liên quan đến bệnh không do tim. Bộ gen virus được phát hiện ở BN viêm cơ tim cũng có thể gây ra bệnh cơ tim dãn nỡ do viêm. So với nhiễm B19V, nhiễm HHV -6 âm ỉ và ít ảnh hưởng đấn cơ tim. Nhiều trung tâm có kinh nghiệm tán thành việc sử dụng thuốc ức chế miễn dịch kết hợp thuốc kháng virus như: Ganciclovir, Acyclovir,hoặc Valacyclovir trong viêm cơ tim bùng phát do HHV6 và viêm cơ tim nặng [6].
- Parvovirus B 19 .
Đối lập với Enterovirus (virus ảnh hưởng lên tế bào cơ tim), B19V có thể gây nhiễm trùng nội mạc cơ tim và gây ra các rối loạn chức năng vi mạch, nội mạc và chức năng tâm trương. Vai trò bệnh học của B19V được chứng minh bởi sự gia tăng những vi phân tử nội mạc (endothelial microparticles) trong tuần hoàn, protein bọc ngoài virus VP 1 (Virus Protein-1) phá hủy tế bào sinh mạch máu nội mạch và nuôi cấy tế bào thực nghiệm chứng minh rằng B19V điều hòa quá trình viêm và chết theo chương trình ở tế bào nội mạc. Một số những dữ liệu khác cũng tán thành có sự tương đồng giữa B19V và kháng nguyên tim. Hiện tại, những nghiên cứu bổ sung rất cần thiết chứng minh vai trò của B19V trong viêm cơ tim cấp và các chiến lược điều trị chống B19V [49].
– Immunoglobulin: các Globulin miễn dịch truyền tĩnh mạch như IgG, IgA, và IgM đều có hiệu quả kháng viêm và kháng virus. Globulin miễn dịch truyền tĩnh mạch có thể thay thế kháng thể diệt hoàn toàn virus, trung hòa các tác nhân gây bệnh và xóa bỏ hoàn toàn các phản ứng viêm do các cytokine (các cytokine góp phần gây phá hủy tế bào cơ tim). Ở những BN bệnh cơ tim dãn nở không xác định được virus, globulin miễn dịch truyền tĩnh mạch không hiệu quả. Tuy nhiên, những nghiên cứu nhỏ và theo dõi sổ bộ không ngẫu nhiên ở BN bệnh cơ tim mạn tính bao gồm dựa trên EMB có B19V, B19V và Adenovirus, và CMV đã đề nghị một khả năng điều trị riêng cho nhóm này. Ở BN bệnh cơ tim dãn nở do viêm sau nhiễm B19V, các dữ liệu sổ bộ xác định các tình trạng lâm sàng có thể được cải thiện, nhưng chỉ tình trạng viêm, trong khi diệt B19V bị hạn chế. Nghiên cứu về hiệu quả của IgG đường tĩnh mạch để giảm lượng virus B19V ở BN bệnh cơ tim dãn nở có B19V dương tính với số lượng > 200 con/µg DNA sắp được hoàn thành [46].
– Telbivudine.
Telbivudine là một đồng phân nucleoid tổng hợp chống virus do ức chế tổng hợp nhân virus (ức chế tổng hợp phản ứng nhân đôi DNA và RNA) đặc biệt hiệu quả trên nhiễm viêm gan siêu vi B. Telbivudin ức chế các đặc tính tự miễn, kháng viêm, bảo vệ nội mạc, ức chế chết theo chương trình và chống oxy hóa. Bộ gen DNA của B19V có liên quan bệnh học với bệnh cơ tim dãn nở qua cơ chế sao chép đặc biệt rolling-hair- pin để nhân đôi phân tử ADN, sao chép tổng hợp ADN chuỗi 2 trong tái tạo virus viêm gan B. Telbivudin cũng tương tác với sự sao chép của B19V và được đánh giá làm cải thiện triệu chứng lâm sàng, diệt các mRNA virus ở những BN dương tính B19V. Do số liệu còn ít nên thuốc chưa được đề nghị dùng trên lâm sàng [44].
– Prednison và Azathioprine.
Theo các giải thuyết, đặc điểm trong bệnh tim do B19V có thể không có dấu hiệu nhiễm virus hoạt động và tình trạng viêm do virus, và điều trị ức chế miễn dịch có thể áp dụng. Nghiên cứu CAPACITY (Cortisone in Parvovirus inflammatory cardiomyopathy) ghi nhận điều trị ức chế miễn dịch với Prednison và azathioprine cùng với các thuốc điệu trị suy tim chuẩn ở những BN dương tính B19V có liên quan đến việc giải quyết tình trạng viêm, cải thiện chức năng tâm thu thất trái với điều kiện không có nhân đôi B19V. Hiện tại, chiến lược ức chế miễn dịch ở BN bệnh cơ tim dãn nở do viêm dương tính với B19V vẫn còn chưa chắc chắn và chưa được khuyến cáo [6].
Bảng 4: Lựa chọn điều trị ở BN dương tính với các virus đặc biệt [30][32].
| THỂ BỆNH | THUỐC VÀ LIỀU DÙNG | |
| Bệnh cơ tim do Enterovirus/Adenovirus |
Ø Liều dùng: 4M UI/48h tiêm dưới da/ trong tuần đầu tiên. Sau đó 8M UI/48h tiêm dưới da/ 2 tuần trong 6 tháng. Ø Theo dõi xét nghiệm: Clearance, men gan, tế bào máu, TSH, FT3, FT4, CK-MB trong 2 tuần đầu tiên, sau đó mỗi tháng. Ø Ngưng điều trị nếu TC< 100000 hoặc BC< 2000 |
|
| Bệnh cơ tim dương tính PVB19 |
Ø Liều dùng: 4M UI/48h tiêm dưới da/ trong tuần đầu tiên. Sau đó 8M UI/48h tiêm dưới da/ 2 tuần trong 6 tháng. |
|
| Bệnh cơ tim có triệu chứng do HHV-6 thể hoạt động. | · Ganciclovir
Ø Liều dùng: 1000mg/24h TM / 5 ngày. Sau đó Valganciclovir 900mg/24h-1800mg/24h trong 6 tháng. Ø Theo dõi xét nghiệm: Clearance, men gan, tế bào máu trong 2 tuần đầu tiên, sau đó mỗi tháng. Ø Ngưng điều trị nếu: giảm bạch cầu, thiếu máu hoặc viêm gan. |
|
- CHIẾN LƯỢC ĐIỀU TRỊ ĐIỀU HÒA MIỄN DỊCH MỚI .
Số lượng các thuốc điều trị kháng viêm theo theo cách đặc biệt riêng, đối lập với các NC trước đây, đang được thực hiện ở giai đoạn sớm để đánh giá lâm sàng. Những thuốc này chủ yếu điều hòa hiệu quả quá trình miễn dịch ban đầu và thích ứng tiếp theo.
- Ức chế IL-1β (Interleukin-1 β).
Il-1β là một cytokin tiền viêm then chốt, khuếch đại đáp ứng miễn dịch bẩm sinh. Nguyên ủy của IL-1 β là yếu tố viêm, cấu trúc bào thể gồm protein thích ứng là procaspas-1 và một phân tử mẫn cảm. Thuộc tính kháng viêm đặc trưng nhất của phân tử mẫn cảm là NLRP3 (nucleotide-binding domain and leucine-rich repeat pyrin domain containing-3). NLRP-3 được hoạt hóa bởi các tác nhân gây nhiễm bao gồm coxsackievirus B3(CVB3)-RNA. Bằng việc kích thích nội sinh làm phá hủy các phân tử như: protein sốc nhiệt, bẻ gẫy các liên kết trong tế bào, oxi hóa protein, ATP, tinh thể clolesterol và protein S100. Sự hoạt hóa của chất gây viêm NLRP3, procaspase-1 bị biến đổi hoạt tính caspase-1 làm tách proIL-1 thành IL-1 β trưởng thành. Các số liệu thực nghiệm ghi nhận yếu tố viêm NLRP3 đóng vai trò trung tâm trong viêm cơ tim. Vì vậy, hướng điều trị là ngăn chặn đường IL-1 bao gồm IL-Ra (đối kháng thụ thể IL-1) tên anakinra, là kháng thể đơn dòng toàn phần kháng IL-1β- IgG, canakinumab và colchicine là những thuốc tiềm năng để điều trị viêm cơ tim. Ghi nhận từ các nghiên cứu quan sát cho thấy giảm mRNA- NLRP3 trên EMB ở những BN dương tính CVB3, và những BN này sẽ loại trừ hoàn toàn CVB3 cũng như sẽ cải thiện chức năng tim theo thời gian [1][2].
1.1 Anakinra.
Những nghiên cứu trước đây do Ikonomidin và CS trên những BN viêm khớp dạng thấp không suy tim ghi nhận có hiệu quả gián tiếp của liệu pháp chẹn IL-1 trên chức năng tim [22]. Anakinra đã từng được đánh giá trong các thực nghiệm lâm sàng ở BN bệnh lý tim mạch rất phổ biến bao gồm nhồi máu cơ tim cấp (VCU-Virginia Commonwealth University Anakinra remodeling Trial)-1 và VCU-ART2 (nghiên cứu dẫn đường-pilot); suy tim mất bù cấp, suy tim với chức năng tâm thu thất trái bảo tồn, viêm màng ngoài tim vô căn tái phát. Một cách ngắn gọn, Anakinra làm mất đáp ứng viêm cấp mà có liên quan đến nhồi máu cơ tim cấp ST chênh lên. Mặc dù thuốc không cho thấy hiệu quả có ý nghĩa thống kê về cải thiện chức năng co bóp thất trái (EF) trong nghiên cứu đoàn hệ trên BN lâm sàng ổn định với đường kính thất trái và EF gần bình thường, nhưng nó làm giảm tần suất BN mắc suy tim hơn. Độ an toàn và hiệu quả của Anakinra trong giai đoạn nhồi máu cơ tim cấp ST chênh lên sẽ được nghiên cứu nhiều hơn tại các nghiên cứu mù đôi, ngẫu nhiên, đa trung tâm và có nhóm chứng theo dõi tới 12 tháng [50].
Trường hợp suy tim tâm thu mất bù gần đây điều trị Anakinra 12 tuần (không phải 2 tuần) giúp cải thiện tiêu thụ oxy đỉnh (peak Vo2), gợi ý hiệu quả điều trị Anakinra kéo dài. Trường hợp suy tim với chức năng tâm thu thất trái bảo tồn, Anakinra trong 14 ngày làm giảm có ý nghĩa đáp ứng viêm, cải thiện khả năng gắng sức ở BN suy tim với chức năng tâm thu thất trái bảo tồn có CRP trong máu tăng. Tuy nhiên điều trị Anakinra 12 tuần thất bại với cải thiện tiêu thụ oxy đỉnh ở nhóm BN béo phì suy tim với chức năng tâm thu thất trái bảo tồn. Ở những BN viêm màng ngoài tim tái phát phụ thuộc corticoid và đề kháng colchicin, Anakinra là giảm nguy cơ tái phát khoảng trên số trung vị 14 tháng. Một số BN viêm cơ tim toàn phát (funminat) bổ sung Anakinra cùng với điều trị chuẩn giúp hồi phục hoàn toàn. Một nghiên cứu ngẫu nhiên và mù đôi pha IIb đánh giá Anakinra (Anakinra và giả dược trong điều trị viêm cơ tim cấp) vẫn đang được tiến hành [43].
1.2. Canakinumab.
Kháng thể đơn dòng chống IL-1β tên là Canakinumab cho thấy làm giảm nồng độ Hs-CRP, IL-1β, IL-6 một cách an toàn ở những BN có bệnh mạch vành ổn định (nghiên cứu CANTOS: Canakinumab Anti-inflammatory thrombisis outcome study). Hiệu quả của Canakinumab cần được chứng minh trong bệnh cảnh viêm cơ tim [45].
1.3. Colchicine.
Colchicine là một loại alkaloid thực vật được sử dụng trong các thập kỷ trước để điều trị bệnh Gout. Về dược lực học, colchicine tương tác với protein trong các ống nhỏ khung tế bào (cytoskeleton protein tubulin ) làm phá vỡ các quá trình trong tế bào phụ thuộc cytoskeleton bao gồm: di chuyển, phân bào, hóa ứng động, tính kết dính, đầu tiên với neutrophil. Tác nhân gây viêm NLRP3 và tiếp theo là sản phẩn của IL-1β cũng bị ức chế bởi colchicine. Hơn nữa, đặc điểm của colchicine là bảo vệ nội mô và chống xơ hóa. Colchicine được chứng minh là cải thiện hiệu quả về tim mạch trong các rối loạn phản ứng viêm ở tim bao gồm viêm màng ngoài tim, bệnh động mạch vành và hội chứng sau phẫu thuật tim.
Năm 2015, ESC đưa ra khuyến cáo điều trị viêm màng ngoài tim, colchicine là điều trị đầu tiên. Tuy có sự chồng lấp về cơ chế bệnh sinh giữa viêm cơ tim và viêm màng ngoài tim nhưng colchicine được chứng minh có lợi ích trên viêm cơ tim. Gultekin và CS ghi nhận một số ít trường hợp cải thiện chức năng co bóp cơ tim trên 5 BN viêm cơ tim được điều trị liều thấp colchicine kết hợp chế độ điều trị suy tim tối ưu. Kết quả âm tính của colchicine trong thí nghiệm trên chuột C3H tạo CVB3 chứng tỏ rằng colchicine có thể là lựa chọn thích hợp nhất trong phân nhóm nhỏ bệnh nhân có phenotype miễn dịch đặc biệt [35].
- Ức chế HMGB1.
HMGB1 (high-mobility group box-1) là một protein nhân ở khắp cơ thể có liên quan với sự sao chép chuyển mã và sửa chữa DNA, nó được phóng thích một cách thụ động bởi mô hoại tử và tiết chủ động khi tế bào bị stress. Nồng độ của những mô phân tử bị phá hủy tăng trong EMB và trong huyết tương của BN viêm cơ tim cấp. Trong thực nghiệm ở chuột gắn troponin I miễn dịch, HMGB1 tăng trong cơ tim và huyết thanh. Ức chế HMGB1 trong các mẫu này làm giảm mô bị phá hủy. Những nghiên cứu bổ sung rất cần thiết để xác định cơ chế và là nền tảng cho các nghiên cứu quan sát sau này. Ngoài ra, HMGB1 có thể là liệu pháp trúng đích trong viêm cơ tim tự miễn [36].
- Ức chế S100A9.
Các phân tử mô liên quan tổn thương, gọi là alarmins, S100AS và S100A9 [tên thay thế MRP8 (protein liên quan tủy- myeloid related protein) và MRP14 tương ứng], đều là các protein gắn Canxi thuộc họ S100. Chúng chủ yếu tạo nên chất nhị trùng khác nhau (heterodimer ) S100A8/S100A9 có chức năng sinh lý và yếu tố tiền viêm trong các tình trạng khác nhau, trong khi chất nhị trùng giống nhau (homodimers ) S100A8 và S100A9 là tiền viêm. Các alarmin này được tiết nhiều do tế bào neutrophil và monocyte được phóng thích trong suốt quá trình đáp ứng viêm. Trong viêm cơ tim, những BN dương tính CVB3 tiết nhiều S100A8 và S100A9 biểu hiện trên EMB hơn BN âm tính với CVB3. Sự giảm tiết S100A8 và S100A9 trong cơ tim có liên quan đến cải thiện lâm sàng ở những BN dương tính CVB3, đây là những BN tăng virus CVB3 trong suốt thời gian bệnh. Dựa vào sự tương hợp của S100A8-S100A9 trong bệnh viêm cơ tim dương tính CVB3 và những dữ liệu về hoạt động của S100A8-S100A9 hoạt hóa yếu tố viêm NLRP3, S100A8/S100A9 là mục tiêu thu hút điều trị trong trường hợp viêm cơ tim do CVB3.
Trong các thử nghiệm lâm sàng về viêm cơ tim tự miễn không do virus, S100A8 được tìm thấy ở protein cơ tim dự đoán hồi phục do DCM sau điều trị. Những dữ liệu này cũng ghi nhận S100A8 trong EMB hoặc S100A8/S100A9 trong huyết thanh được sử dụng chọn lọc ở những BN có chỉ định điều trị liệu pháp miễn dịch do viêm cơ tim. Những dữ liệu lâm sàng truyền thống và một số NC mới ghi nhận có sự liên quan giữa nồng độ S100A8/S100A9 cao và nguy cơ nhồi máu cơ tim cũng như tử vong do tim mạch trong tương lai ở những người khỏe mạnh. Giá trị của S100A8-S100A9 như là chất đánh dấu sinh học của viêm cơ tim vẫn còn đang được nghiên cứu [36].
- ĐỊNH HƯỚNG TƯƠNG LAI VỀ XỬ TRÍ VIÊM CƠ TIM CẤP.
Từ khi các thử nghiệm điều trị viêm cơ tim gần 25 năm được xuất bản cho đến nay, dù có nhiều hiểu biết đáng kể vể cơ chế bệnh sinh nhưng có rất ít tiến bộ đáng kể trong điều trị trên lâm sàng. Chẩn đoán viêm cơ tim qua sinh thiết nội mạc cơ tim cho phép chỉ định các liệu pháp điều trị đặc hiệu đối với GCM, viêm cơ tim tăng bạch cầu ái toan, và tiên lượng chính xác hơn với BN cần phải hỗ trợ tuần hoàn cơ học.
Giá trị tiên lượng của các chủng virus trên mô cơ tim rất khác nhau tùy thuộc loại virus. Không có một liệu pháp kháng virus nào được đưa ra trong các thực nghiệm lâm sàng hoặc nghiên cứu phù hợp để làm giảm nguy cơ tử vong hay ghép tim trong bệnh cảnh viêm cơ tim cấp. BN viêm cơ tim mạn tính không có gen virus trên EMB có thể đáp ứng với azathioprine và prednison, sau khi áp dụng các biện pháp điều trị nội khoa tối ưu. Nhiều thử nghiệm can thiệp đang được tiến hành dựa vào đặc điểm của EMB và hy vọng EMB có thể được sử dụng rộng rãi trong thời gian tới. Những BN được chỉ định EMB nên được thực hiện với sự cân nhắc kỹ vì chúng ta còn những vấn đề chưa rõ trong chiến lược điều trị viêm cơ tim. Những điều chưa chắc chắn này là nền tảng đưa ra sự khác biệt về mức khuyến cáo giữa các hướng dẫn và vai trò của EMB trong viêm cơ tim cấp.
Phân tích chi tiết dựa trên EMB từ các NC chuyển tiếp (translational studies-xem giải thích ở cuối bài***) dẫn tới xác định những dấu hiệu chẩn đoán và tiên lượng mới khác biệt với những dữ liệu khổng lồ không đồng nhất trước đây ở BN viêm cơ tim trong các theo dõi nhỏ mà có thể có lợi từ các can thiệp cá thể hóa. Như vậy, lĩnh vực này vẫn còn sơ khai và dữ liệu thể hiện lợi ích điều trị dựa trên nguyên nhân còn hạn chế do thiếu những thử nghiệm lâm sàng lớn và ngẫu nhiên. Trở ngại lớn nhất để thiết kế những thử nghiệm mạnh và phù hợp để đạt những tiến bộ lâm sàng là do rất hiếm BN viêm cơ tim cấp và nặng và tỉ lệ thành công cao với điều trị theo guideline. Hiểu biết thu được từ các phân tich mô học không đủ giá trị để nghiên cứu và tiến bộ trong nhận thức để áp dụng vào thực hành lâm sàng. Giờ là cơ hội cho các nghiên cứu lớn và ngẫu nhiên dựa vào tác nhân gây bệnh để đánh giá các liệu pháp đặc hiệu trúng đích.
- KẾT LUẬN.
Bệnh tim sau nhiễm virus thường xảy ra và không được chú ý. Từ đó có thể là nguyên nhân tiềm tàng dẫn đến dãn buồng tim và suy tim. Những NC gần đây ghi nhận sự tồn tại và sao chép gen của virus trong cơ tim dẫn đến phá hủy lớp nội mạc cơ tim thông qua cơ chế miễn dịch là giai đoạn tiếp theo của bệnh. Điều trị tối ưu của bệnh cơ tim dãn nở sau viêm bao gồm ức chế men chuyển/ ức chế thụ thể, ức chế beta, lợi tiểu có hay không kèm các thuốc ức chế miễn dịch đặc biệt. Vai trò của EMB cũng cần được xem xét vì giá trị của nó trong thực hành. Tuy nhiên cần hết sức thận trọng vì chúng ta còn thiếu kinh nghiệm. Chúng tôi hy vọng bài viết này sẽ cung cấp những thông tin cần thiết giúp các bác sỹ lâm sàng có thêm cái nhìn mới về các liệu pháp đặc trị trong bệnh cơ tim sau viêm từ đó có thêm các sự lựa chọn trong điều trị, giúp cải thiện tình trạng bệnh và các biến chứng không mong muốn có thể xảy ra trên BN.
***Giải thích nghiên cứu chuyển tiếp (translational studies):
– Sơ đồ phác họa các giai đoạn trong nghiên cứu chuyển tiếp:
T1: đang phát triển các hướng điều trị và can thiệp.
T2: kiểm tra hiệu quả và ảnh hưởng của các hướng điều trị và can thiệp.
T3: nghiên cứu rộng rãi và nghiên cứu ứng dụng để thay đổi hệ thống trên diện rộng
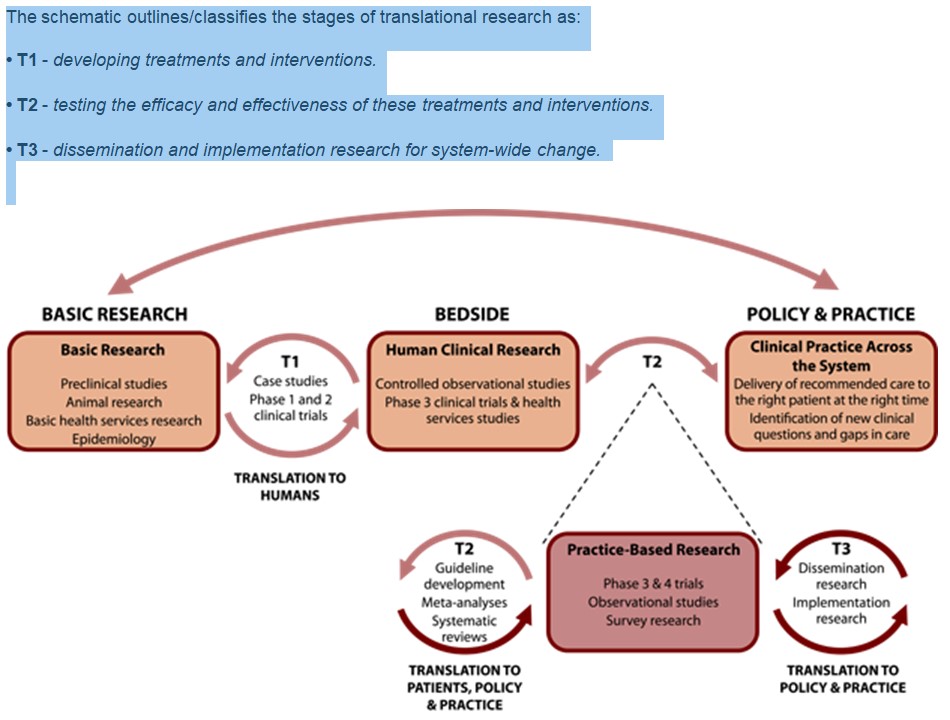
Hình 4.
TÀI LIỆU THAM KHẢO.
- Abbate A et al, “ Interleukin-1 blockade with anakinra to prevent adverse cardiac remodeling after acute myocardial infarction”, Am J Cardiol, 2010; 105: e1371-e1377.
- Abston ED et al, “ Biomarkers of heart failure in myocarditis and dilated cardiomyopathy”, 2011: e321-e348. www.intechopen.com.
- Ammirati E et al, “ Changes of late gadolinium enhancement extension compared with native T1 maping early after acute myocarditis”, Int J Cardiol, 2018: 257.
- Ammirati E et al, “ Survival and left ventricular function changes in fulminant versus nonfulminant acute myocarditis”, Circulation, 2017; 136: e529-e545.
- Baughman KL et al, “ Diagnosis of myocarditis: death of Dallas criteria”, Circulation, 2006; 113: e593-e595.
- Bachelier K et al, “ Parvovirus B19-induced vascular damage in the heart is associated with elevated circulating endothelial microparticles”, PloS One, 2007; 12: e176311.
- Bleeker JS et al, “ Treatment refractory idiopathic hypereosinophilic syndrome: pitfalls ang progress with use of novel drugs”, Am J Hematol, 2012; 87: e703-e706.
- Boehmer JP et al, “ Left ventricular assist device support andmyocardial recovery inrecent onset cardiomyopathy”, J Card Fail, 2012; 18: e755- e761.
- Bozkurt B et al, “ American Heart Association Committee on Heart Failure and Transplantation of the Council on Clinical Cardiology: Current diagnostic and treatment strategies for specific dilated cardiomyopathies”, Circulation,2016; 134: e579-e646.
- Camm AJ et al, “ An update og the 2010 ESC guidlines for the management of atrial fibrillation developed with the special contribution of the European Heart Rhythm Association”, Europace, 2012; 14: e1385-e1413.
- Cardiomyopathy- Patient Uptodate 2015.
- Cognet T et al, “ A family history of dilated cardiomyopathy induced by viral myocarditis”, 2012. Cas Report in Cardiology, Volume 12: e1-e3.
- Cooper LT et al, “ The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association”, Circulation, 2007; 16:e2216- e2233.
- Chow LH et al, “Insensitivity of right ventricular endomyocardial biopsy in the diagnosis of myocarditis”, J Am Coll Cardiol, 1989; 14: e915-e920.
- Dilated and restrictive cardiomyopathies, disease management, Cleveland clinic, 2016.
- Ekstrom K et al, “ Long-term outcome and predictors in giant cell myocarditis”, Eur Heart J, 2016; 18: e1482-e1458.
- Dominguez F et al, “ Update on myocarditis and inflammatory cardiomyopathy: Reemergence of endomyocardial biopsy”, Rev Esp Car, 2016; 69: e178-e187.
- Ferreira MV et al, “Cardiovascular magnetic resonance in nonischemic myocardial inflammation”, JACC Sci Expert Panel, 2018;72: e3158-e3176.
- Francis R et al, “ Techniques and indications”, Heart, 2018; 104: e950-e958.
- Felix SB et al, “Hemodynamic effects of immunoadsorption ans subsequent immunoglobulin substition in dilated cardiomyopathy: three month results from a randomized study”, J Am Coll Cardiol , 2000; 35: e1590-e1598.
- Hsu KH et al, “ Extracorporeal membranous oxygenation support for acute fulminant myocarditis: analysis of a single center’s experience, Eur J Cardiothorac Surg”, 2011; 40: e682-e688.
- Ikonomidis I et al, “ Inhibition of IL-1 by anakinra improves cascular and left ventricular function on in patients with rheumatoid arthritis’, Circulation, 2009;117: 2662-e2669.
- Kindermann I et al, “ Predictors of outcome in patients with suspected mypcarditis”, Circulation, 2008, 118: e 639-e648.
- Kruyer WB et al, “ Cardiomypathy”, Aerospace Medical Association, 2010. www.asams.org.
- Latham RD et al, “Recently diagnosed idiopathic dilated cardiomyopathy: incidence of myocarditis and efficacy of prednisone therapy”, Am Heart J, 1989; 117: e876-e882.
- Lurz P et al, “ Comprehensive cardiac magnetic resonance imaging in patients with suspected myocarditis: the myoracer-trial”, J Am Coll Cardiol, 2016; 67:e1800-e1811.
- Lurz P et al, “ Diagnostic performance of CMR imaging compared with EMB in patients with suspected myocarditis”, JACC Cardiovasc Imaging, 2012; 5: e513-e524.
- Leone O et al, “ 2011 consensus statement on endomyocardial biopsyfrom the Association for European Cardiovascular pathology and the Society for cardiovascular pathology”, Cardiovascular pathol, 2012; 21:e245-e274.
- Mason JW et al, “ Myocarditis and dilated cardiomyopathy: An inflammatory link”, Eur S Car, 2003; 60: e5-e10
- Maisch B et al, “ Treatment of inflammatory dilated cardiomyopathy and myocarditis with immunosuppression and i.v immunoglobulins”, Herz:2004; 29: e624-e636.
- Mancio J et al, “ Acute right ventricular myocarditis presenting with chest pain and syncope”, BMJ Case Rep, 2013. www.ncbi.nlm.nih.gow/pubmed/24096068.
- Maisch B et al, “ Treatment options in myocarditis and inflammatory cardiomyopath: focus on i.v immunoglobulins”, Herz, 2018; 43: e423-e430.
- McNamara DM et al, “ Controlled trial of intravenous immune globulin in recent onset dilated cardiomyopathy”, Circulation, 2001; 103: e2254-e2259.
- Merken J et al, “ Immunosuppressive therapy improves both short and long term prognosis in patients with virus-negative nonfulminant inflammatory cardiomyopathy”, Circ Heart F, 2018; 11: e4228.
- Musumeci et al, “ An overview on HMGB1 inhibitors as potential therapeutic agents in HMGB1 related pathologies”, Pharmacol Ther, 2014; 141: e347-e357.
- Muller I et al, “ S100A8/S100A9 alarmin as a potential biomarker in patients with active myocarditis”, clin Res Cardiol, 2018; 107: e 1163.
- Mason JW et al, “ A clinical trial of immunosupprressive therapy for myocarditis, the myocarditis treatment trial investigators”, N Engl J Med, 1995; 333: e269-e275.
- Myocarditis and cardiomyopathy, cardiomyopathy.org
- Pinto YM et al, “ Proposal for a revised definition of dilated cardiomyopathy, hypokinetic non-dilated cardiopathy, and its implications for clinical practice: a position statement of the ESC working group on myocardial and pericardial disease:, Eur Heart J, 2016; 37: e1850-e1858.
- Ponikowski P et al, “Guidlines for the diagnosis and treatment of acute and chronic heart failure”, Eur Heart J, 2016; 18: e891-e975.
- Shanbhag SM et al, “ Prevalenceand prognosis of ischaemic and non-ischaemic myocardial fibrosis in alder adults”, Eur Heart j, 2019: 40: e529-e538.
- Schultheiss HP et al, “ Betaferon in chronic viral cardiomyopathy (BICC) trial: Effects of interferon-beta treatment in patients with chronic viral cardiomyopathy”, Clin Res Cardiol, 2016; 105: e763-e773.
- Smilde BJ et al, “ Colchicine aggravates coxsackievirus B3 infectionin mice”, Int J Cardiol”, 2016; 216: e58-e65.
- Sutterwala FS et al, “ Mechanism of NLRP3 inflammasome activation”, Ann N Y Acad Sci, 2014; 1319: e82-e95.
- Remes J et al, “Clinical outcome and left ventricular function 23 years after acute coxsackie virus myopericarditis”, Eur Heart J, 1990; 11: 182-188.
- Ridker PM et al, “ Antiinflammatory therapy with canakinumab for atheroclerotic disease”, N Eng J Med, 2017;377: e1119-e1131.
- Tschope C et al, “ Immunosuppression in lymphocytic myocarditis with parvovirus B19 presence”, Eur J Heart Fail, 2018; 20: e609.
- Tschope C et al, “ Management of myocarditis-related Cardiomyopathy in Adults”, Circ Res, 2019; 124: e1568-e1583.
- Tschope C et al, “ How to perform an endomyocardial biopsy”, Turk Kardiyol Dern Ars, 2015, 43: e572-e575.
- Van Linthout S et al, “ Telbivudine in chronic lymphocytic myocarditis and human parvovirus B19 transcriptional activity”, ESC Heart Fail, 2018; 5: e818-e829.
- Van Tassell BW et al, “ IL-1 blockade in patients with heart failure with preserved ejection fraction”, Circ Heart Fail, 2018; 11: e5036.
- Wojnicz R et al, “ Randomized, placebo-controlled study for immunosuppressive treatment of inflammatory dilated cardiomyopathy: two year follow-up results”, Circulation, 2001; 104:e39-e45.
- Wu LA et al, “ Current role of endomyocardial biopsy inthe management of dilated cardiomyopathy and myocarditis”, Mayo Clin, 2001; 76: e1030-e1038.








