TS. PHẠM HỮU VĂN
11.3.10.3 Điều trị lâu dài
Nếu không mong muốn triệt phá hoặc không khả thi ở những bệnh nhân AVRT kích thích sớm và có triệu chứng, trong đó bệnh tim do thiếu máu cục bộ hoặc thiếu máu cục bộ đã được loại trừ, thuốc chống loạn nhịp nhóm IC hoạt động chủ yếu trên AP và có thể được sử dụng trong nhịp nhanh thể antidromic (Hình 21) . [429,437,444,445] Trong trường hợp AF có kích thích sớm, cần thận trọng không chuyển thành cuồng nhĩ và gây ra dẫn truyền 1: 1. Ngoài các thuốc nhóm IC, thuốc chẹn beta, diltiazem hoặc verapamil cũng có thể được xem xét trong trường hợp nhịp nhanh thể orthodromic nếu các dầu hiệu của kích thích sớm được nhận thấy trên ECG lúc nghỉ. [340,341,442,443]
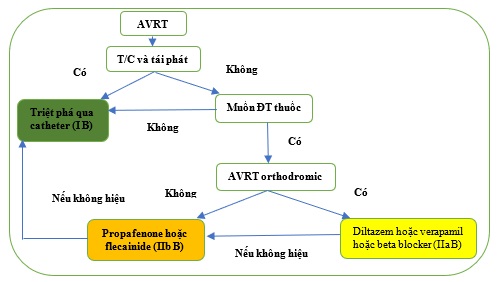
Hình 21. Điều trị lâu dài nhịp nhanh vào lại nhĩ thất. AVRT = nhịp nhanh vào lại nhĩ thất. ĐT = điều trị.
11.3.11 Bệnh nhân kích thích sớm không triệu chứng
Đại đa số bệnh nhân có mẫu WPW không triệu chứng sẽ trải qua cuộc sống mà không có bất kỳ biến cố lâm sàng nào liên quan đến kích thích sớm tâm thất. Khoảng một phần năm (1/5) bệnh nhân sẽ bị rối loạn nhịp tim liên quan đến AP trong quá trình theo dõi. Rối loạn nhịp tim phổ biến nhất ở bệnh nhân có hội chứng WPW là AVRT (80%), sau đó là tỷ lệ AF 20% 30%. Đột tử do tim thứ phát do AF bị kích thích sớm do dẫn truyền nhanh đến tâm thất qua AP, dẫn đến rung thất, là biểu hiện đáng sợ nhất của hội chứng WPW. Nguy cơ ngừng tim / rung thất được ước tính là 2,4 / 1000 người mỗi năm (khoảng tin cậy 95% 1,3 .93,9), nhưng không có trường hợp tử vong nào được báo cáo trong sổ đăng ký của 2169 bệnh nhân trong thời gian theo dõi 8 năm. [439] Tuy nhiên, trong một cơ quan đăng ký của Đan Mạch gồm 310 cá nhân bị kích thích sớm (độ tuổi 8 – 85 tuổi), có nguy cơ mắc AF và HF cao hơn, do AP vách trước phải, và ở những bệnh nhân > 65 tuổi cũng có nguy cơ tử vong cao hơn có ý nghĩa thống kê. [22]
Các đặc điểm lâm sàng và điện sinh lý liên quan đến tăng nguy cơ đột tử tim gồm tuổi trẻ hơn, [439,449,450] khả năng gây nhịp tim nhanh qua AV trong EPS, [450, 454454] nhiều AP, [450.451.455.456] và chứng minh khả năng của AP dẫn nhanh đến tâm thất. [439,450,451,453 – 456] Các biến này bao gồm khoảng RR được kích thích sớm ngắn nhất trong quá trình AF (shortest pre-excited RR interval: SPERRI) 250 ms tại đường cơ sở hoặc thời gian trơ xuôi chiều có hiệu quả ngắn (short antegrade effective refractory period: ERP) của AP (≤ 250 ms). [439,450–452,454–460] Với test không thâm nhập, nhận biết sự bình thường hóa đột ngột và hoàn toàn của khoảng PR với sự mất đi của sóng delta trong test gắng sức, hoặc sau khi dùng procainamide, propafenone, hoặc dispopyramide, đã được xem xét là chỉ dấu nguy cơ thấp. [459,461–463] Độ nhạy catecholamine là yếu tố hạn chế chính của tất cả các xét nghiệm, cả hai xâm lấn [452,460] và không xâm lấn, và test gắng sức. [459,461,462] Mất không liên tục kích thích sớm trên ECG lúc nghỉ hoặc theo dõi lưu động cũng được kết hợp với AP và ERPs kéo dài hơn, và được chấp nhận như là thước phân tầng nguy cơ đáng tin cậy. [2,464] Tuy nhiên, một số nghiên cứu gần đây, gồm cả bệnh nhân có triệu chứng và không có triệu chứng, đã chỉ ra hơn một phần năm (1/5) số bệnh nhân có kích thích sớm không liên tục có AP ERPs <250 ms. Do đó, tiền kích thích không liên tục hiện được công nhận là chỉ dấu không hoàn hảo của AP có nguy cơ thấp. [406.462.465-469]
Trong 30 năm qua, một bộ tài liệu đáng kể đã được xuất bản tập trung vào chủ đề quan trọng của việc đánh giá và quản lý bệnh nhân bị kích thích sớm không triệu chứng. Những ấn phẩm này bao gồm những ấn phẩm mô tả các đặc điểm lâm sàng và điện sinh lý của bệnh nhân bị kích thích sớm khi bị ngừng tim, [439.451.455.459] và hàng loạt bệnh nhân bị kích thích sớm có triệu chứng hoặc không có triệu chứng, được theo dõi trong thời gian khác nhau [22, 405, 439, 449, 450, 454, 456, 470-472] Trong số những nghiên cứu này, có một RCT triệt phá qua catheter tiền cứu (37 bệnh nhân) so với theo dõi lâm sàng không cần điều trị (35 bệnh nhân) bệnh nhân bị kích thích sớm không triệu chứng. [453] Triệt phá qua catheter làm giảm tần suất các biến cố loạn nhịp tim (7 so với 77%, P <0,001) trong 5 năm. Một bệnh nhân trong nhóm đối chứng có một cơn rung thất đã được chuyển nhịp.
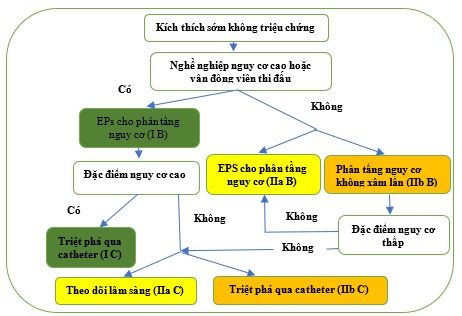
Hình 22 tóm tắt các khuyến cáo cho việc tâm soát và điều chỉnh các bệnh nhân có kích thích sớm không triệu chứng.
Hình 22. Phân tầng nguy cơ và điều trị của bệnh nhân bị kích thích sớm không có triệu chứng. Các đặc điểm nguy cơ cao trong nghiên cứu điện sinh lý là khoảng RR ngắn nhất trong thời gian rung tâm nhĩ ≤250 ms, thời gian trơ có hiệu quả của đường phụ ≤250 ms, nhiều đường phụ và nhịp nhanh vào lại nhĩ thất có thể tạo ra. Các đặc điểm nguy cơ thấp trong phân tầng nguy cơ không xâm lấn được gây ra hoặc mất kích thích sớm không liên tục trên test gắng sức hoặc thuốc, điện tâm đồ lúc nghỉ, và điện tâm đồ theo dõi liên tục. EPS = nghiên cứu điện sinh lý.
Khuyến cáo cho điều chỉnh các bệnh nhân với kích thích sớm không triệu chứng
| Các khuyến cáo | Classa | Levelb |
| Thực hiện EPS, với việc sử dụng isoprenaline, được khuyến cáo để phân tầng nguy cơ các cá nhân bị kích thích sớm không triệu chứng, những người có nghề nghiệp / sở thích có nguy cơ cao, c và những người tham gia ở các vận động viên cạnh tranh. [439,450-452,454-460] |
I |
B |
| Triệt phá qua catheter được khuyến cáo ở những bệnh nhân không có triệu chứng trong đó test điện sinh lý với việc sử dụng isoprenaline nhận định các đặc tính nguy cơ cao, như SPERRI ≤ 250 ms, AP ERP ≤ 250 ms, nhiều AP và nhịp tim nhanh do AP có thể tạo ra. [439,450,52,454-460] |
I |
B |
| Triệt phá qua catheter được khuyến cáo ở những bệnh nhân bị kích thích sớm không có triệu chứng có nguy cơ cao sau khi thảo luận về các nguy cơ, đặc biệt là block tim liên quan đến triệt phá các AP vách trước hoặc và MS (vách giữa), và lợi ích thủ thuật. [439,440,473-476] |
I |
C |
| Thực hiện EPS để phân tầng nguy cơ các cá nhân bị kích thích sớm không có triệu chứng nên được xem xét. [439,450-452,454-460] | IIa | B |
| Đánh giá không xâm lấn các đặc tính dẫn truyền của AP ở những người bị kích thích sớm không triệu chứng có thể được xem xét. [459,461-463,465-469] |
IIb |
B |
| Phân tầng nguy cơ xâm lấn với EPS được khuyến cáo ở những bệnh nhân không có đặc điểm tính “nguy cơ thấp” trong phân tầng nguy cơ không xâm lấn. [462,463,465-469,477] |
I |
C |
| Theo dõi lâm sàng nên được xem xét ở một bệnh nhân bị kích thích sớm không có triệu chứng và AP có nguy cơ thấp trong phân tầng nguy cơ xâm lấn. [450,52,456,463,477] |
IIa |
C |
| Triệt phá qua catheter có thể được xem xét ở một bệnh nhân bị kích thích sớm không có triệu chứng và AP có nguy cơ thấp trong phân tấng nguy cơ xâm lấn hoặc không xâm lấn. [405,450,52,456,463,477] | IIb | C |
| Triệt phá qua catheter nên được xem xét ở những bệnh nhân bị kích thích sớm không có triệu chứng và rối loạn chức năng LV do rối loạn đồng bộ về điện học. [478-481] |
IIa |
C |
| Triệt phá qua catheter có thể được xem xét ở những bệnh nhân bị kích thích sớm không có triệu chứng nguy cơ thấp ở các trung tâm có kinh nghiệm phù hợp theo sở thích của bệnh nhân. [203, 439, 450, 453, 454, 471, 474, 482] |
IIb |
C |
AP = đường phụ; EPS = nghiên cứu điện sinh lý; ERP = thời ký trơ có hiệu quả; LV = thất trái; MS = vách giữa; SPERRI = khoảng thời gian RR bị kích thích sớm ngắn nhất trong quá trình rung nhĩ (shortest pre-excited RR interval during atrial fibrillation).
aClass của khuyến cáo.
bMức độ bằng chứng.
cNhư phi công và các lái xe chuyên nghiệp.
Sàng lọc xâm lấn bằng EPS nên được thực hiện ở những bệnh nhân bị kích thích sớm không có triệu chứng, những người có nghề nghiệp có nguy cơ cao hoặc là vận động viên cạnh tranh (Hình 22). Các biến số trên EPS xác định bệnh nhân có AP có nguy cơ cao bao gồm SPERRI ≤ 250 ms, AP ERP ≤ 250 ms, nhiều AP và nhịp tim nhanh qua trung gian AP có thể gây ra ở trạng thái cơ bản hoặc trong quá trình truyền isoproterenol, luôn luôn phải được thử. [452,460] Các lựa chọn sàng lọc bệnh nhân không thuộc các nhóm này bao gồm sử dụng EPS làm công cụ phân tầng nguy cơ hoặc sử dụng sàng lọc không xâm lấn với test gắng sức, test thuốc và theo dõi lưu động như là một công cụ phân tầng nguy cơ.
Nếu một bệnh nhân trải qua sàng lọc với EPS và được phát hiện có AP với các đặc điểm nguy cơ cao, nên triệt phá qua catheter. Triệt phá AP qua catheter, khi do một người có kinh nghiệm thực hiện, được kết hợp với tần số điều trị khỏi cao (> 95%) và nguy cơ các biến chứng lớn thấp (<0,5%) (xem thêm Mục 11.1.2.3). [438-440] Tuy nhiên, cần lưu ý ghi nhận ngay cả các nghiên cứu xâm lấn cũng không mang lại sự chắc chắn tuyệt đối về đánh giá nguy cơ. Trong một nghiên cứu hồi cứu gần đây ở 912 bệnh nhân trẻ (độ tuổi ≤ 21) có hội chứng WPW, 96 người đã trải qua các biến cố đe dọa đến tính mạng, [405] trong đó 49% đã có AF kích thích sớm dẫn truyền nhanh. Ở những bệnh nhân với biến cố đã được thực hiện với phân tầng nguy cơ bằng EPs, 22 trong số 60 (37%) không có các đặc điểm nguy cơ cao được EPs xác định và 15 trong số 60 (25%) không liên quan đến đặc điểm đường phụ cũng như AVRT. Cũng có bằng chứng ủng hộ quan niệm về rối loạn chức năng LV liên quan đến sự không đồng bộ điện ở bệnh nhân, đặc biệt là trẻ em, với sự kích thích sớm không có triệu chứng. [478-481] Có vẻ hợp lý khi đề xuất EPS và xem xét thực hiện việc triệt phá nếu có liên kết giữa kích thích sớm và rối loạn chức năng LV.
Triệt phá AP không có triệu chứng có “nguy cơ thấp” cũng mang đến sự hợp lý tại các trung tâm có kinh nghiệm phù hợp theo sự lựa chọn của bệnh nhân. Tuy nhiên, khi đưa ra quyết định thực hiện triệt phá qua catheter, điều quan trọng là phải nhận biết triệt phá AP ở vùng vách trước hoặc giữa (MS) có liên quan đến nguy cơ nhỏ của block AV. Nguy cơ block tim liên quan đến triệt phá các AP vách trước hoặc MS có thể ngăn cản việc triệt phá AP vách hoặc MS ở bệnh nhân không có triệu chứng.
Do đó, cách tiếp cận đối với bệnh nhân bị kích thích sớm không có triệu chứng không biểu hiện các đặc điểm nguy cơ cao trong EPS phụ thuộc vào kinh nghiệm và chuyên môn của bác sĩ điện sinh lý thực hiện quy trình, cũng như sở thích và giá trị của bệnh nhân. Trong đăng ký CASPED liên quan đến 182 trẻ em và thanh thiếu niên bị kích thích sớm không có triệu chứng, triệt phá đạt tỷ lệ thành công 91%, không có biến chứng đáng kể. [482]
12 Nhịp nhanh trên thất ở người lớn có tim bẩm sinh
Số người trưởng thành mắc bệnh tim bẩm sinh đang gia tăng với tỷ lệ ∼60% mỗi thập kỷ ở các nước phát triển. [483,484] Hiện tại, ước tính có khoảng 1 triệu người trưởng thành mắc bệnh tim bẩm sinh sống ở Liên minh châu Âu. Mặc dù liên tục có những tiến bộ trong phẫu thuật nhi khoa và tim mạch, cho phép > 90% trẻ em sinh ra mắc bệnh tim bẩm sinh sống sót đến tuổi trưởng thành, [48] những các bệnh nhân này thường tiếp tục bị ảnh hưởng do các biến chứng muộn dẫn đến tăng tỷ lệ mắc bệnh và tử vong. Bên cạnh HF, rối loạn nhịp tim là biến chứng muộn thường gặp ở người lớn bị tật tim bẩm sinh. [486] Điều này là do khiếm khuyết cơ bản tiềm ẩn, các vấn đề về huyết động trước đó hoặc kéo dài và các can thiệp phẫu thuật trước đó dẫn đến tổn thương cơ tim và sẹo. [487] Gánh nặng nhịp tim dao động từ nhịp tim chậm đến SVT, cả VT và VF đe dọa tính mạng.
Nhờ các hoạt động trước đó và giải phẫu cơ bản, bệnh nhân bị tứ chứng Fallot, dị thường của Ebstein, chuyển vị các động mạch lớn sau thủ thuật chuyển tâm nhĩ, và bệnh nhân phức tạp với tim tâm thất độc nhất và giảm nhẹ Fontan đặc biệt dễ bị phát triển loạn nhịp trễ, như nhịp nhanh vào lại trong nhĩ hoặc sẹo sau mổ (incisional), nhịp nhanh thất. [488] Tuy nhiên, ngay cả những bệnh nhân thường có tổn thương không phức tạp như dị tật thông liên nhĩ có nguy cơ rối loạn nhịp nhĩ tăng lên trong cuộc đời.
Ngoài việc liên quan đến các triệu chứng, SVT đã được báo cáo là yếu tố nguy cơ gây tử vong tim đột ngột ở bệnh nhân mắc tim bẩm sinh ở người lớn (ACHD). Vấn đề này đặc biệt ảnh hưởng đến các bệnh nhân bị tổn thương tắc nghẽn tâm thất hệ thống, tứ chứng Fallot, sau phẫu thuật Fontan và tâm thất phải hệ thống. [489,490] Thật không may, chẩn đoán và điều trị rối loạn nhịp tim ở bệnh nhân ACHD rất phức tạp do tính chất bất thường của nhịp tim nhanh, phức tạp giải phẫu trong tim, và đặc biệt là do khó khăn trong việc tiếp cận tim, ví dụ do giải phẫu tĩnh mạch bất thường (ví dụ azygos liên tục hoặc hoạt động Fontan trước đó). Do đó, chuyên môn cụ thể ở bệnh nhân mắc ACHD và tiếp cận với các công cụ điện sinh lý đầy đủ là cần thiết khi thực hiện các thủ thuật triệt phá qua catheter ở những bệnh nhân này.
12.1 Điều trị bằng các thuốc chống loạn nhịp
Điều trị cấp thời của SVT trong bối cảnh ACHD được mô tả cho SVT QRS hẹp, nói chung. [491,492] Các thử nghiệm ngẫu nhiên có đối chứng về điều trị chống loạn nhịp kéo dài ở bệnh nhân mắc ACHD phức tạp còn thiếu. Tất cả các thuốc chống loạn nhịp đều có nguy cơ bị loạn nhịp tim, và nhiều bệnh nhân mắc ACHD có rối loạn chức năng nút xoang tiềm ẩn hoặc có khuynh hướng mắc bệnh AVN. Do đó, thuốc chống loạn nhịp nên được sử dụng một cách thận trọng và thường được dành riêng cho bệnh nhân có triệu chứng sau khi các lựa chọn cho thủ thuật triệt phá qua catheter và tối ưu hóa huyết động (ví dụ, điều chỉnh các vấn đề về bệnh van tim cơ bản) đã hết. Thuốc chẹn beta có thể được sử dụng để làm chậm dẫn truyền nút AV và có thể được xem xét, thận trọng, ở những bệnh nhân chuyển vị các đại động mạch sau khi phẫu thuật chuyển nhĩ. Điều này được ủng hộ bằng các nghiên cứu báo cáo về việc giảm rung thất và / hoặc các sốc ICD thích hợp ở những bệnh nhân được điều trị bằng thuốc chẹn beta. [493,494] Tuy nhiên, cần phải thận trọng vì những bệnh nhân này có thể bị suy giảm điều biến tần số (chronotropic incompetence) và không thể chịu đựng được chẹn beta. [495] Do tác dụng chống loạn nhịp được công nhận, thuốc nhóm IC nên được sử dụng thận trọng trong tất cả các trạng thái ACHD. Những cân nhắc tương tự đề cập đến quinidine, disopyramide và sotalol. Trong báo cáo gần đây của nghiên cứu đoàn hệ DARE, amiodarone, flecainide và sotalol rõ ràng đã gây rối loạn nhịp tim, đặc biệt là khi có QT kéo dài, ở phụ nữ lớn tuổi và ở bệnh nhân mắc bệnh tim mạch tiềm ẩn, tiền sử gia đình có đột tử và hạ kali máu. [496] Flecainide có hiệu quả cao với SVT ở trẻ sơ sinh, nhưng có những lo ngại về độc tính của nó ở tuổi già. [496,497] Hầu hết các trung tâm đều có ngưỡng sử dụng amiodarone thấp hơn ở những bệnh nhân mắc ACHD vì nó được coi là ít rối loạn nhịp tim. Tuy nhiên, nó thường liên quan đến các rối loạn tuyến giáp và ít phổ biến hơn với các biến chứng có khả năng thay đổi cuộc sống được mô tả tốt khác. Các xem xét này nên hạn chế nghiêm ngặt việc sử dụng lâu dài ở bệnh nhân mắc ACHD, do đó hỗ trợ thêm cho việc sử dụng đầu tiên của các nỗ lực triệt phá bất cứ khi nào có thể. [498]
Các khuyến cáo cho điều trị nhịp nhanh trên thất trong bệnh tim bẩm sinh ở người lớn
| Các khuyến cáo | Classa | Levelb |
| Thuốc chống đông cho AT ổ hoặc cuồng nhĩ phải tương tự như đối với bệnh nhân bị AF. [241,242,499] | I | C |
| Điều trị cấp thời | ||
| Các bệnh nhân không ổn định về huyết động | ||
| Chuyển nhịp DC đồng bộ được khuyến cáo cho các bệnh nhân không ổn định về huyết động. [86-88,491,492] | I | B |
| Các bệnh nhân ổn định huyết động | ||
| Các thủ pháp phế vị, tốt nhất ở tư thế năm ngửa với chân nâng lên được khuyến cáo. [41,89-91] | I | B |
| Adenosine (6-18 mg i.v. bolus) được khuyến cáo nếu thủ pháp phế vị thất bại. [92-94] | I | B |
| i.v. verapamil hoặc diltiazem nên được xem xét, nếu thủ pháp phế vị và adenosine thất bại. [92,94-98] | IIb | B |
| I .v. beta-blockers esmolol hoặc metoprolol) nên được xem xét nếu thủ pháp phế vị và adenosine thất bại. [97,99,100] | IIa | C |
| Chuyển nhịp DC đồng bộ được khuyến cáo khi điều trị thất bại để chuyển nhịp hoặc kiểm soát nhịp nhanh. [87,88] | I | B |
| Điều trị lâu dài | ||
| Triệt phá qua catheter ở các trung tâm có kinh nghiệm nên được xem xét. [292,500,501] | IIa | C |
| Beta-blockers nên được xem xét đối với AT ổ hoặc cuồng nhĩ tái phát, nếu triệt phá không có khả năng hoặc không thành công. [237] | IIa | C |
| Ở các bệnh nhân có SVT được lập kế hoạch có sửa chữa ngoại khoa bệnh tim bẩm sinh bất thường, triệt phá qua catheter trước phẫu thuật hoặc triệt phá ngoại khoa trong khi phẫu thất nên được xem xét. [502-504] |
IIa |
C |
| Amiodarone có thể được xem xét để ngăn ngừa nếu triệt phá không thể hoặc không thành công. [505] | IIb | C |
| Sotalol được khuyến cáo như là thuốc chống loạn nhịp đầu tiên khi nó được liên quan đến nguy cơ tăng lên của tử suất do thúc đẩy rối loạn nhịp. [496] | III | C |
| Flecainide và propafenone không được khuyến cáo như là thuốc chống loạn nhịp đầu tiên ở các bệnh nhân có rối loạn chức năng thất và xơ hóa nặng. [497] | III | C |
i.v. verapamil và diltiazem bị chống chỉ định khi có hạ huyết áp và HFrEF.
i.v. beta-blockers bị chống chỉ định khi có suy tim mất bù.
AF = rung nhĩ; AT = nhịp nhanh nhĩ; DC = dòng một chiều; HF = suy tim; HFrEF = suy tim với phân suất tống máu giảm; i.v. = đường tĩnh mạch; SVT = nhịp nhanh trên thất.
aClass khuyến cáo.
bMức độ bằng chứng
12.2 Triệt phá qua catheter và ngoại khoa
Do giải phẫu cơ bản và các hoạt động trước đó, việc tiếp cận can thiệp cho các thủ thuật triệt phá có thể là thách thức ở bệnh nhân ACHD. Ngoài ra, bản chất của SVT thường không điển hình, và liên quan đến nhiều vòng và tổ chức nhĩ xơ hóa. Do đó, chuyên môn chuyên sâu và kinh nghiệm về việc triệt phá rối loạn nhịp nhanh và các thủ thuật liên quan đến sẹo là cần thiết. [506] Người ta khuyến cáo bệnh nhân có nhịp tim nhanh phức tạp nên được chuyển đến các trung tâm chuyên khoa có đủ kinh nghiệm, khối lượng thủ thuật triệt phá và khả năng lập bản đồ nâng cao. Các thủ thuật triệt phá qua catheter trong tình huống ACHD có liên quan đến tỷ lệ thành công thấp hơn so với đoàn hệ chung của bệnh nhân AF hoặc cuồng nhĩ. [484] Tuy nhiên, việc cắt bỏ chứng loạn nhịp tim liên quan đến CTI đã được báo cáo là có tỷ lệ thành công cấp thời cao (> 95%), mặc dù tỷ lệ tái phát giữa kỳ có thể đạt tới 20%. [507] Triệt phá qua catheter trước phẫu thuật hoặc phẫu thuật rối loạn nhịp đồng thời nên được xem xét ở những bệnh nhân ACHD trải qua phẫu thuật tim, vì sự kết hợp của nó có thể dẫn đến class chức năng được cải thiện và có khả năng giảm yêu cầu đối với thuốc chống loạn nhịp kéo dài trong quần thể dễ bị tổn thương này. [502–504]
12.3 Các trạng thái bệnh đặc biệt
12.3.1 Khiếm khuyết vách nhĩ (thông liên nhĩ)
Tỷ lệ rối loạn nhịp nhĩ ở bệnh nhân bị khiếm khuyết vách liên nhĩ dao động trong khoảng 5-15%. [508] Tác động chính xác của việc đóng thông liên nhĩ, đặc biệt là đóng trễ, đối với nguy cơ phát triển AT đang gây tranh cãi. Bệnh nhân thường có mặt với RA MRAT (nhịp nhanh nhĩ vào lại vòng lớn). Cơ chế hàng đầu là nhịp tim nhanh phụ thuộc CTI và điều này thường dễ triệt phá qua catheter. Tuy nhiên, cuồng nhĩ phụ thuộc CTI và cuồng nhĩ “do sẹo mổ” có thể cùng tồn tại. Nói chung, việc đóng một khiếm khuyết thông liên nhĩ hiện tại, trong cô lập, nói chung là không đủ để loại bỏ một AT đang tổn tại và triệt phá qua catheter nên được xem xét trước khi đóng khiếm khuyến. Tỷ lệ tái phát giữa kỳ 40-44% đã được báo cáo ở bệnh nhân khiếm khuyết vách nhĩ sau triệt phá cuồng nhĩ hoặc AF [508,509]; tuy nhiên, điều này không nên ngăn cản các thủ thuật triệt phá bất cứ khi nào có thể
12.3.2 Bất thường Ebstein’s
AT là phổ biến trong bất thường Ebstein, xảy ra ở 25-65% bệnh nhân. [501,510-512] Các types rối loạn nhịp tim bao gồm rung tâm nhĩ, AT ổ và AF. Ngoài ra, 10-45% bệnh nhân có AP ở bên phải, gồm hội chứng WPW. Nhiều hơn một AP là phổ biến trong trạng thái này, và bản thân nó có thể làm tăng nguy cơ tổn thương huyết động và đột tử tim. Triệt phá APs qua catheter có tần số thành công cao; tuy nhiên, các thủ thuật triệt phá có thể là thách thức và các thủ thuật lặp lại có thể cần thiết vì một số bệnh nhân có nhiều mục tiêu triệt phá. Ngoài ra, bệnh nhân có thể phát triển các cơ chế rối loạn nhịp tim khác nhau sau khi triệt phá. [501] Ở những bệnh nhân trải qua phẫu thuật sửa chữa, EPs trước phẫu thuật thường quy có thể được khuyến cáo vì năng suất chẩn đoán và điều trị trong dân số này cao. [513]
12.3.3 Chuyển vị của các đại động mạch (chuyển vị sang phải của các đại động mạch) sau hoạt động chuyển sang nhĩ (Mustard hoặc Senning)
Do phẫu thuật trước đây và sẹo, nhịp nhanh vào lại nhĩ thường ở các bệnh nhân với sửa chữa Mustard hoặc Senning. Ngoài ra, rối loạn chức năng nút xoang có thể xảy ra do hậu quả của thủ thuật chuyển lại tâm nhĩ. [495] Vì nhịp nhanh không được dung nạp tốt ở bệnh nhân rối loạn chức năng tâm trương và thất phải hệ thống, nên duy trì nhịp xoang lâu dài là mong muốn cao trong trạng thái này. Sử dụng thuốc chống loạn nhịp bị hạn chế do rối loạn chức năng nút xoang và thất, và nguy cơ thúc đẩy rối loạn nhịp. Thủ thuật triệt phá ở các bệnh nhân với sửa cữa Mustard hoặc Senning có tần số thành công cao; tuy nhiên, tần số tái phát tiếp cận 30% trong thời gian theo dõi dài hạn. [500,514-516]
12.3.4 Tứ chứng Fallot
SVT không phải là hiếm gặp ở bệnh nhân tứ chứng Fallot. Ngoài việc liên quan đến các triệu chứng, sự xuất hiện của rối loạn nhịp trên thất có liên quan đến nguy cơ đột tử tim cao hơn ở quần thể này. [517] Vì triệt phá qua catheter có
tần số thủ thuật thành công cao, nó nên được xem xét như là sự lựa chọn trong tình huống này. [518] Ngoài ra, bệnh nhân bị rối loạn nhịp nhĩ mới khởi phát nên được đánh giá kỹ lưỡng để loại trừ các tổn thương huyết động có thể điều trị được như hồi phục như hở van động mạch phổi nặng, có thể được điều trị bằng phẫu thuật hoặc can thiệp gián tiếp để giảm gánh nặng rối loạn nhịp tim.
12.3.5 Sửa chữa Fontan
AT là phổ biến ở bệnh nhân sau giảm nhẹ Fontan. Bệnh nhân có thủ thuật Fontan kinh điển (nhĩ phổi) có nguy cơ AT rất cao, với ≤ 60% phát triển SVT sau 15 năm theo dõi. [519] Ngoài các triệu chứng và nguy cơ thuyên tắc huyết khối tim, AT còn được dung nạp kém về mặt huyết động ở bệnh nhân có tim tâm thất độc nhất, và có thể dẫn đến thoái biến cấp tính và HF thật sự trong trạng thái này. [520] Triệt phá qua catheter thường có hiệu quả nhưng đầy thách thức, do bản chất của các rối loạn nhịp cũng như các vấn đề về tiếp cận tim. [514,515] Các biến đổi ngoại khoa khác nhau, như chuyển đổi sang kết nối phổi tĩnh mạch chủ hoàn toàn, đã tiến triển và có thể làm cải thiện nguy cơ rối loạn nhịp nhĩ [521]
13 Nhịp nhanh trên thất ở quần thể nhi khoa
Khuyến cáo chi tiết cụ thể cho bệnh nhân nhi được đề cập riêng [522,523] và nằm ngoài phạm vi của tài liệu này. Nói chung, các khía cạnh nhất định là khác nhau trong dân số nhi và nên được tính đến.
Sự non nớt của các cấu trúc tim, bao gồm tổ chức dẫn truyền, có thể dẫn đến sự điều chỉnh trong điện sinh lý của tim. Do đó, một số AP có mặt trong những tháng đầu đời (ngay cả những AP liên quan đến nhịp tim nhanh) có thể biến mất trước năm đầu tiên của đời sống. [522] Trên thực tế, AVRT do WPW bắt đầu ở giai đoạn ấu nhĩ có thể giải quyết ở 90% bệnh nhân, nhưng có thể tái phát ở tuổi thiêu niên sau này ở 30 – 50% bệnh nhân; tuy nhiên, nếu nhịp nhanh xuất hiện sau 5 tuổi, nó vẫn tồn tại ở > 75% bệnh nhân. [524]
Rõ ràng là trẻ nhỏ có thể không phàn nàn về các triệu chứng, vì vậy các dấu hiệu gián tiếp phải được đánh giá khi nghi ngờ SVT, tức là khó chịu, không phát triển mạnh và thậm chí là các đường cong phát triển đi ngang. Không có gì lạ khi phát hiện ra SVT liên tục ở một bệnh nhân bị sốc tim do TCM. Điều này thường xuyên nhất xảy ra trong các SVT tương đối chậm, chẳng hạn như PJRT và AT ổ. [525,526]
Dược động học và dược lực học ở trẻ em khác với ở người lớn; do đó, phải đặc biệt chú ý khi kê đơn thuốc. [527] Điều này đặc biệt quan trọng ở trẻ sơ sinh vì sữa có thể thay đổi đáng kể sự hấp thu của thuốc và, vì lịch trình cho ăn có xu hướng thất thường, có thể ảnh hưởng đến hiệu quả của thuốc. Hơn nữa, nhiều loại thuốc phải được chuẩn bị tại các nhà thuốc chuyên dụng, làm tăng thêm nguy cơ dùng thuốc không đúng, và các giải pháp thuốc cũng có thể cần được lưu trữ trong các điều kiện đặc biệt để duy trì sự ổn định của chúng. Điều này có thể bất tiện khi cần điều trị lâu dài vì, ví dụ, phải mang theo túi làm mát di động. Ngoài ra, tác dụng lâu dài của một số loại thuốc, khi chúng tích lũy, đặc biệt nguy hiểm trong cơ thể đang phát triển. Đây là mối quan tâm đặc biệt liên quan đến amiodarone, có thể gây ra các tác dụng phụ tương tự như ở người lớn. Verapamil phải được tránh bất cứ khi nào có thể hoặc được cung cấp rất cẩn thận cho bệnh nhân nhỏ vì nó có thể gây hạ huyết áp nghiêm trọng. [522] Đáp ứng adenosine bị giảm ở các trẻ em nhỏ hơn cũng đã được đề xuất. [528]
Kỹ thuật xâm lấn là có thể và hiệu quả ngay cả ở trẻ nhỏ, khi được chỉ định, nhưng có một số yếu tố hạn chế. Đầu tiên, sự hình thành tổn thương do tần số radio ở cơ tim cừu chưa trưởng thành tương tự như ở cơ tim cừu trưởng thành một cách cấp thời, nhưng có liên quan đến sự mở rộng tổn thương muộn và sự xâm lấn mô sợi của cơ tim bình thường. Những quan sát này có thể có ý nghĩa đối với các thủ thuật lâm sàng triệt phá tần số radio ở trẻ sơ sinh [529] và tránh triệt phá bằng tần số radio, nếu có thể, trong 2 năm đầu đời là thận trọng. Thứ hai, không có catheter và dụng cụ cụ thể nào tồn tại cho dân số nhi. Hiện tại, catheter có sẵn (tối thiểu 5 French cho các đầu tần số radio không tưới rửa) và các đường cong, nói chung là quá lớn. Điều này đặc biệt hạn chế ở trẻ nhỏ cần triệt phá để giải quyết nhịp nhanh liên hồi. Cuối cùng, kinh nghiệm của các nhà thực hiện và trung tâm là rất quan trọng. Bệnh nhân nhỏ cần cắt bỏ nên được chuyển đến các trung tâm tham khảo có kinh nghiệm để điều trị. Số lượng catheter được sử dụng, và thời gian thủ thuật và phóng xạ, nên được giảm thiểu trong các cơ quan đang phát triển này. [530] Các hệ thống lập bản đồ giải phẫu điện học có giá trị nhất trong tình huống này
13.1 Rối loạn nhịp ở thai nhi
Rối loạn nhịp ở thai nhi có thể được phát hiện ở tuổi thai sớm, với các SVT không liên tục, nhanh liên quan đến tử vong thai nhi do ứ trệ dịch (hydrops). Do đó, một nỗ lực đặc biệt phải được thực hiện để phát hiện và kiểm soát rối loạn nhịp tim thai nhi. Một mối tương quan mạnh mẽ giữa SVT sau sinh và tuổi thai sau đó trong chẩn đoán SVT của thai nhi đã được báo cáo. [531] Chẩn đoán dựa vào siêu âm tim vì ECG của thai nhi không có sẵn ở hầu hết các phòng khám (nó chỉ được sử dụng ở một vài trung tâm trên toàn thế giới và chủ yếu cho mục đích nghiên cứu). [535] Khi quan sát thấy nhịp tim nhanh của thai nhi dai dẳng, việc điều trị là bắt buộc. Có một số giao thức cho mục đích này, và chúng chủ yếu dựa trên digoxin, flecainide và sotalol hoặc kết hợp tùy thuộc vào loại nhịp tim nhanh. Những loại thuốc này phải được cung cấp cho người mẹ, với một phần nhỏ đến được thai nhi. Điều này có nghĩa là tác dụng phụ của những loại thuốc này có thể biểu hiện ở cả thai nhi và mẹ. Do đó, theo dõi chặt chẽ là cần thiết. [522,533,534]
14 Nhịp nhanh trên thất trong thai kỳ
SVT dai dẳng trở nên thường xuyên hơn trong khi mang thai, xảy ra trong 22 – 24 / 100 000 mang thai. Nó thậm chí có thể xuất hiện lần đầu tiên, đặc biệt là trong tam cá nguyệt thứ ba hoặc chu sinh, theo dữ liệu xuất viện toàn diện từ các bệnh viện. [535] Tần suất chung của bất kỳ rối loạn nhịp tim nào lớn hơn ở phụ nữ ở độ tuổi 41-50 (199/100 000) so với những người ở độ tuổi 18-30 (55/100 000), có thể là do AF và VT phổ biến hơn, trong khi SVT dường như ổn định theo thời gian. [535] Rối loạn nhịp tim cũng thường xuyên hơn ở những phụ nữ mắc bệnh tim bẩm sinh, đặc biệt là rung nhĩ, so với những phụ nữ không bị khuyết tật bẩm sinh. [536]
Do các nghiên cứu tiền cứu thực sự hoặc ngẫu nhiên là không có sẵn, các khuyến cáo chủ yếu dựa trên các đoàn hệ nhỏ hoặc báo cáo trường hợp kết hợp với ý kiến chuyên gia.
14.1 Nguy cơ cho mẹ, sản khoa và con
SVT có liên quan đến nguy cơ tử vong tăng lên trong quá trình thai kỳ, và tần số được thông báo 68 / 100 000 ca nhập viện liên quan đến thai kỳ cho bất kỳ rối loạn nhịp tim nào, 22 / 100 000 cho SVT, 4 / 100 000 cho cuồng nhĩ, 27 / 100 000 cho AF , 2 / 100 000 cho rung thất và 16 trên 100 000 cho VT. [535]
Xác định và điều trị các trạng thái nên là ưu tiên hàng đầu. Mặc dù hầu hết các đợt trầm trọng của SVT trong thai kỳ là lành tính và có thể được điều trị hiệu quả bằng liệu pháp y tế chuẩn, [537] các trường hợp nên được xem xét bao gồm sức khỏe của thai nhi và ảnh hưởng đến chuyển dạ, sinh nở và cho con bú. Hiệu quả huyết động của nhịp tim nhanh, cũng như tác dụng phụ của phương pháp điều trị, phải được cân bằng và giải quyết cho thai nhi. Do đó, triệt phá qua catheter nên được xem xét trước khi mang thai khi có thể ở những bệnh nhân có bệnh sử nhịp tim nhanh có triệu chứng đã biết. Các thử nghiệm đánh giá mức độ giám sát khi sinh là cần thiết
Các khuyến cáo cho điều trị nhịp nhanh trên thất thai kỳ
| Các khuyến cáo | Classa | Levelb |
| Triệt phá qua catheter được khuyến cáo ở các phụ nữ có SVT tái phát có triệu chứng có lên kế hoạch để mang thai. [538] | I | C |
| Điều trị cấp thời | ||
| Chuyển nhịp bằng điện ngay lập tức được khuyến cáo cho bất kỳ nhịp nhanh nào có tổn thương huyết động. [539,540] | I | C |
| Thủ pháp phế vị và nếu thủ pháp thất bại, adenosine được khuyến cáo cho chuyển nhịp SVT cấp thời. [541,542] | I | C |
| Beta blocker I chọn lọc I.V (trừ atenolol) nên được xem xét cho chuyển nhịp cấp thời hoặc kiểm soát tần số SVT. [542,543] | IIa | C |
| Digoxin IV trong phiên bản Gls bỏ túi mới nhất nên được xem xét để kiểm soát tần số AT nếu beta-blockers thất bại. [542,543] | IIa | C |
| Ibutilide IV trong phiên bản Gls bỏ túi mới nhất có thể được xem xét để cắt cơn cuồng nhĩ. [544,545] | IIb | C |
| Điều trị lâu dài | ||
| Trong tam cá nguyệt đầu của thai kỳ, nên tránh tất cả các loại thuốc chống loạn nhịp, nếu có thể được khuyến cáo. | I | C |
| Các beta-1 blockers chọn lọc (trừ atenolol) hoặc verapamil, theo thứ tự ưu tiên, nên được xem xét để phòng ngừa SVT ở bệnh nhân không có hội chứng WPW. [543,546-548] |
IIa |
C |
| Flecainide hoặc propafenone nên được xem xét để phòng ngừa SVT ở những bệnh nhân có hội chứng WPW, và không có bệnh tim thiếu máu cục bộ hoặc cấu trúc. [549] |
IIa |
C |
| Flecainide hoặc propafenone ở những bệnh nhân không có bệnh tim cấu trúc nên được xem xét nếu các thuốc chẹn nút AV thất bại để ngăn chặn SVT. [533,543] |
IIa |
C |
| Digoxin hoặc verapamil nên được xem xét để kiểm soát tần số AT nếu thuốc beta blockers thất bại ở bệnh nhân không có hội chứng WPW. [543] | IIa | C |
| Amiodarone không được khuyến cáo ở phụ nữ thai kỳ. [153,543] | III | C |
| Triệt phá qua catheter không cần quang tuyến nên được xem xét ở các trường hợp trơ với thuốc hoặc SVT dung nạp kém, ở các trung tâm có kinh nghiệm. [550-552] |
IIa |
C |
i.v. ibutilide chống chỉ định ở các bệnh nhân có khoảng QTc kéo dài.
AT = nhip nhanh nhĩ; AV = nhĩ thất; i.v. = đường tĩnh mạch; SVT = nhịp nhanh trên thất; WPW = Wolff–Parkinson–White.
aClass khuyến cáo.
bMức độ bằng chứng
14.2 Điều trị
14.2.1 Các thuốc chống loạn nhịp
Điều trị bằng thuốc chống loạn nhịp để phòng ngừa SVT, nói chung, nên được dành riêng cho các SVT gây ra tổn thương huyết động hoặc triệu chứng quan trọng. Mối quan tâm chính liên quan đến việc sử dụng thuốc chống loạn nhịp trong thai kỳ là tác dụng phụ tiềm ẩn đối với thai nhi. Trong khi tam cá nguyệt thứ nhất có nguy cơ gây quái thai lớn nhất, việc tiếp xúc với thuốc sau này trong thai kỳ có thể dẫn đến những ảnh hưởng xấu đến sự tăng trưởng và phát triển của thai nhi, và sự co bóp tử cung và tăng nguy cơ rối loạn nhịp tim. Nguy cơ và lợi ích của việc tiếp tục so với ngừng thuốc phải được xem xét cẩn thận về nguy cơ tái phát SVT và khả năng tổn thương huyết động. Các quyết định nên được cá nhân hóa, dựa trên trạng thái lâm sàng và bệnh tim cấu trúc có thể thêm vào. Còn thiều các nghiên cứu chính được kiểm soát về thuốc chống loạn nhịp trong thai kỳ. Nếu thao tác không xâm lấn thất bại, adenosine nên là thuốc đầu tiên để điều trị nếu cần trong tam cá nguyệt thứ hai và thứ ba. Có rất ít dữ liệu về quản lý SVT trong ba tháng đầu tiên. [542] Tất cả các thuốc chẹn beta có thể gây nhịp tim chậm và hạ đường huyết ở thai nhi. Vì thuốc chẹn beta 1 chọn lọc beta-1 ít có khả năng ảnh hưởng đến việc giãn tử cung, nên chúng được ưu tiên. [546] Việc sử dụng thuốc chẹn beta của mẹ trong ba tháng đầu không liên quan đến sự gia tăng lớn về nguy cơ dị tật toàn bộ hoặc tim. [548,553] Tuy nhiên, trong nghiên cứu EUROmediCAT, một mối liên quan giữa sử dụng thuốc chẹn alpha / beta-adrenergic trong ba tháng đầu tiên với loạn sản thận đa nang đã được báo cáo. [554] Đã có những lo ngại về trọng lượng thấp đối với tuổi thai bằng thuốc chẹn beta, mặc dù các tác dụng được báo cáo có thể không đủ lớn để có tầm quan trọng lâm sàng. Làm rõ với atenolol có liên quan đến nguy cơ trẻ sơ sinh nhỏ hơn tuổi thai so với metoprolol và propranolol, phù hợp với mối liên hệ này không phải là một hiệu ứng theo nhóm. [543,555] Diltiazem đã được tìm thấy là gây quái thai ở động vật, chỉ có dữ liệu hạn chế ở người và việc sử dụng nó thường không được khuyến nghị trong thai kỳ. Verapamil được coi là an toàn hơn diltiazem và có thể được sử dụng như một loại thuốc hàng hai. [153,543]
14.2.2 Chuyển nhịp bằng điện
Chuyển nhịp bằng điện nên là lựa chọn đầu tiên khi rối loạn nhịp tim không ổn định về mặt huyết động. Chuyển nhịp có vẻ an toàn trong tất cả các giai đoạn của thai kỳ vì nó không ảnh hưởng đến lưu lượng máu của thai nhi, và có nguy cơ thấp gây ra rối loạn nhịp tim thai hoặc bắt đầu chuyển dạ sớm. [539] Nhịp tim của thai nhi nên được kiểm soát thường xuyên sau chuyển nhịp.
14.2.3 Triệt phá qua catheter
Triệt phá qua catheter nên được hoãn lại trong tam cá nguyệt thứ hai nếu có thể, nhưng có thể cần thiết trong trường hợp nhịp nhanh trơ với thuốc và dung nạp kém. Do đó nên được thực hiện ở trung tâm có kinh nghiệm sử dụng lập bản đồ điện giải phẫu không cần chiếu quang tuyến và hệ thống bản đồ catheter. [556] Việc triệt phá qua catheter AVNRT, AVRT, AT ổ, và cuồng nhĩ phụ thuộc CTI tái phát, trơ với thuốc đã thành công trong quá trình thai nghén. [550-552]
15 Bệnh cơ tim do nhịp nhanh
15.1 Định nghĩa
Bệnh cơ tim do nhịp nhanh (Tachycardia-induced cardiomyopathy: TCM), hoặc chính xác hơn là bệnh cơ tim do rối loạn nhịp, là nguyên nhân chức năng thất trái suy giảm có thể hồi phục do nhịp nhanh dai dẳng hoặc các nhắt bóp thất sởm rất thường xuyên có thể đưa đến HF và tử vong. Tỷ lệ TCM không được biết nhưng đã được thông báo ở tất cả các nhóm tuổi, từ thai nhi đến người già.
15.2 Cơ chế
Hội chứng được mô tả đầu tiên với PJRT, nhưng bây giờ chúng ta biết rằng bất kỳ rối loạn nhịp tim mạn tính nào cũng có thể gây ra TCM. AVRT liên tục do AP vách, AF nhanh, VT nguyên phát, AT và nhịp ngoại vị dai dẳng được mô tả rõ nhất. [196,233,526,557-563] Ở những bệnh nhân <18 tuổi, AT ổ là nguyên nhân phổ biến nhất. [408]
Tạo nhịp nhanh trong mô hình động vật gây ra thay đổi tế bào cơ và tái cấu trúc cơ bản bên ngoài tế bào được thay đổi cho chu ký canxi bất thường, catecholaimes được tăng lên, giảm mật độ thụ thể adrenergic beta-1, kích thích oxy hóa, suy giảm năng lượng của cơ tim và thiếu máu cơ tim do tần số tim tăng lên. [559,565] Các mẫu sinh thiết nội tâm mạc cơ tim từ các bệnh nhân có TCM thể hiện các đặc tính khác biệt với những type khác của bệnh cơ tim, bao gồm hư hòng tế bào cơ tim và hình thái học mitochondri, và viêm tim đại thực bào chiếm ưu thế. [565] Tuy nhiên, nó vẫn chưa được thiết lập đầy đủ làm thế nào phần lớn bệnh nhân bị các co bóp thất sớm thường xuyên có một quá trình lành tính, trong khi 30% trong số họ có thể phát triển bệnh cơ tim. [566]
15.3 Chẩn đoán
TCM là một trong số rất ít nguyên nhân có thể đảo ngược của bệnh HF và bệnh cơ tim giãn, và nên được xem xét ở bất kỳ bệnh nhân nào mới bắt đầu rối loạn chức năng LV. Trong trường hợp nhịp tim nhanh hoặc thường xuyên, hoặc co bóp thất sớm thường xuyên, cần duy trì một chỉ số nghi ngờ cao. Chẩn đoán được thiết lập bằng cách loại trừ các nguyên nhân khác của bệnh cơ tim và chứng minh phục hồi chức năng LV sau khi loại bỏ rối loạn nhịp tim hoặc kiểm soát tần số thất. Thông thường trong TCM, phân suất tống máu LV là < 30%, đường kính cuối tâm trương LV là < 65 mm và đường kính tâm thu cuối LV là <50 mm. [557] Thể tích thất bị giãn nhiều hơn gợi ý bệnh cơ tim giãn, mặc dù một vài sự chồng chéo của hai trạng thái có thể xảy ra. Ở những bệnh nhân nghi ngờ TCM, cộng hưởng từ tim (CMR) được khuyến khích để loại trừ thay đổi cấu trúc nội tại. Đánh giá một loạt N-terminal pro-B-type natriuretic peptide (NT-proBNP) và ước tính tỷ lệ NT-proBNP cơ bản so NT-proBNP trong quá trình theo dõi có thể giúp phân biệt TCM với bệnh cơ tim giãn nguyên phát không thể hồi phục
15.4 Điều trị
Các khuyến cáo điều trị nhịp nhanh trên thất ở các bệnh nhân có suy tim nghi ngờ hoặc đã xác định do bệnh cơ tim do nhịp nhanh
| Các khuyến cáo | Classa | Levelb |
| Triệt phá qua catheter được khuyến cáo cho TMC do SVT. [196,233,418,525] | I | B |
| Beta-blockers (từ danh sách với lợi ích tử suất và bệnh suất được cải thiện trong HFrEF) được khuyến cáo cho TCM do SVT, khi triệt phá qua catheter thất bại hoặc không thế áp dụng. [567] |
I |
A |
| TCM được khuyến cáo xem xét ở bệnh nhân có phân suất LV giảm với tần số tim nhanh (>100 b.p.m.). [557-561] | I | B |
| ECG theo dõi 24 h (hoặc nhiều ngày) nên được xem xét cho chẩn đoán TCM bằng nhận biết rối loạn nhịp dưới lâm sàng hoặc không liên tục. [526,557,568] |
IIa |
B |
| Triệt phá nút AV với tại nhịp tiếp theo (“triệt phá và tạo nhịp), hoặc hai thất hoặc bó His, được khuyến cáo nếu nhịp nhanh gây ra TCM không thể triệt phá hoặc không được kiểm soát bằng thuốc. [526,557,564,569-572] |
I |
C |
b.p.m. = nhắt bóp trên phút; ECG = điện tâm đồ; HFrEF = suy tim phân suất tống máu giảm; LV = thất trái; SVT = nhịp nhanh trên thất; TCM = bệnh cơ tim do nhịp nhanh.
aClass khuyến cáo.
bMức độ bằng chứng.
Trong TCM, chức năng LV thường xuyên cải thiện sau 3 tháng phục hồi nhịp tim bình thường. Trong IST, beta-blockers được chỉ định. Triệt phá qua catheter được chỉ định khi TCM do SVT khác. Khi nhịp tim nhanh không thể triệt phá, triệt phá qua nút AV bằng cách tạo nhịp hai buồng thất hoặc bó His là phù hợp. [569 .5572] Điều trị thuốc dài hạn với thuốc chẹn beta và thuốc ức chế men chuyển angiotensin II hoặc thuốc ức chế thụ cảm thể angiotensin II, được chỉ định trước và sau khi triệt phá thành công các tác dụng có lợi đã biết của các loại thuốc này trong quá trình tu sửa LV. Với nguy cơ tái phát rối loạn nhịp tim, nên theo dõi lâu dài bệnh nhân
16 Nhịp nhanh trên thất trong thể thao
Các vận động viên bị rối loạn nhịp trên thất thường xuyên phải được đánh giá để loại trừ sự hiện diện của bệnh tim nền, mất cân bằng điện giải, rối loạn chức năng tuyến giáp và sử dụng thuốc kích thích hoặc thuốc tăng cường hiệu suất. Bảng 13 phác thảo các khuyến cáo về khả năng hội đủ điều kiện thể thao của bệnh nhân SVT. [573,574]
Bảng 13. Khuyến cáo cho sự tham gia thể thao trong các vận động viên bị kích thích sớm tâm thất và rối loạn nhịp trên thất.
| Các tiêu chỉ cho đủ điều kiện | Chấp thuận | ||
| Nhắt bóp nhĩ sớm | Không triệu chứng, không bệnh tim | Tất cả thể thao | |
| AVRT hoặc AF trong bối cảnh hội chứng WPW syndrome | Triệt phá là bắt buộc. Thể thao được phép 1 tháng sau khi triệt phá nếu không có tái phát. | Tất cả thể thao | |
| Kích thích sớm thất không triệu chứng | Triệt phá là bắt buộc ở các bệnh nhân nguy cơ cao. Thể thao được phép 1 tháng sau triệt phá nếu không có tái phát | Tất cả thể thao | |
| Cơn SVT (AVNRT, AVRT qua đường phụ ẩn, và AT) | Triệt phá được khuyến cáo. Thể thao được phép 1 tháng sau triệt phá nếu không có tái phát | Tất cả thể thao | |
| Tất cả các môn thể thao, ngoại trừ nguy cơ mất ý thực nội tại cao | |||
| Triệt phá không mong muốn hoặc không khả thi |
AF = rung nhĩ; AP = đường phụ; AT = nhịp nhanh nhĩ; AVNRT = nhịp nhanh vào lại nút nhĩ thất; AVRT = nhịp nhanh vào lại nhĩ thất; SVT = nhịp nhanh trên thất; WPW = Wolff–Parkinson–White
Kích thích sớm tâm thất (hội chứng WPW) là một nguyên nhân hiếm gây ra đột tử do tim ở vận động viên trẻ. [575] Mặc dù nhiều người bị kích thích sớm tâm thất vẫn không có triệu chứng trong suốt cuộc đời, AVRT có triệu chứng có thể xảy ra. Bệnh nhân có WPW cũng có thể bị rối loạn nhịp tim khác, chẳng hạn như AF, có thể thoái hóa thành rung thất và đột tử do tim. Do hoạt động thể thao có liên quan đến việc tăng nguy cơ AF, [576] vận động viên bị kích thích sớm tâm thất có nguy cơ đột tử tim nếu AP có khả năng dẫn truyền xuôi nhanh. Do đó, triệt phá AP qua catheter đang được khuyến cáo ở những vận động viên có triệu chứng với kích thích sớm tâm thất. Vận động viên không có triệu chứng với kích thích sớm liên tục (khi nghỉ ngơi hoặc trong khi tập thể dục) hoặc kích thích sớm biến mất đột ngột trước trong suốt quá trình test kích thích có thể xem xét có nguy cơ thấp (xem phần 11.3.11 cho hạn chế), nhưng nên được đánh giá thêm vì họ có thể đủ điều kiện cho hoạt động thể thao cạnh tranh. Ở những vận động viên không có triệu chứng với kích thích sớm tâm thất, phân tầng nguy cơ xâm lấn nên được tiến hành như mô tả trong phần 11.3.11 và triệt phá qua catheter nên được thực hiện ở những người có tính năng nguy cơ cao. [577] Bệnh nhân không có triệu chứng phân tầng có nguy cơ thấp được phép thực hành các môn thể thao cạnh tranh.
AVNRT, AVRT orthodromic qua AP ẩn và AT không được liệt kê trong số các nguyên nhân gây đột tử tim trong quá trình gắng sức ở các bệnh nhân có tim cấu trúc bình thường. Tuy nhiên, sự xuất hiện của chúng trong hoạt động thể thao có thể liên quan đến nhịp tim rất cao do kích thích giao cảm và có thể gây suy giảm huyết động ngay cả ở những bệnh nhân có tim cấu trúc bình thường. Theo đó, triệt phá qua catheter nên được khuyến cáo thông thường cho tất cả các vận động viên có tiền sử có cơn SVT. Các vận động viên với SVT không muốn tiến hành triệt phá qua catheter hoặc ở họ thủ thuật không thành công, có thể được coi là đủ điều kiện cho hoạt động thể thao cạnh tranh nếu rối loạn nhịp tim lẻ tẻ, không liên quan đến bệnh tim, dung nạp tốt và không liên quan đến gắng sức, và khi nào hoạt động thể thao không có nguy cơ mất ý thức nội tại cao (như thợ lặn, phi công, người cưỡi ngựa, v.v.). [578]
Điều trị cơn SVT bằng beta-blockers hoặc chẹn kênh natri không được khuyến khích ở các vận động viên, do các thuốc này có thể giảm hiệu suất trong quá trình thể thao và có khả năng hạn chế đối với việc để ngăn chặn rối loạn nhịp tái phát trong quá trình hoạt động thể thao. Hơn nữa, thuốc chẹn beta được Cơ quan chống doping thế giới liệt vào danh sách các loại thuốc bị cấm trong các môn thể thao cụ thể.
17 Nhịp nhanh trên thất và hạn chế lái xe
Tần suất mà các nguyên nhân y tế góp phần gây ra tai nạn xe cơ giới không được biết chính xác. Dữ liệu về rối loạn nhịp tim là nguyên nhân gây ra tai nạn xe cơ giới khó ghi nhận chính xác các biến cố như vậy trong dân số nói chung. Tuy nhiên, tỷ lệ này được cho là nhỏ, với ∼1 – 3% trong số tất cả các vụ tai nạn xe cơ giới được xác định là do tài xế điều khiển xe bất ngờ. [579] Trong số các vụ tai nạn này, 5 – 10% có liên quan đến nguyên nhân tim, có hoặc không có ngất, trong khi <2% trường hợp mất lái xe đột ngột được báo cáo đã dẫn đến thương tích hoặc tử vong cho người đi đường hoặc người sử dụng các phương tiên trên đường khác. [579]
Vào năm 2013, một nhóm làm việc của ESC đã công bố các khuyến nghị chi tiết về hạn chế lái xe ở bệnh nhân mắc SVT (Bảng 14). [580] Hai nhóm lái xe được xem xét. Nhóm 1 bao gồm người điều khiển xe máy, ô tô và các phương tiện nhỏ khác có và không có rơ moóc. Nhóm 2 bao gồm người điều khiển phương tiện trên 3500 kg hoặc phương tiện chở khách vượt quá tám chỗ ngồi trừ tài xế. Người lái xe taxi, xe cứu thương nhỏ và các phương tiện khác tạo thành một hạng mục trung gian giữa người lái xe tư nhân thông thường và người lái xe dạy nghề.
Bảng 14 Báo cáo của Nhóm Công tác châu Âu 2013 về lái xe và bệnh tim mạch: lái xe trong rối loạn nhịp tim và rối loạn dẫn truyền: nhịp nhanh trên thất
| Rối loạn dẫn truyền / rối loạn nhịp | Group 1 | Group 2 |
| AF/cuồng nhĩ/AT ổ | • Lái xe có thể tiếp tục khi không cung cấp tiền sử của ngất.
• Nếu tiền sử ngất, việc lái xe phải chấm dứt cho đến khi tình trạng được kiểm soát / điều trị thỏa đáng. |
• Lái xe có thể tiếp tục khi không cung cấp tiền sử ngất và hướng dẫn chống đông máu được tuân thủ.
• Nếu tiền sử ngất, việc lái xe phải chấm dứt trừ khi nguyên nhân cơ bản được điều trị và nguy cơ tái phát thấp. Kiểm soát tần số trong nhịp tim nhanh nên được đầy đủ. • Lái xe chỉ có thể được nối lại sau khi đánh giá y tế. |
| AVNRT, AVRT, và WPW | • Nếu bệnh sử ngất, lái xe phải chấm dứt cho đến khi điều kiện đã được kiểm soát / điều trị thỏa đáng. | • Lái xe có thể tiếp tục khi không được cung cấp tiền sử ngất hoặc các triệu chứng quan trọng khác (ví dụ như đánh trống ngực với chóng mặt).
• Nếu vậy, lái xe phải chấm dứt cho đến khi nguyên nhân cơ bản được điều trị đến nguy cơ tái phát thấp. • Trong trường hợp kích thích sớm, lái xe chỉ có thể được phép sau khi chuyên gia đánh giá. |
AF = rung nhĩ; AT = nhịp nhanh nhĩ; AVNRT = nhịp nhanh vào lại nút nhĩ thất; AVRT = nhịp nhanh vào lại nhĩ thất; WPW = Wolff−Parkinson−White.
18 Các thông điệp quan trọng
- Không phải tất cả các SVT là rối loạn nhịp tim của người trẻ.
- Thủ pháp phế vị và adenosine là phương pháp điều trị được lựa chọn cho trị liệu cấp thời của SVT, và cũng có thể cung cấp thông tin chẩn đoán quan trọng.
- Verapamil không được khuyến cáo trong nhịp tim nhanh phức hợp QRS rộng của bệnh nguyên không rõ.
- Cân nhắc sử dụng ivabradine, khi được chỉ định, cùng với thuốc chẹn beta.
- Trong tất cả các rối loạn nhịp tim vào lại và hầu hết các rối loạn nhịp ổ, triệt phá qua catheter nên được lựa chọn khởi đầu hơn đối với bệnh nhân, sau khi giải thích cặn kẽ về nguy cơ tiềm ẩn và lợi ích.
- Bệnh nhân nhịp nhanh vào lại vòng lớn sau ngoại khoa nhĩ nên được chuyển đến các trung tâm chuyên khoa để triệt phá.
- Trong các lần triệt phá AT sau AF, các ổ hoặc vào lại vòng lớn, triệt phá nên được trì hoãn trong vòng ≥3 tháng sau triệt phá AF, khi có thể.
- Triệt phá AVNRT, điển hình hoặc không điển hình, với các tổn thương ở vùng giải phẫu của phần nút mở rộng, hoặc từ vách phải hoặc trái.
- AVNRT, điển hình hoặc không điển hình, hiện có thể được triệt phá mà hầu như không có nguy cơ về block AV.
- Không sử dụng sotalol ở bệnh nhân SVT.
- Không sử dụng flecainide hoặc propafenone ở bệnh nhân LBBB, hoặc thiếu máu cục bộ hoặc bệnh tim cấu trúc.
- Không sử dụng amiodarone trong AF có kích thích sớm.
- Một trong năm bệnh nhân kích thích sớm không có triệu chứng sẽ bị rối loạn nhịp tim liên quan đến AP trong quá trình theo dõi.
- Nguy cơ ngừng tim / rung thất ở bệnh nhân bị kích thích sớm không có triệu chứng là ∼2.4 / 1000 người mỗi năm.
- Sàng lọc không xâm lấn có thể được sử dụng để phân tầng nguy cơ bệnh nhân bị kích thích sớm không có triệu chứng, nhưng khả năng dự đoán của nó vẫn còn khiêm tốn.
- Đánh giá xâm lấn bằng EPS được khuyến nghị ở những bệnh nhân bị kích thích sớm không có triệu chứng, những người có nghề nghiệp có nguy cơ cao hoặc là vận động viên cạnh tranh.
- Nếu một bệnh nhân trải qua đánh giá với một EPS và được phát hiện có AP với ‘các đặc điểm có nguy cơ cao, nên triệt phá qua catheter.
- Nếu có thể, tránh tất cả các thuốc chống loạn nhịp trong ba tháng đầu của thai kỳ. Nếu các thuốc chẹn beta là cần thiết, chỉ sử dụng các thuốc chọn lọc beta-1 (chứ không phải atenolol).
- Nếu triệt phá là cần thiết trong khi mang thai, sử dụng lập bản đồ không huỳnh quang.
- Cân nhắc TCM ở bệnh nhân giảm chức năng LV và SVT.
- Triệt phá là lựa chọn điều trị cho TCM do SVT. Triệt phá nút AV với tạo nhịp hai buồng thất hoặc bó His tiếp theo (‘triệt phá và tạo nhịp) nên được xem xét nếu SVT không thể triệt phá được.
19 Các khoảng trống bằng chứng
- Sự khác biệt giữa hoạt động được kích hoạt và tính tự động gia tăng không đơn giản, vì hai cơ chế có nhiều đáp ứng và đặc điểm tương tự, chẳng hạn như sự gia tăng bằng hoạt động adrenergic và ức chế bằng chẹn dòng Ca2 + loại L.
- Các vòng vào lại có thể là kính hiển vi hoặc làm giả các ổ bằng “sự xuyên thủng” lan truyền xuyên thành trên bề mặt. Do đó, lập bản đồ có thể là không phù hợp đề phân biệt chúng với hoạt động tự động / khởi kích.
- Vòng chính xác của AVNRT, rối loạn nhịp tim đều phổ biến nhất ở người, vẫn còn chưa được giải quyết.
- Vai trò tiềm tàng của protein Connexin trong AVNRT và SVT nói chung, đang được nghiên cứu.
- Cả hai test xâm lấn và không xâm lấn để đánh giá nguy cơ ở bệnh nhân có kích thích sớm không triệu chứng có nhiều hạn chế, phụ thuộc vào trương lực tự trị. Các mô hình phân tầng nguy cơ chính xác hơn là cần thiết.
- Việc quản lý kích thích sớm không triệu chứng phù hợp và chỉ định triệt phá qua catheter còn chưa được xác định.
- Di truyền học của SVT chưa được nghiên cứu đầy đủ. Đã có bằng chứng cho các hình thái gia đình của AVNRT, AVRT, nhịp nhanh xoang và AT, nhưng các dữ liệu rất khan hiếm.
- Các hệ thống lập bản đồ điện giải phẫu ngày nay cho phép hình dung đồng thời hoạt động và điện thế. Những tác động này có thể có trên đặc trưng của nền của nhịp tim nhanh, và không chỉ ngày vòng nhịp nhanh, đòi hỏi nghiên cứu trong tương laii.
- Mô hình toán học và phân tích số lượng các ECG được ghi, sử dụng các mô hình Fourier và Gaussian nhanh, có thể hữu ích cho tương lai của các ứng dụng trí tuệ nhân tạo (artificial intelligence) trong chẩn đoán phân biệt nhịp tim nhanh phức bộ QRS hẹp và rộng, nhưng kinh nghiệm còn hạn chế.
20 Thông điệp ‘Việc gì cần làm’ và ‘việc gì không được làm’ từ các hướng dẫn
Các thông điệp ‘Cái gì được làm’
| Các khuyến cáo điều chỉnh nhịp nhanh QRS hẹp chưa được chẩn đoán xác định | Classa | Levelb |
| Huyết động ổn định | ||
| ECG 12 chuyển đạo trong cơn nhịp nhanh được khuyến cáo | I | C |
| Khuyến cáo nên sử dụng các thủ pháp phế vị, tốt nhất là ở tư thế nằm ngửa với nâng chân lên cao. | I | B |
| Adenosine (6-18 mg i.v. bolus) được khuyến cáo nếu thủ pháp phế vị thất bại | I | B |
| Khuyến cáo cho điều chỉnh cấp thời cho nhịp nhanh QRS rộng khi không có chẩn đoán xác định | ||
| Các bệnh nhân huyết động ổn định | ||
| 12 chuyển đạo ECG trong quá trình nhịp nhanh được khuyến cáo | I | C |
| Các thủ pháp phế vị được khuyến cáo | I | C |
| Các khuyến cáo cho điều trị AT ổ | ||
| Điều trị lâu dài | ||
| Triệt phá qua catheter được khuyến cáo cho AT ổ tái phát, đặc biệt nếu liên hồi hoặc gây ra TCM | I | B |
| Các khuyến cáo cho điều trị MRATs | ||
| Kháng đông trong AF được khuyến cáo cho các bệnh nhân cuồng nhĩ và AF đồng thời. | I | B |
| Điều trị lâu dài | ||
| Triệt phá qua catheter được khuyến cáo cho các cơn cuồng nhĩ phụ thuộc CTI tái phát có triệu chứng. | I | A |
| Triệt phá qua catheter được khuyến cáo ở các bệnh nhân có cuồng nhĩ dai dẳng hoặc hiện diện của chức năng tâm thu LV giảm do TCM. | I | B |
| Các khuyến cáo cho điều chỉnh AVNRT | ||
| Điều trị lâu dài | ||
| Triệt phá qua catheter được khuyến cáo cho AVNRt tái phát có triệu chứng. | I | B |
| Các khuyến cáo cho điều trị AVRT do AP bộc lộ hoặc ẩn | ||
| Triệt phá APs qua catheter được không ở các bệnh nhân AVRT tái phát có triệu chứng. | I | B |
| Các khuyến cáo cho điều trị cấp thời AF có kích thích sớm | ||
| Bệnh nhân huyết động ổn định | ||
| Chuyển nhịp DC đồng bộ được khuyến cáo nếu điều trị thuốc thất bại để chuyển nhịp hoặc kiểm soát nhịp nhanh. | I | B |
| Các khuyến cáo cho điều chỉnh các bệnh nhân có kích thích sớm có triệu chứng | ||
| Thực hiện EPs, với sử dụng isoprenaline, được khuyến cáo để phân tầng nguy cơ do kích thích sớm có nghề nghiệp / sở thích nguy cơ cao và những người tham gia các vận động viên cạnh tranh. | I | B |
| Triệt phá qua catheter được khuyến cáo ở các bệnh nhân không có triệu chứng ở họ chó test điện sinh lý với sử dụng isoprenaline xác định các đặc tính nguy cơ cao, như SPERRI <_250 ms, AP ERP <_250 ms, nhiều APs, và nhịp nhanh qua trung gian AP có thể tạo ra. | I | B |
| Các khuyến cáo điều trị SVT trong thai kỳ | ||
| Triệt phá qua catheter được khuyến cáo ở phụ nữ có SVT tái phát cơ triệu chứng có kế hoạc mang thai. | I | C |
| Điều trị lâu dài | ||
| Trong quá trình tam cá nguyệt đầu tiên thai kỳ, được khuyến cáo tránh tất cả các thuốc chống loạn nhịp nếu có thể. | I | C |
| Các khuyến cáo điều trị SVT ở các bệnh nhân HF nghi ngờ hoặc xác định do TCM | ||
| Triệt phá qua catheter được khuyến cáo cho TCM do SVT | I | B |
| Triệt phá nút AV với tạo nhịp tiếp theo (‘triệt phá và tạo nhịp), tạo nhịp hai buồng thất hoặc tạo nhịp bó His, được khuyến cáo nếu nhịp nhanh gây ra TCM không có thể triệt phá hoặc kiểm soát bằng thuốc. | I | C |
| Thông điệp ‘cái gì không được làm’ | ||
| Các khuyến cáo cho điều chỉnh cấp thời nhịp nhanh QRS rộng khi không có chẩn đoán được xác định | ||
| Verapamil không được khuyến cáo trong nhịp nhanh QRS rộng căn nguyên chưa rõ | III | B |
| Các khuyến cáo cho điều trị MRATs (nhịp nhanh nhĩ vào lại vòng lớn) | ||
| Điều trị cấp thời | ||
| Propafenone và flecainide không được khuyến cáo cho chuyển nhịp về nhip xoang | III | B |
| Các khuyến cáo cho điều trị AVRT do AP bộc lộ hoặc ẩn | ||
| Điều trị lâu dài | ||
| Digoxin, beta-blockers, diltiazem, verapamil, và amiodarone không được khuyến cáo và tác hại tiềm ẩn ở các bệnh nhân AF có kích thích sớm. | III | B |
| Các khuyến cáo cho điều trị cấp thời AF có kích thích sớm | ||
| Các bệnh nhân huyết động ổn định | ||
| Amiodarone (i.v.) không được khuyến cáo | III | B |
| Các khuyến cáo cho điều trị SVT trong bệnh tim bẩm sinh ở người lớn | ||
| Điều trị lâu dài | ||
| Sotalol không được khuyến cảo như là thuốc chống loạn nhịp hàng đầu do liên quan đến nguy cơ thúc đẩy loạn nhịp và tử suất tăng lên. | III | C |
| Flecainide và propafenone không được khuyến cáo như thuốc chống loạn nhịp hàng đầu ở các bệnh nhân rối loạn thất và xơ hóa nặng | III | C |
| Các khuyến cáo cho điều trị SVT trong thai kỳ | ||
| Điều trị lầu dài | ||
| Amiodarone không được khuyến cáo ở phụ nữ thai kỳ. | III | C |
AF = rung nhĩ; AP = đường phụ; AT = nhịp nhanh nhĩ; AVNRT = nhịp nhanh vào lại nút nhĩ thất; AVRT = nhịp nhanh vào lại nhĩ thất; CTI = eo tĩnh mạch chủ ba lá; DC = dòng một chiều; ECG = điện tâm đồ; EPS = nghiên cứu điện sinh lý; ERP = thời ký trơ có hiệu quả; HF = suy tim; i.v. = đường tĩnh mạch; MRAT = nhịp nhanh nhĩ vào lại vòng lớn; SPERRI = khoảng RR được kích thích sớm ngắn nhất trong quá trình rung nhĩ; SVT = nhịp nhanh trên thất; TCM = bệnh cơ tim do nhịp nhanh.
aClass khuyến cáo.
bMức độ bằng chứng.
21 Các lĩnh vực nghiên cứu trong tương lai
Với sự ra đời của triệt phá qua catheter vào những năm 1990, dẫn đến việc loại bỏ thành công AP ở bệnh nhân có triệu chứng, AVRT hiện chiếm <20% trong tất cả các SVT. [11,13] Tần số của AVNRT, được sử dụng chiếm 50% trong tất cả Các trường hợp SVT, [14] đã thay đổi thành ∼30%, [11,13] và sự tăng trưởng của triệt phá AF sẽ không thể tránh khỏi dẫn đến MRAT nhĩ trái nhiều hơn. Hơn nữa, sự sống sót kéo dài của bệnh nhân nhi và ACHD (bệnh tim bẩm sinh ở người lớn) dự kiến sẽ đặt ra một thách thức hơn nữa đối với các nhà nghiên cứu điện sinh lý, những người sẽ gặp phải những MRAT phức tạp hơn nữa. Một số tiến bộ quan trọng trong lĩnh vực lập bản đồ giải phẫu và điện học, cũng như sự đánh giá cao của chúng tôi về tổ chức sẹo và và sự xuyên thấu của các tổn thương triệt phá, sự cải thiện kết quả của chúng ta trong điều trị các bệnh nhân này
Thập kỷ qua đã chứng kiến sự phát triển nhanh chóng của thiết bị triệt phá và hệ thống hướng dẫn điện cực, dẫn đến các thủ thuật dễ kiểm soát và an toàn hơn. Siêu âm tim trong buồng tim, kỹ thuật robot và hệ thống điều hướng giải phẫu đã phát triển ở mức độ hoàn thiện (sophisticated anatomical navigation systems) đã được phát triển, và giờ đây có thể thực hiện triệt phá không làm cho người thực hiện tiếp xúc với bức xạ và các vị trí không thuận lợi. [581] Vật liệu mới cho điện cực và các thiết bị khác đã cho phép khái niệm về các lab định sinh lý không có quang tuyến (radiation free electrophysiology laboratory) với việc sử dụng CMR. Sự mong mỏi một laboratory từ trường, hoàn toàn không bức xa trong tương lai không có là khoa học viễn tưởng nửa (science fiction). [582]
Cuộc cách mạng trong công nghệ máy tính không chỉ cải thiện hệ thống lập bản đồ và di chuyển điện cực mà còn tăng cường các sơ đồ phân loại SVT chuyên biệt với các thuật toán hoàn toàn tự động có thể hỗ trợ rất nhiều cho các khoa cấp cứu, xe cứu thương và bệnh nhân được theo dõi. [583] Mô hình toán học và phân tích số cũng đã được sử dụng trong quá trình khám phá vòng vào lại của AVNRT. [317,329] Phân tích tương lại của ECG được ghi lại sử dụng mô hình Fourier và Gaussian có thể cũng cung cấp các thông tin chẩn đoán hữu dụng về đặc tính của nhịp nhanh. Các hệ thống lập bản đồ điện tử giải phẫu mới đang được phát triển để hỗ trợ việc xác định cơ chế nhịp tim nhanh và vị trí triệt phá tối ưu của SVT, và đặc biệt là nhịp tim nhanh nhĩ vòng lớn phức tạp, với thời gian soi huỳnh quang được giảm xuống. [584-589] Các hệ thống hiện có sẵn cho phép hiển thị đồng thời sự kích hoạt và điện thế. Những tác động này có thể thể hiện đặc tính đặc trưng nền nhịp nhanh, và không chỉ vòng vào lại, đòi hỏi nghiên cứu trong tương lại.
Dữ liệu mới về di truyền của SVT liên tục xuất hiện kể từ khi xác định đột biến sai lệch trong gen PRKAG2, mã hóa tiểu đơn vị Y của proteinkinase hoạt hóa adenosine monophosphate (AMP) điều hòa, là nguyên nhân của hội chứng WPW gia đình. Đột biến R302Q trong PRKAG2 đã được liên kết với các sợi Mahaim. [592] Một hình thái mới của hội chứng WPW có liên quan đến microdeletion của gen BMP2, mã hóa protein – 2 hình thái xương, một thành viên của siêu họ gen beta-yếu tố tăng trưởng biến đổi và ảnh hưởng đến sự phát triển của xơ hóa sợi. [593] Các dạng kích thích sớm hiếm, di truyền hiếm khác đã được mô tả. [398] Liệu loại khuynh hướng di truyền này có chuyển thành nguy cơ rung thất cao hơn hay không vẫn còn được xem xét. Các mô hình động vật của WPW di truyền biểu hiện đột biến (chẳng hạn như gen mã hóa protein kinase được kích hoạt AMP) chịu trách nhiệm cho một hình thái hội chứng WPW gia đình có kiểu hình giống với hội chứng trên người đã được phát triển và có thể cung cấp cái nhìn sâu sắc về sự phát triển và tính chất của hệ thống dẫn truyền tim và AP. [594] AVNRT tự phát cũng đã được xác định là một biểu hiện lâm sàng tiềm tàng đầu tiên của hội chứng Brugada ẩn, đặc biệt ở bệnh nhân nữ. [595] Người ta đã đề nghị các biến thể di truyền làm giảm dòng natri có thể khiến các cá nhân biểu hiện của cả hai kiểu hình. Điện sinh lý tế bào hiện đang được tích hợp vào phân tích di truyền. Sự kết hợp của trình tự toàn bộ exome với phân tích chức năng điện sinh lý tế bào có thể làm sáng tỏ cơ chế sinh lý bệnh cơ bản chịu trách nhiệm cho một số kiểu hình. [596] Mới đây, một dạng IST gia đình đã được chứng minh là có liên quan đến đột biến chức năng trong kênh tạo nhịp HCN4 (R524Q), tạo ra độ nhạy tăng lên cho AMP vòng truyền tin thứ hai là trung gian quan trọng tỏng điều biến giao cảm. [597] Những phát triển này có thể có ảnh hưởng quan trọng đối với một phương pháp chẩn đoán chuyên biệt hơn và điều trị mang tính cá thể hóa hơn trong SVT. Nghiên cứu trong tương lai nên xác định các cơ chế rối loạn nhịp phân tử đặc hiệu cho bệnh nhân có thể hành động, làm rõ các đáp ứng của các chất nền cơ bản với các can thiệp và đạt được mục tiêu cơ chế rối loạn nhịp chuyển biệt trên thất chọn lọc với các thuốc.
SVT không chỉ là một vấn đề lâm sàng thường nhật, với AVNRT là rối loạn nhịp đều hay gặp nhất ở người. Chúng cũng cung cấp nền tảng để đào tạo thích hợp cho các nhà nghiên cứu điện sinh lý trong tương lai bằng ý nghĩa của các vòng của chúng được xác định rõ, trong hầu hết các trường hợp, và các đáp ứng có thể dự đoán được trong phòng thí nghiệm điện sinh lý. Trong kỷ nguyên của các phương pháp vi tính ngày nay khả năng cho triệt phá AF, AT phức tạp VT, điều này là rất quan trọng đối với cách tiếp cận hợp lý kiểu Aristote đối với nghệ thuật y học. [598]
Tài liệu tham khảo
- Steinbeck G, Sinner MF, Lutz M, Muller-Nurasyid M, Kaab S, Reinecke H. Incidence of complications related to catheter ablation of atrial fibrillation and atrial flutter: a nationwide in-hospital analysis of administrative data for Germany in 2014. Eur Heart J 2018;39:40204029.
- Konig S, Ueberham L, Schuler E, Wiedemann M, Reithmann C, Seyfarth M, Sause A, Tebbenjohanns J, Schade A, Shin DI, Staudt A, Zacharzowsky U, Andrie R, Wetzel U, Neuser H, Wunderlich C, Kuhlen R, Tijssen JGP, Hindricks G, Bollmann A. In-hospital mortality of patients with atrial arrhythmias: insights from the German-wide Helios hospital network of 161 502 patients and 34 025 arrhythmia-related procedures. Eur Heart J 2018;39:39473957.
- Katritsis DG, Zografos T, Siontis KC, Giannopoulos G, Muthalaly RG, Liu Q, Latchamsetty R, Varga Z, Deftereos S, Swerdlow C, Callans DJ, Miller JM, Morady F, John RM, Stevenson WG. End-points for successful slow pathway catheter ablation in typical and atypical atrioventricular nodal reentrant tachycardia: a contemporary, multicenter study. JACC Clin Electrophysiol 2019;5:113119.
- Kastor JA. Multifocal atrial tachycardia. N Engl J Med 1990;322:17131717.
- Bradley DJ, Fischbach PS, Law IH, Serwer GA, Dick M II. The clinical course of multifocal atrial tachycardia in infants and children. J Am Coll Cardiol 2001;38:401408.
- Iseri LT, Fairshter RD, Hardemann JL, Brodsky MA. Magnesium and potassium therapy in multifocal atrial tachycardia. Am Heart J 1985;110:789794.
- Marchlinski FE, Miller JM. Atrial arrhythmias exacerbated by theophylline: response to verapamil and evidence for triggered activity in man. Chest 1985;88:931934.
- Salerno DM, Anderson B, Sharkey PJ, Iber C. Intravenous verapamil for treatment of multifocal atrial tachycardia with and without calcium pretreatment. Ann Intern Med 1987;107:623628.
- Arsura E, Lefkin AS, Scher DL, Solar M, Tessler S. A randomized, double-blind, placebo-controlled study of verapamil and metoprolol in treatment of multifocal atrial tachycardia. Am J Med 1988;85:519524. 215. Pierce WJ, McGroary K. Multifocal atrial tachycardia and Ibutilide. Am J Geriatr Cardiol 2001;10:193195.
- Ueng KC, Lee SH, Wu DJ, Lin CS, Chang MS, Chen SA. Radiofrequency catheter modification of atrioventricular junction in patients with COPD and medically refractory multifocal atrial tachycardia. Chest 2000;117:5259.
- Hazard PB, Burnett CR. Verapamil in multifocal atrial tachycardia: hemodynamic and respiratory changes. Chest 1987;91:6870. 218. Levine JH, Michael JR, Guarnieri T. Treatment of multifocal atrial tachycardia with verapamil. N Engl J Med 1985;312:2125.
- Hazard PB, Burnett CR. Treatment of multifocal atrial tachycardia with metoprolol. Crit Care Med 1987;15:2025.
- Saoudi N, Cosio F, Waldo A, Chen S-A, Iesaka Y, Lesh M, Saksena S, Salerno J, Schoels W. Classification of atrial flutter and regular atrial tachycardia according to electrophysiologic mechanism and anatomic bases: a statement from a joint expert group from the Working Group of Arrhythmias of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. J Cardiovasc Electrophysiol 2001;12:852866.
- Saoudi N, Nair M, Abdelazziz A, Poty H, Daou A, Anselme F, Letac B. Electrocardiographic patterns and results of radiofrequency catheter ablation of clockwise type I atrial flutter. J Cardiovasc Electrophysiol 1996;7:931942.
- Olgin JE, Kalman JM, Fitzpatrick AP, Lesh MD. Role of right atrial endocardial structures as barriers to conduction during human type I atrial flutter. Activation and entrainment mapping guided by intracardiac echocardiography. Circulation 1995;92:18391848.
- Chugh A, Latchamsetty R, Oral H, Elmouchi D, Tschopp D, Reich S, Igic P, Lemerand T, Good E, Bogun F, Pelosi F Jr, Morady F. Characteristics of cavotricuspid isthmus-dependent atrial flutter after left atrial ablation of atrial fibrillation. Circulation 2006;113:609615.
- Stevenson IH, Kistler PM, Spence SJ, Vohra JK, Sparks PB, Morton JB, Kalman JM. Scar-related right atrial macroreentrant tachycardia in patients without prior atrial surgery: electroanatomic characterization and ablation outcome. Heart Rhythm 2005;2:594601.
- Havr anek S, Simek J, Stovıcek P, Wichterle D. Distribution of mean cycle length in cavo-tricuspid isthmus dependent atrial flutter. Physiol Res 2012;61: 4351.
- Barbato G, Carinci V, Tomasi C, Frassineti V, Margheri M, Di Pasquale G. Is electrocardiography a reliable tool for identifying patients with isthmusdependent atrial flutter? Europace 2009;11:10711076.
- Halligan SC, Gersh BJ, Brown RD Jr, Rosales AG, Munger TM, Shen WK, Hammill SC, Friedman PA. The natural history of lone atrial flutter. Ann Intern Med 2004;140:265268.
- Chinitz JS, Gerstenfeld EP, Marchlinski FE, Callans DJ. Atrial fibrillation is common after ablation of isolated atrial flutter during long-term follow-up. Heart Rhythm 2007;4:10291033.
- Pe ´rez FJ, Schubert CM, Parvez B, Pathak V, Ellenbogen KA, Wood MA. Longterm outcomes after catheter ablation of cavo-tricuspid isthmus dependent atrial flutter. A meta-analysis. Circ Arrhythm Electrophysiol 2009;2:393401.
- Reithmann C, Hoffmann E, Spitzlberger G, Dorwarth U, Gerth A, Remp T, Steinbeck G. Catheter ablation of atrial flutter due to amiodarone therapy for paroxysmal atrial fibrillation. Eur Heart J 2000;21:565572.
- Bertaglia E, Bonso A, Zoppo F, Proclemer A, Verlato R, Cor O L, Mantovan R, Themistoclakis S, Raviele A, Pascotto P. Different clinical courses and predictors of atrial fibrillation occurrence after transisthmic ablation in patients with preablation lone atrial flutter, coexistent atrial fibrillation, and drug induced atrial flutter. Pacing Clin Electrophysiol 2004;27:15071512.
- Nabar A, Rodriguez LM, Timmermans C, van Mechelen R, Wellens HJJ. Class IC antiarrhythmic drug induced atrial flutter: electrocardiographic and electrophysiological findings and their importance for long term outcome after right atrial isthmus ablation. Heart 2001;85:424429.
- Luchsinger JA, Steinberg JS. Resolution of cardiomyopathy after ablation of atrial flutter. J Am Coll Cardiol 1998;32:205210.
- Pizzale S, Lemery R, Green MS, Gollob MH, Tang ASL, Birnie DH. Frequency and predictors of tachycardia-induced cardiomyopathy in patients with persistent atrial flutter. Can J Cardiol 2009;25:469472.
- Ellenbogen KA, Dias VC, Cardello FP, Strauss WE, Simonton CA, Pollak SJ, Wood MA, Stambler BS. Safety and efficacy of intravenousdiltiazem in atrial fibrillation or atrial flutter. Am J Cardiol 1995;75:4549.
- Salerno DM, Dias VC, Kleiger RE, Tschida VH, Sung RJ, Sami M, Giorgi LV. Efficacy and safety of intravenous diltiazem for treatment of atrial fibrillation and atrial flutter. Am J Cardiol 1989;63:10461051.
- Platia EV, Michelson EL, Porterfield JK, Das G. Esmolol versus verapamil in the acute treatment of atrial fibrillation or atrial flutter. Am J Cardiol 1989;63:925929.
- Ellenbogen KA, Dias VC, Plumb VJ, Heywood JT, Mirvis DM. A placebocontrolled trial of continuous intravenous diltiazem infusion for 24-hour heart rate control during atrial fibrillation and atrial flutter: a multicenter study. J Am Coll Cardiol 1991;18:891897.
- Delle Karth G, Geppert A, Neunteufl T, Priglinger U, Haumer M, Gschwandtner M, Siostrzonek P, Heinz G. Amiodarone versus diltiazem for rate control in critically ill patients with atrial tachyarrhythmias. Crit Care Med 2001;29:11491153.
- Clemo HF, Wood MA, Gilligan DM, Ellenbogen KA. Intravenous amiodarone for acute heart rate control in the critically ill patient with atrial tachyarrhythmias. Am J Cardiol 1998;81:594598.
- Ghali WA, Wasil BI, Brant R, Exner DV, Cornuz J. Atrial flutter and the risk of thromboembolism: a systematic review and meta-analysis. Am J Med 2005;118:101107.
- Vadmann H, Nielsen PB, Hjortshøj SP, Riahi S, Rasmussen LH, Lip GYH, Larsen TB. Atrial flutter and thromboembolic risk: a systematic review. Heart 2015;101:14461455.
- Seidl K, Hauer B, Schwick NG, Zellner D, Zahn R, Senges J. Risk of thromboembolic events in patients with atrial flutter. Am J Cardiol 1998;82:580583.
- Wood KA, Eisenberg SJ, Kalman JM, Drew BJ, Saxon LA, Lee RJ, Lesh MD, Scheinman MM. Risk of thromboembolism in chronic atrial flutter. Am J Cardiol 1997;79:10431047.
- Lin YS, Chen YL, Chen TH, Lin MS, Liu CH, Yang TY, Chung CM, Chen MC. Comparison of clinical outcomes among patients with atrial fibrillation or atrial flutter stratified by CHA2DS2-VASc score. JAMA Netw Open 2018;1:e180941.
- Chen YL, Lin YS, Wang HT, Liu WH, Chen HC, Chen MC. Clinical outcomes of solitary atrial flutter patients using anticoagulation therapy: a national cohort study. Europace 2019;21:313321.
- Schmidt H, von der Recke G, Illien S, Lewalter T, Schimpf R, Wolpert C, Becher H, Lu¨deritz B, Omran H. Prevalence of left atrial chamber and appendage thrombi in patients with atrial flutter and its clinical significance. J Am Coll Cardiol 2001;38:778784.
- Gallagher MM, Guo X-H, Poloniecki JD, Guan Yap Y, Ward D, Camm AJ. Initial energy setting, outcome and efficiency in direct current cardioversion of atrial fibrillation and flutter. J Am Coll Cardiol 2001;38:14981504.
- Van Gelder IC, Crijns HJ, Van Gilst WH, Verwer R, Lie KI. Prediction of uneventful cardioversion and maintenance of sinus rhythm from direct-current electrical cardioversion of chronic atrial fibrillation and flutter. Am J Cardiol 1991;68:4146.
- Crijns HJGM, Van Gelder IC, Kingma JH, Dunselman PHJM, Gosselink ATM, Lie KI. Atrial flutter can be terminated by a class III antiarrhythmic drug but not by a class IC drug. Eur Heart J 1994;15:14031408.
- Stambler BS, Wood MA, Ellenbogen KA, Perry KT, Wakefield LK, VanderLugt JT. Efficacy and safety of repeated intravenous doses of ibutilide for rapid conversion of atrial flutter or fibrillation. Circulation 1996;94:16131621.
- Ellenbogen KA, Stambler BS, Wood MA, Sager PT, Wesley RC, Meissner MD, Zoble RG, Wakefield LK, Perry KT, Vanderlugtt JT, Ibutilide I. Efficacy of intravenous ibutilide for rapid termination of atrial fibrillation and atrial flutter: a dose-response study. J Am Coll Cardiol 1996;28:130136.
- Falk MDFRH, Pollak MDA, Singh MDFSN, Friedrich MDT. Intravenous dofetilide, a class III antiarrhythmic agent, for the termination of sustained atrial fibrillation or flutter. J Am Coll Cardiol 1997;29:385390.
- Stambler BS, Wood MA, Ellenbogen KA. Antiarrhythmic actions of intravenous ibutilide compared with procainamide during human atrial flutter and fibrillation: electrophysiological determinants of enhanced conversion efficacy. Circulation 1997;96:42984306.
- Volgman AS, Carberry PA, Stambler B, Lewis WR, Dunn GH, Perry KT, VanderLugt JT, Kowey PR. Conversion efficacy and safety of intravenous ibutilide compared with intravenous procainamide in patients with atrial flutter or fibrillation. J Am Coll Cardiol 1998;31:14141419.
- Vos MA, Golitsyn SR, Stangl K, Ruda MY, Van Wijk L, Harry JD, Perry KT, Touboul P, Steinbeck G, Wellens HJJ. Superiority of ibutilide (a new class III agent) over dl-sotalol in converting atrial flutter and atrial fibrillation. Heart 1998;79:568575.
- Singh S, Zoble RG, Yellen L, Brodsky MA, Feld GK, Berk M, Billing CB. Efficacy and safety of oral dofetilide in converting to and maintaining sinus rhythm in patients with chronic atrial fibrillation or atrial flutter. The Symptomatic Atrial Fibrillation Investigative Research on Dofetilide (SAFIRE-D) study 2000;102: 23852390.
- Peters RW, Shorofsky SR, Pelini M, Olsovsky M, Gold MR. Overdrive atrial pacing for conversion of atrial flutter: comparison of postoperative with nonpostoperative patients. Am Heart J 1999;137:100103.
- Gillis AM, Unterberg-Buchwald C, Schmidinger H, Massimo S, Wolfe K, Kavaney DJ, Otterness MF, Hohnloser SH. Safety and efficacy of advanced atrial pacing therapies for atrial tachyarrhythmias in patients with a new implantable dual chamber cardioverter-defibrillator. J Am Coll Cardiol 2002;40: 16531659.
- Mitchell AR, Spurrell PA, Cheatle L, Sulke N. Effect of atrial antitachycardia pacing treatments in patients with an atrial defibrillator: randomised study comparing subthreshold and nominal pacing outputs. Heart 2002;87:433437.
- Rhodes LA, Walsh EP, Saul JP. Conversion of atrial flutter in pediatric patients by transesophageal atrial pacing: a safe, effective, minimally invasive procedure. Am Heart J 1995;130:323327.
- Natale A, Newby KH, Pisano E, Leonelli F, Fanelli R, Potenza D, Beheiry S, Tomassoni G. Prospective randomized comparison of antiarrhythmic therapy versus first-line radiofrequency ablation in patients with atrial flutter. J Am Coll Cardiol 2000;35:18981904.
- Da Costa A, The´venin J, Roche F, Romeyer-Bouchard C, Abdellaoui L, Messier M, Denis L, Faure E, Gonthier R, Kruszynski G, Pages JM, Bonijoly S, Lamaison D, Defaye P, Barthe´lemy JC, Gouttard T, Isaaz K. Results from the LoireArde`che-Droˆme-Ise`re-Puy-de-Doˆme (LADIP) trial on atrial flutter, a multicentric prospective randomized study comparing amiodarone and radiofrequency ablation after the first episode of symptomatic atrial flutter. Circulation 2006;114:16761681.
- Satomi K, Chun KRJ, Tilz R, Bansch D, Ernst S, Antz M, Schmidt B, Kuck K-H, Ouyang F. Catheter ablation of multiple unstable macroreentrant tachycardia within the right atrium free wall in patients without previous cardiac surgery. Circ Arrhythm Electrophysiol 2010;3:2431.
- Jais P, Shah DC, Haissaguerre M, Hocini M, Peng JT, Takahashi A, Garrigue S, Le Metayer P, Clementy J. Mapping and ablation of left atrial flutters. Circulation 2000;101:29282934.
- Kall JG, Rubenstein DS, Kopp DE, Burke MC, Verdino RJ, Lin AC, Johnson CT, Cooke PA, Wang ZG, Fumo M, Wilber DJ. Atypical atrial flutter originating in the right atrial free wall. Circulation 2000;101:270279.
- Nakagawa H, Shah N, Matsudaira K, Overholt E, Chandrasekaran K, Beckman KJ, Spector P, Calame JD, Rao A, Hasdemir C, Otomo K, Wang Z, Lazzara R, Jackman WM. Characterization of reentrant circuit in macroreentrant right atrial tachycardia after surgical repair of congenital heart disease: isolated channels between scars allow “focal” ablation. Circulation 2001;103:699709.
- Ouyang F, Ernst S, Vogtmann T, Goya M, Volkmer M, Schaumann A, Bansch D, Antz M, Kuck K-H. Characterization of reentrant circuits in left atrial macroreentrant tachycardia: critical isthmus block can prevent atrial tachycardia recurrence. Circulation 2002;105:19341942.
- Tai C-T, Huang J-L, Lin Y-K, Hsieh M-H, Lee P-C, Ding Y-A, Chang M-S, Chen S-A. Noncontact three-dimensional mapping and ablation of upper loop reentry originating in the right atrium. J Am Coll Cardiol 2002;40:746753.
- Blackshear JL, Stambler BS, Strauss WE, Roy D, Dias VC, Beach CL, Ebener MK. Control of heart rate during transition from intravenous to oral diltiazem in atrial fibrillation or flutter. Am J Cardiol 1996;78:12461250.
- Brodsky MA, Allen BJ, Grimes JA, Gold C. Enhanced atrioventricular conduction during atrial flutter after intravenous adenosine. N Engl J Med 1994;330:288289.
- Strickberger SA, Man KC, Daoud EG, Goyal R, Brinkman K, Knight BP, Weiss R, Bahu M, Morady F. Adenosine-induced atrial arrhythmia: a prospective analysis. Ann Intern Med 1997;127:417422.
- Crozier IG, Ikram H, Kenealy M, Levy L. Flecainide acetate for conversion of acute supraventricular tachycardia to sinus rhythm. Am J Cardiol 1987;59:607609.
- Murdock CJ, Kyles AE, Yeung-Lai-Wah JA, Qi A, Vorderbrugge S, Kerr CR. Atrial flutter in patients treated for atrial fibrillation with propafenone. Am J Cardiol 1990;66:755757.
- Bianconi L, Castro A, Dinelli M, Alboni P, Pappalardo A, Richiardi E, Santini M. Comparison of intravenously administered dofetilide versus amiodarone in the acute termination of atrial fibrillation and flutter. A multicentre, randomized, double-blind, placebo-controlled study. Eur Heart J 2000;21:12651273.
- Kafkas NV, Patsilinakos SP, Mertzanos GA, Papageorgiou KI, Chaveles JI, Dagadaki OK, Kelesidis KM. Conversion efficacy of intravenous ibutilide compared with intravenous amiodarone in patients with recent-onset atrial fibrillation and atrial flutter. Int J Cardiol 2007;118:321325.
- Heisel A, Jung J, Stopp M, Schieffer H. Facilitating influence of procainamide on conversion of atrial flutter by rapid atrial pacing. Eur Heart J 1997;18:866869.
- Katritsis DG, Josephson ME. Anticoagulation for cardioversion of acute onset atrial fibrillation: time to revise guidelines? JACC Clin Electrophysiol 2016;2:495497.
- Schwartzman D, Callans DJ, Gottlieb CD, Dillon SM, Movsowitz C, Marchlinski FE. Conduction block in the inferior vena caval-tricuspid valve isthmus: association with outcome of radiofrequency ablation of type I atrial flutter. J Am Coll Cardiol 1996;28:15191531.
- De Bortoli A, Shi LB, Ohm OJ, Hoff PI, Schuster P, Solheim E, Chen J. Incidence and clinical predictors of subsequent atrial fibrillation requiring additional ablation after cavotricuspid isthmus ablation for typical atrial flutter. Scand Cardiovasc J 2017;51:123128.
- Benditt DG, Williams JH, Jin J, Deering TF, Zucker R, Browne K, Chang-Sing P, Singh BN. Maintenance of sinus rhythm with oral d,l-Sotalol therapy in patients with symptomatic atrial fibrillation and/or atrial flutter. d,l-Soltalol Atrial Fibrillation/Flutter Study Group. Am J Cardiol 1999;84:270277.
- Grimm RA, Stewart WJ, Arheart KL, Thomas JD, Klein AL. Left atrial appendage “stunning” after electrical cardioversion of atrial flutter: an attenuated response compared with atrial fibrillation as the mechanism for lower susceptibility to thromboembolic events. J Am Coll Cardiol 1997;29:582589.
- Bochoeyer A, Yang Y, Cheng J, Lee RJ, Keung EC, Marrouche NF, Natale A, Scheinman MM. Surface electrocardiographic characteristics of right and left atrial flutter. Circulation 2003;108:6066.
- Cheng J, Cabeen WR Jr, Scheinman MM. Right atrial flutter due to lower loop reentry: mechanism and anatomic substrates. Circulation 1999;99:17001705.
- Zhang S, Younis G, Hariharan R, Ho J, Yang Y, Ip J, Thakur RK, Seger J, Scheinman MM, Cheng J. Lower loop reentry as a mechanism of clockwise right atrial flutter. Circulation 2004;109:16301635.
- Yang Y, Cheng J, Bochoeyer A, Hamdan MH, Kowal RC, Page R, Lee RJ, Steiner PR, Saxon LA, Lesh MD, Modin GW, Scheinman MM. Atypical right atrial flutter patterns. Circulation 2001;103:30923098.
- Yang Y, Varma N, Badhwar N, Tanel RE, Sundara S, Lee RJ, Lee BK, Tseng ZH, Marcus GM, Kim AM, Olgin JE, Scheinman MM. Prospective observations in the clinical and electrophysiological characteristics of intra-isthmus reentry. J Cardiovasc Electrophysiol 2010;21:10991106.
- Zrenner B, Dong JUN, Schreieck J, Ndrepepa G, Meisner H, Kaemmerer H, Scho¨mig A, Hess J, Schmitt C. Delineation of intra-atrial reentrant tachycardia circuits after mustard operation for transposition of the great arteries using biatrial electroanatomic mapping and entrainment mapping. J Cardiovasc Electrophysiol 2003;14:13021310.
- Ueda A, Suman-Horduna I, Mantziari L, Gujic M, Marchese P, Ho SY, BabuNarayan SV, Ernst S. Contemporary outcomes of supraventricular tachycardia ablation in congenital heart disease: a single-center experience in 116 patients. Circ Arrhythm Electrophysiol 2013;6:606613.
- Akca F, Bauernfeind T, De Groot NMS, Shalganov T, Schwagten B, Szili-Torok T. The presence of extensive atrial scars hinders the differential diagnosis of focal or macroreentrant atrial tachycardias in patients with complex congenital heart disease. Europace 2014;16:893898.
- Shah D, Jais P, Takahashi A, Hocini M, Peng JT, Clementy J, Haissaguerre M. Dual-loop intra-atrial reentry in humans. Circulation 2000;101:631639.
- Scaglione M, Caponi D, Ebrille E, Di Donna P, Di Clemente F, Battaglia A, Raimondo C, Appendino M, Gaita F. Very long-term results of electroanatomic-guided radiofrequency ablation of atrial arrhythmias in patients with surgically corrected atrial septal defect. Europace 2014;16:18001807.
- Gucuk Ipek E, Marine JE, Habibi M, Chrispin J, Lima J, Rickard J, Spragg D, Zimmerman SL, Zipunnikov V, Berger R, Calkins H, Nazarian S. Association of left atrial function with incident atypical atrial flutter after atrial fibrillation ablation. Heart Rhythm 2016;13:391398.
- Gerstenfeld EP, Callans DJ, Dixit S, Russo AM, Nayak H, Lin D, Pulliam W, Siddique S, Marchlinski FE. Mechanisms of organized left atrial tachycardias occurring after pulmonary vein isolation. Circulation 2004;110:13511357.
- Wasmer K, Mo¨nnig G, Bittner A, Dechering D, Zellerhoff S, Milberg P, Ko¨be J, Eckardt L. Incidence, characteristics, and outcome of left atrial tachycardias after circumferential antral ablation of atrial fibrillation. Heart Rhythm 2012;9:16601666.
- Satomi K, B€ansch D, Tilz R, Chun J, Ernst S, Antz M, Greten H, Kuck K-H, Ouyang F. Left atrial and pulmonary vein macroreentrant tachycardia associated with double conduction gaps: a novel type of man-made tachycardia after circumferential pulmonary vein isolation. Heart Rhythm 2008;5:4351.
- Katritsis D, Wood MA, Shepard RK, Giazitzoglou E, Kourlaba G, Ellenbogen KA. Atrial arrhythmias following ostial or circumferential pulmonary vein ablation. J Interv Card Electrophysiol 2006;16:123130.
- Barbhaiya CR, Baldinger SH, Kumar S, Chinitz JS, Enriquez AD, John R, Stevenson WG, Michaud GF. Downstream overdrive pacing and intracardiac concealed fusion to guide rapid identification of atrial tachycardia after atrial fibrillation ablation. Europace 2018;20:596603.
- Johner N, Shah DC, Jousset F, Dall’Aglio PB, Namdar M. Electrophysiological and anatomical correlates of sites with postpacing intervals shorter than tachycardia cycle length in atypical atrial flutter. Circ Arrhythm Electrophysiol 2019;12:e006955.
- Yokokawa M, Latchamsetty R, Ghanbari H, Belardi D, Makkar A, Roberts B, Saint-Phard W, Sinno M, Carrigan T, Kennedy R, Suwanagool A, Good E, Crawford T, Jongnarangsin K, Pelosi F, Bogun F, Oral H, Morady F, Chugh A. Characteristics of atrial tachycardia due to small vs large reentrant circuits after ablation of persistent atrial fibrillation. Heart Rhythm 2013;10:469476.
- Chang S-L, Tsao H-M, Lin Y-J, Lo L-W, Hu Y-F, Tuan T-C, Tsai W-C, Chang CJ, Suenari K, Huang S-Y, Tai C-T, Li C-H, Chao T-F, Wu T-J, Chen S-A. Differentiating macroreentrant from focal atrial tachycardias occurred after circumferential pulmonary vein isolation. J Cardiovasc Electrophysiol 2011;22:748755.
- Gerstenfeld EP, Dixit S, Bala R, Callans DJ, Lin D, Sauer W, Garcia F, Cooper J, Russo AM, Marchlinski FE. Surface electrocardiogram characteristics of atrial tachycardias occurring after pulmonary vein isolation. Heart Rhythm 2007;4:11361143.
- Markowitz SM, Brodman RF, Stein KM, Mittal S, Slotwiner DJ, Iwai S, Das MK, Lerman BB. Lesional tachycardias related to mitral valve surgery. J Am Coll Cardiol 2002;39:19731983.
- Takahashi K, Miyauchi Y, Hayashi M, Iwasaki Y-k, Yodogawa K, Tsuboi I, Hayashi H, Oka E, Ito Hagiwara K, Fujimoto Y, Shimizu W. Mechanisms of postoperative atrial tachycardia following biatrial surgical ablation of atrial fibrillation in relation to the surgical lesion sets. Heart Rhythm 2016;13:10591065.
- Zhang J, Tang C, Zhang Y, Han H, Li Z, Su XI. Electroanatomic characterization and ablation outcome of nonlesion related left atrial macroreentrant tachycardia in patients without obvious structural heart disease. J Cardiovasc Electrophysiol 2013;24:5359.
- Fukamizu S, Sakurada H, Hayashi T, Hojo R, Komiyama K, Tanabe Y, Tejima T, Nishizaki M, Kobayashi Y, Hiraoka M. Macroreentrant atrial tachycardia in patients without previous atrial surgery or catheter ablation: clinical and electrophysiological characteristics of scar-related left atrial anterior wall reentry. J Cardiovasc Electrophysiol 2013;24:404412.
- Marrouche NF, Natale A, Wazni OM, Cheng J, Yang Y, Pollack H, Verma A, Ursell P, Scheinman MM. Left septal atrial flutter: electrophysiology, anatomy, and results of ablation. Circulation 2004;109:24402447.
- Sawhney N, Anand K, Robertson CE, Wurdeman T, Anousheh R, Feld GK. Recovery of mitral isthmus conduction leads to the development of macroreentrant tachycardia after left atrial linear ablation for atrial fibrillation. Circ Arrhythm Electrophysiol 2011;4:832837.
- Miyazaki S, Shah AJ, Hocini M, Haı¨ssaguerre M, Jaı¨s P. Recurrent spontaneous clinical perimitral atrial tachycardia in the context of atrial fibrillation ablation. Heart Rhythm 2015;12:104110.
- Ammar S, Luik A, Hessling G, Bruhm A, Reents T, Semmler V, Buiatti A, Kathan S, Hofmann M, Kolb C, Schmitt C, Deisenhofer I. Ablation of perimitral flutter: acute and long-term success of the modified anterior line. Europace 2015;17:447452.
- Chugh A, Oral H, Lemola K, Hall B, Cheung P, Good E, Tamirisa K, Han J, Bogun F, Pelosi F, Morady F. Prevalence, mechanisms, and clinical significance of macroreentrant atrial tachycardia during and following left atrial ablation for atrial fibrillation. Heart Rhythm 2005;2:464471.
- Nikolaidou T, Aslanidi OV, Zhang H, Efimov IR. Structurefunction relationship in the sinus and atrioventricular nodes. Pediatr Cardiol 2012;33:890899.
- Hucker WJ, McCain ML, Laughner JI, Iaizzo PA, Efimov IR. Connexin 43 expression delineates two discrete pathways in the human atrioventricular junction. Anat Rec (Hoboken) 2008;291:204215.
- Katritsis DG, Efimov IR. Cardiac connexin genotyping for identification of the circuit of atrioventricular nodal re-entrant tachycardia. Europace 2018;21:190191.
- Katritsis DG, Becker AE, Ellenbogen KA, Giazitzoglou E, Korovesis S, Camm AJ. Effect of slow pathway ablation in atrioventricular nodal reentrant tachycardia on the electrophysiologic characteristics of the inferior atrial inputs to the human atrioventricular node. Am J Cardiol 2006;97:860865.
- Katritsis DG, Ellenbogen KA, Becker AE, Camm AJ. Retrograde slow pathway conduction in patients with atrioventricular nodal re-entrant tachycardia. Europace 2007;9:458465.
- Katritsis DG, Sepahpour A, Marine JE, Katritsis GD, Tanawuttiwat T, Calkins H, Rowland E, Josephson ME. Atypical atrioventricular nodal reentrant tachycardia: prevalence, electrophysiologic characteristics, and tachycardia circuit. Europace 2015;17:10991106.
- Pentinga ML, Meeder JG, Crijns HJGM, de Muinck ED, Wiesfeld ACP, Lie KI. Late onset atrioventricular nodal tachycardia. Int J Cardiol 1993;38:293298.
- D’Este D, Zoppo F, Bertaglia E, Zerbo F, Picciolo A, Scarabeo V, Pascotto A, Pascotto P. Long-term outcome of patients with atrioventricular node reentrant tachycardia. Int J Cardiol 2007;115:350353.
- Sauer WH, Alonso C, Zado E, Cooper JM, Lin D, Dixit S, Russo A, Verdino R, Ji S, Gerstenfeld EP, Callans DJ, Marchlinski FE. Atrioventricular nodal reentrant tachycardia in patients referred for atrial fibrillation ablation: response to ablation that incorporates slow-pathway modification. Circulation 2006;114:191195.
- Michowitz Y, Anis-Heusler A, Reinstein E, Tovia-Brodie O, Glick A, Belhassen B. Familial occurrence of atrioventricular nodal reentrant tachycardia. Circ Arrhythm Electrophysiol 2017;10:e004680.
- Katritsis DG, Josephson ME. Classification, electrophysiological features and therapy of atrioventricular nodal reentrant tachycardia. Arrhythm Electrophysiol Rev 2016;5:130135.
- Katritsis DG, Camm AJ. Atrioventricular nodal reentrant tachycardia. Circulation 2010;122:831840.
- Katritsis DG, Josephson ME. Classification of electrophysiological types of atrioventricular nodal re-entrant tachycardia: a reappraisal. Europace 2013;15:12311240.
- Yamabe H, Tanaka Y, Morihisa K, Uemura T, Enomoto K, Kawano H, Ogawa H. Analysis of the anatomical tachycardia circuit in verapamil-sensitive atrial tachycardia originating from the vicinity of the atrioventricular node. Circ Arrhythm Electrophysiol 2010;3:5462.
- Engelstein ED, Stein KM, Markowitz SM, Lerman BB. Posterior fast atrioventricular node pathways: Implications for radiofrequency catheter ablation of atrioventricular node reentrant tachycardia. J Am Coll Cardiol 1996;27:10981105.
- Katritsis DG, Ellenbogen KA, Becker AE. Atrial activation during atrioventricular nodal reentrant tachycardia: studies on retrograde fast pathway conduction. Heart Rhythm 2006;3:9931000.
- Nam G-B, Rhee K-S, Kim JUN, Choi K-J, Kim Y-H. Left atrionodal connections in typical and atypical atrioventricular nodal reentrant tachycardias: activation sequence in the coronary sinus and results of radiofrequency catheter ablation. J Cardiovasc Electrophysiol 2006;17:171177.
- Katritsis DG, Marine JE, Latchamsetty R, Zografos T, Tanawuttiwat T, Sheldon SH, Buxton AE, Calkins H, Morady F, Josephson ME. Coexistent types of atrioventricular nodal re-entrant tachycardia. Implications for the tachycardia circuit. Circ Arrhythm Electrophysiol 2015;8:11891193.
- Miljoen H, Ector J, Garweg C, Saenen J, Huybrechts W, Sarkozy A, Willems R, Heidbuchel H. Differential presentation of atrioventricular nodal re-entrant tachycardia in athletes and non-athletes. Europace 2019;21:944949.
- Nawata H, Yamamoto N, Hirao K, Miyasaka N, Kawara T, Hiejima K, Harada T, Suzuki F. Heterogeneity of anterograde fast-pathway and retrograde slowpathway conduction patterns in patients with the fastslow form of atrioventricular nodal reentrant tachycardia: electrophysiologic and electrocardiographic considerations. J Am Coll Cardiol 1998;32:17311740.
- Hwang C, Martin DJ, Goodman JS, Gang ES, Mandel WJ, Swerdlow CD, Peter CT, Chen P-S. Atypical atrioventricular node reciprocating tachycardia masquerading as tachycardia using a left-sided accessory pathway. J Am Coll Cardiol 1997;30:218225.
- Sakabe K, Wakatsuki T, Fujinaga H, Oishi Y, Ikata J, Toyoshima T, Hiura N, Nishikado A, Oki T, Ito S. Patient with atrioventricular node reentrant tachycardia with eccentric retrograde left-sided activation: treatment with radiofrequency catheter ablation. Jpn Heart J 2000;41:227234.
- Vijayaraman P, Kok LC, Rhee B, Ellenbogen KA. Unusual variant of atrioventricular nodal reentrant tachycardia. Heart Rhythm 2005;2:100102. 335. Heidbuchel H, Jackman WM. Characterization of subforms of AV nodal reentrant tachycardia. Europace 2004;6:316329.
- Katritsis DG, Zografos T, Katritsis GD, Giazitzoglou E, Vachliotis V, Paxinos G, Camm AJ, Josephson ME. Catheter ablation vs. antiarrhythmic drug therapy in patients with symptomatic atrioventricular nodal re-entrant tachycardia: a randomized, controlled trial. Europace 2017;19:602606.
- Katritsis DG, John RM, Latchamsetty R, Muthalaly RG, Zografos T, Katritsis GD, Stevenson WG, Efimov IR, Morady F. Left septal slow pathway ablation for atrioventricular nodal reentrant tachycardia. Circ Arrhythm Electrophysiol 2018;11:e005907.
- Katritsis DG, Marine JE, Contreras FM, Fujii A, Latchamsetty R, Siontis KC, Katritsis GD, Zografos T, John RM, Epstein LM, Michaud GF, Anter E, Sepahpour A, Rowland E, Buxton AE, Calkins H, Morady F, Stevenson WG, Josephson ME. Catheter ablation of atypical atrioventricular nodal reentrant tachycardia. Circulation 2016;134:16551663.
- Stavrakis S, Jackman WM, Lockwood D, Nakagawa H, Beckman K, Elkholey K, Wang Z, Po SS. Slow/fast atrioventricular nodal reentrant tachycardia using the inferolateral left atrial slow pathway. Circ Arrhythm Electrophysiol 2018;11:e006631.
- Rinkenberger RL, Prystowsky EN, Heger JJ, Troup PJ, Jackman WM, Zipes DP. Effects of intravenous and chronic oral verapamil administration in patients with supraventricular tachyarrhythmias. Circulation 1980;62:9961010.
- Winniford MD, Fulton KL, Hills LD. Long-term therapy of paroxysmal supraventricular tachycardia: a randomized, double-blind comparison of digoxin, propranolol and verapamil. Am J Cardiol 1984;54:11381139.
- Alboni P, Tomasi C, Menozzi C, Bottoni N, Paparella N, Fuc a G, Brignole M, Cappato R. Efficacy and safety of out-of-hospital self-administered single-dose oral drug treatment in the management of infrequent, well-tolerated paroxysmal supraventricular tachycardia. J Am Coll Cardiol 2001;37:548553.
- Yeh SJ, Lin FC, Chou YY, Hung JS, Wu D. Termination of paroxysmal supraventricular tachycardia with a single oral dose of diltiazem and propranolol. Circulation 1985;71:104109.
- Musto B, Cavallaro C, Musto A, D’Onofrio A, Belli A, De Vincentis L. Flecainide single oral dose for management of paroxysmal supraventricular tachycardia in children and young adults. Am Heart J 1992;124:110115.
- Goldberg AS, Bathina MN, Mickelsen S, Nawman R, West G, Kusumoto FM. Long-term outcomes on quality-of-life and health care costs in patients with supraventricular tachycardia (radiofrequency catheter ablation versus medical therapy). Am J Cardiol 2002;89:11201123.
- Larson MS, McDonald K, Young C, Sung R, Hlatky MA. Quality of life before and after radiofrequency catheter ablation in patients with drug refractory atrioventricular nodal reentrant tachycardia. Am J Cardiol 1999;84: 471473.
- Bathina M, Mickelsen S, Brooks C, Jaramillo J, Hepton T, Kusumoto F. Radiofrequency catheter ablation versus medical therapy for initial treatment of supraventricular tachycardia and its impact on quality of life and healthcare costs. Am J Cardiol 1998;82:589593.
- Cheng CF, Sanders GD, Hlatky MA, Heidenreich P, McDonald KM, Lee BK, Larson MS, Owens DK. Cost-effectiveness of radiofrequency ablation for supraventricular tachycardia. Ann Intern Med 2000;133:864876.
- Kalbfleisch SJ, Calkins H, Langberg JJ, El-Atassi R, Leon A, Borganelli M, Morady F. Comparison of the cost of radiofrequency catheter modification of the atrioventricular node and medical therapy for drug-refractory atrioventricular node reentrant tachycardia. J Am Coll Cardiol 1992;19:15831587.
- Kalbfleisch SJ, Strickberger SA, Williamson B, Vorperian VR, Man C, Hummel JD, Langberg JJ, Morady F. Randomized comparison of anatomic and electrogram mapping approaches to ablation of the slow pathway of atrioventricular node reentrant tachycardia. J Am Coll Cardiol 1994;23:716723.
- Katritsis DG, Giazitzoglou E, Zografos T, Ellenbogen KA, Camm AJ. An approach to left septal slow pathway ablation. J Interv Card Electrophysiol 2011;30:7379.
- Morady F. Catheter ablation of supraventricular arrhythmias: state of the art. Heart Rhythm 2004;1:C67C84.
- Van Hare GF, Javitz H, Carmelli D, Saul JP, Tanel RE, Fischbach PS, Kanter RJ, Schaffer M, Dunnigan A, Colan S, Serwer G; Pediatric Electrophysiology Society. Prospective assessment after pediatric cardiac ablation: demographics, medical profiles, and initial outcomes. J Cardiovasc Electrophysiol 2004;15:759770.
- Katritsis DG. Catheter ablation of atrioventricular nodal re-entrant tachycardia: facts and fiction. Arrhythm Electrophysiol Rev 2018;7:230231.
- Chen H, Shehata M, Ma W, Xu J, Cao J, Cingolani E, Swerdlow C, Chen M, Chugh SS, Wang X. Atrioventricular block during slow pathway ablation: entirely preventable? Circ Arrhythm Electrophysiol 2015;8:739744.
- Papagiannis J, Beissel DJ, Krause U, Cabrera M, Telishevska M, Seslar S, Johnsrude C, Anderson C, Tisma-Dupanovic S, Connelly D, Avramidis D, Carter C, Kornyei L, Law I, Von Bergen N, Janusek J, Silva J, Rosenthal E, Willcox M, Kubus P, Hessling G, Paul T; Paediatric and Congenital Electrophysiology Society. Atrioventricular nodal reentrant tachycardia in patients with congenital heart disease. Outcome after catheter ablation. Circ Arrhythm Electrophysiol 2017;10:e004869.
- Backhoff D, Klehs S, Mu¨ller MJ, Schneider HE, Kriebel T, Paul T, Krause U. Long-term follow-up after catheter ablation of atrioventricular nodal reentrant tachycardia in children. Circ Arrhythm Electrophysiol 2016;9:e004264.
- Skeberis V, Simonis F, Tsakonas K, Celiker Alp AY, Andries E, Brugada P. Inappropriate sinus tachycardia following radiofrequency ablation of AV nodal tachycardia: incidence and clinical significance. Pacing Clin Electrophysiol 1994;17:924927.
- Rostock T, Risius T, Ventura R, Klemm HU, Weiss C, Keitel A, Meinertz T, Willems S. Efficacy and safety of radiofrequency catheter ablation of atrioventricular nodal reentrant tachycardia in the elderly. J Cardiovasc Electrophysiol 2005;16:608610.
- Li YG, Gronefeld G, Bender B, Machura C, Hohnloser SH. Risk of development of delayed atrioventricular block after slow pathway modification in patients with atrioventricular nodal reentrant tachycardia and a pre-existing prolonged PR interval. Eur Heart J 2001;22:8995.
- Deisenhofer I, Zrenner B, Yin Y-h, Pitschner H-F, Kuniss M, Grossmann G, Stiller S, Luik A, Veltmann C, Frank J, Linner J, Estner HL, Pflaumer A, Wu J, von Bary C, Ucer E, Reents T, Tzeis S, Fichtner S, Kathan S, Karch MR, Jilek C, Ammar S, Kolb C, Liu Z-C, Haller B, Schmitt C, Hessling G. Cryoablation versus radiofrequency energy for the ablation of atrioventricular nodal reentrant tachycardia (the CYRANO Study): results from a large multicenter prospective randomized trial. Circulation 2010;122:22392245.
- Hanninen M, Yeung-Lai-Wah N, Massel D, Gula LJ, Skanes AC, Yee R, Klein GJ, Manlucu J, Leong-Sit P. Cryoablation versus RF ablation for AVNRT: a metaanalysis and systematic review. J Cardiovasc Electrophysiol 2013;24:13541360.
- Matta M, Anselmino M, Scaglione M, Vitolo M, Ferraris F, Di Donna P, Caponi D, Castagno D, Gaita F. Cooling dynamics: a new predictor of long-term efficacy of atrioventricular nodal reentrant tachycardia cryoablation. J Interv Card Electrophysiol 2017;48:333341.
- Pieragnoli P, Paoletti Perini A, Checchi L, Carrassa G, Giomi A, Carrai P, Michelucci A, Padeletti L, Ricciardi G. Cryoablation of typical AVNRT: younger age and administration of bonus ablation favor long-term success. Heart Rhythm 2015;12:21252131.
- Enriquez A, Ellenbogen KA, Boles U, Baranchuk A. Atrioventricular nodal reentrant tachycardia in implantable cardioverter defibrillators: diagnosis and troubleshooting. J Cardiovasc Electrophysiol 2015;26:12821288.
- Walsh EP, Saul JP, Sholler GF, Triedman JK, Jonas RA, Mayer JE, Wessel DL. Evaluation of a staged treatment protocol for rapid automatic junctional tachycardia after operation for congenital heart disease. J Am Coll Cardiol 1997;29:10461053.
- Cools E, Missant C. Junctional ectopic tachycardia after congenital heart surgery. Acta Anaesthesiol Belg 2014;65:18.
- Collins KK, Van Hare GF, Kertesz NJ, Law IH, Bar-Cohen Y, Dubin AM, Etheridge SP, Berul CI, Avari JN, Tuzcu V, Sreeram N, Schaffer MS, Fournier A, Sanatani S, Snyder CS, Smith RT Jr, Arabia L, Hamilton R, Chun T, Liberman L, Kakavand B, Paul T, Tanel RE. Pediatric nonpost-operative junctional ectopic tachycardia medical management and interventional therapies. J Am Coll Cardiol 2009;53:690697.
- Hamdan M, Van Hare GF, Fisher W, Gonzalez R, Dorostkar P, Lee R, Lesh M, Saxon L, Kalman J, Scheinman M. Selective catheter ablation of the tachycardia focus in patients with nonreentrant junctional tachycardia. Am J Cardiol 1996;78:12921297.
- Ruder MA, Davis JC, Eldar M, Abbott JA, Griffin JC, Seger JJ, Scheinman MM. Clinical and electrophysiologic characterization of automatic junctional tachycardia in adults. Circulation 1986;73:930937.
- Fishenfeld J, Desser KB, Benchimol A. Non-paroxysmal A-V junctional tachycardia associated with acute myocardial infarction. Am Heart J 1973;86:754758.
- Kumagai K, Yamato H, Yamanouchi Y, Matsuo K, Tashiro N, Hiroki T, Arakawa K. Automatic junctional tachycardia in an adult. Clinical Cardiology 1990;13:813816.
- Cook JR, Steinberg JS. An incessant form of junctional ectopic tachycardia in an adult responsive to a class 1C agent. Am Heart J 1991;122:14871489.
- Amrousy DE, Elshehaby W, Feky WE, Elshmaa NS. Safety and efficacy of prophylactic amiodarone in preventing early junctional ectopic tachycardia (JET) in children after cardiac surgery and determination of its risk factor. Pediatr Cardiol 2016;37:734739.
- Entenmann A, Michel M, Herberg U, Haas N, Kumpf M, Gass M, Egender F, Gebauer R. Management of postoperative junctional ectopic tachycardia in pediatric patients: a survey of 30 centers in Germany, Austria, and Switzerland. Eur J Pediatr 2017;176:12171226.
- Raja P, Hawker RE, Chaikitpinyo A, Cooper SG, Lau KC, Nunn GR, Cartmill TB, Sholler GF. Amiodarone management of junctional ectopic tachycardia after cardiac surgery in children. Br Heart J 1994;72:261265.
- Sarubbi B, Musto B, Ducceschi V, D‘Onofrio A, Cavallaro C, Vecchione F, Musto C, Calabr o R. Congenital junctional ectopic tachycardia in children and adolescents: a 20 year experience based study. Heart 2002;88:188190.
- Dieks J-K, Klehs S, Mu¨ller MJ, Paul T, Krause U. Adjunctive ivabradine in combination with amiodarone: A novel therapy for pediatric congenital junctional ectopic tachycardia. Heart Rhythm 2016;13:12971302.
- Al-Ghamdi S, Al-Fayyadh MI, Hamilton RM. Potential new indication for ivabradine: treatment of a patient with congenital junctional ectopic tachycardia. J Cardiovasc Electrophysiol 2013;24:822824.
- Kuck K-H, Kunze K-P, Schlu¨ter M, Duckeck W. Encainide versus flecainide for chronic atrial and junctional ectopic tachycardia. Am J Cardiol 1988;62:L37L44.
- Paul T, Reimer A, Janousek J, Kallfelz H-C. Efficacy and safety of propafenone in congenital junctional ectopic tachycardia. J Am Coll Cardiol 1992;20:911914.
- Hamdan MH, Badhwar N, Scheinman MM. Role of invasive electrophysiologic testing in the evaluation and management of adult patients with focal junctional tachycardia. Card Electrophysiol Rev 2002;6:431435.
- Law IH, Von Bergen NH, Gingerich JC, Saarel EV, Fischbach PS, Dick M. Transcatheter cryothermal ablation of junctional ectopic tachycardia in the normal heart. Heart Rhythm 2006;3:903907.
- Jackowska-Zduniak B, Forys U. Mathematical model of the atrioventricular nodal double response tachycardia and double-fire pathology. Math Biosci Eng 2016;13:11431158.
- Peiker C, Pott C, Eckardt L, Kelm M, Shin DI, Willems S, Meyer C. Dual atrioventricular nodal non-re-entrant tachycardia. Europace 2016;18:332339.
- Yokoshiki H, Sasaki K, Shimokawa J, Sakurai M, Tsutsui H. Nonreentrant atrioventricular nodal tachycardia due to triple nodal pathways manifested by radiofrequency ablation at coronary sinus ostium. J Electrocardiol 2006;39:395399.
- Itagaki T, Ohnishi Y, Inoue T, Yokoyama M. Linking phenomenon in dual atrioventricular nodal pathways. Jpn Circ J 2001;65:937940.
- Arena G, Bongiorni MG, Soldati E, Gherarducci G, Mariani M. Incessant nonreentrant atrioventricular nodal tachycardia due to multiple nodal pathways treated by radiofrequency ablation of the slow pathways. J Cardiovasc Electrophysiol 1999;10:16361642.
- Wang NC. Dual atrioventricular nodal nonreentrant tachycardia: a systematic review. Pacing Clin Electrophysiol 2011;34:16711681.
- Ho SY. Accessory atrioventricular pathways: getting to the origins. Circulation 2008;117:15021504.
- Jackman WM, Wang XZ, Friday KJ, Roman CA, Moulton KP, Beckman KJ, McClelland JH, Twidale N, Hazlitt HA, Prior MI, Margolis PD, Calame JD, Overholt ED, Lazzara R. Catheter ablation of accessory atrioventricular pathways (Wolff-Parkinson-White syndrome) by radiofrequency current. N Engl J Med 1991;324:16051611.
- Katritsis D, Bashir Y, Heald S, Poloniecki J, Ward DE. Radiofrequency ablation of accessory pathways: implications of accumulated experience and time dedicated to procedures. Eur Heart J 1994;15:339344.
- Schluter M, Geiger M, Siebels J, Duckeck W, Kuck KH. Catheter ablation using radiofrequency current to cure symptomatic patients with tachyarrhythmias related to an accessory atrioventricular pathway. Circulation 1991;84:16441661.
- Liu Q, Shehata M, Lan DZ, Ehdaie A, Cingolani E, Chugh SS, Fu G, Jiang C, Wang X. Accurate localization and catheter ablation of superoparaseptal accessory pathways. Heart Rhythm 2018;15:688695.
- Kuck KH, Friday KJ, Kunze KP, Schluter M, Lazzara R, Jackman WM. Sites of conduction block in accessory atrioventricular pathways. Basis for concealed accessory pathways. Circulation 1990;82:407417.
- Cappato R, Schluter M, Weiss C, Antz M, Koschyk DH, Hofmann T, Kuck KH. Radiofrequency current catheter ablation of accessory atrioventricular pathways in Ebstein’s anomaly. Circulation 1996;94:376383.
- Bhatia A, Sra J, Akhtar M. Preexcitation syndromes. Curr Probl Cardiol 2016;41:99137.
- Koneru JN, Wood MA, Ellenbogen KA. Rare forms of preexcitation: a case study and brief overview of familial forms of preexcitation. Circ Arrhythm Electrophysiol 2012;5:e82e87.
- Xie B, Heald SC, Bashir Y, Katritsis D, Murgatroyd FD, Camm AJ, Rowland E, Ward DE. Localization of accessory pathways from the 12-lead electrocardiogram using a new algorithm. Am J Cardiol 1994;74:161165.
- Pambrun T, El Bouazzaoui R, Combes N, Combes S, Sousa P, Le Bloa M, Massoullie G, Cheniti G, Martin R, Pillois X, Duchateau J, Sacher F, Hocini M, Jais P, Derval N, Bortone A, Boveda S, Denis A, Haissaguerre M, Albenque JP. Maximal pre-excitation based algorithm for localization of manifest accessory pathways in adults. JACC Clin Electrophysiol 2018;4:10521061.
- Basiouny T, de Chillou C, Fareh S, Kirkorian G, Messier M, Sadoul N, Chevalier P, Magnin-Poull I, Blankoff I, Chen J, Touboul P, Aliot E. Accuracy and limitations of published algorithms using the twelve-lead electrocardiogram to localize overt atrioventricular accessory pathways. J Cardiovasc Electrophysiol 1999;10:13401349.
- Packer DL, Gallagher JJ, Prystowsky EN. Physiological substrate for antidromic reciprocating tachycardia. Prerequisite characteristics of the accessory pathway and atrioventricular conduction system. Circulation 1992;85:574588.
- Brembilla-Perrot B, Pauriah M, Sellal JM, Zinzius PY, Schwartz J, de Chillou C, Cismaru G, Beurrier D, Voilliot D, Selton O, Louis P, Andronache M, Nosu R, de la Chaise AT. Incidence and prognostic significance of spontaneous and inducible antidromic tachycardia. Europace 2013;15:871876.
- Ceresnak SR, Tanel RE, Pass RH, Liberman L, Collins KK, Van Hare GF, Gates GJ, Dubin AM. Clinical and electrophysiologic characteristics of antidromic tachycardia in children with Wolff-Parkinson-White syndrome. Pacing Clin Electrophysiol 2012;35:480488.
- Etheridge SP, Escudero CA, Blaufox AD, Law IH, Dechert-Crooks BE, Stephenson EA, Dubin AM, Ceresnak SR, Motonaga KS, Skinner JR, Marcondes LD, Perry JC, Collins KK, Seslar SP, Cabrera M, Uzun O, Cannon BC, Aziz PF, Kubus P, Tanel RE, Valdes SO, Sami S, Kertesz NJ, Maldonado J, Erickson C, Moore JP, Asakai H, Mill L, Abcede M, Spector ZZ, Menon S, Shwayder M, Bradley DJ, Cohen MI, Sanatani S. Life-threatening event risk in children with Wolff-Parkinson-White syndrome: a multicenter international study. JACC Clin Electrophysiol 2018;4:433444.
- Gemma LW, Steinberg LA, Prystowsky EN, Padanilam BJ. Development of rapid preexcited ventricular response to atrial fibrillation in a patient with intermittent preexcitation. J Cardiovasc Electrophysiol 2013;24:347350.
- Kang KT, Potts JE, Radbill AE, La Page MJ, Papagiannis J, Garnreiter JM, Kubus P, Kantoch MJ, Von Bergen NH, Fournier A, Coˆte´ J-M, Paul T, Anderson CC, Cannon BC, Miyake CY, Blaufox AD, Etheridge SP, Sanatani S. Permanent junctional reciprocating tachycardia in children: a multicenter experience. Heart Rhythm 2014;11:14261432.
- Moore JP, Patel PA, Shannon KM, Albers EL, Salerno JC, Stein MA, Stephenson EA, Mohan S, Shah MJ, Asakai H, Pflaumer A, Czosek RJ, Everitt MD, Garnreiter JM, McCanta AC, Papez AL, Escudero C, Sanatani S, Cain NB, Kannankeril PJ, Bratincsak A, Mandapati R, Silva JNA, Knecht KR, Balaji S. Predictors of myocardial recovery in pediatric tachycardia-induced cardiomyopathy. Heart Rhythm 2014;11:11631169.
- Kottkamp H, Hindricks G, Shenasa H, Chen X, Wichter T, Borggrefe M, Breithardt G. Variants of preexcitation–specialized atriofascicular pathways, nodofascicular pathways, and fasciculoventricular pathways: electrophysiologic findings and target sites for radiofrequency catheter ablation. J Cardiovasc Electrophysiol 1996;7:916930.
- Gandhavadi M, Sternick EB, Jackman WM, Wellens HJJ, Josephson ME. Characterization of the distal insertion of atriofascicular accessory pathways and mechanisms of QRS patterns in atriofascicular antidromic tachycardia. Heart Rhythm 2013;10:13851392.
- Haissaguerre M, Cauchemez B, Marcus F, Le Metayer P, Lauribe P, Poquet F, Gencel L, Clementy J. Characteristics of the ventricular insertion sites of accessory pathways with anterograde decremental conduction properties. Circulation 1995;91:10771085.
- Hluchy JAN, Schlegelmilch P, Schickel S, Jo¨rger URS, Jurkovicova O, Sabin GV. Radiofrequency ablation of a concealed nodoventricular Mahaim fiber guided by a discrete potential. J Cardiovasc Electrophysiol 1999;10:603610.
- Katritsis DG, Wellens HJ, Josephson ME. Mahaim accessory pathways. Arrhythm Electrophysiol Rev 2017;6:2932. 414. de Alencar Neto JN, Ramalho de Moraes SR, Back Sternick E, Wellens HJJ. Atypical bypass tracts: can they be recognized during sinus rhythm? Europace 2019;21:208218.
- Francia P, Pittalis MC, Ali H, Cappato R. Electrophysiological study and catheter ablation of a Mahaim fibre located at the mitral annulus-aorta junction. J Interv Card Electrophysiol 2008;23:153157.
- Johnson CT, Brooks C, Jaramillo J, Mickelsen S, Kusumoto FM. A left free-wall, decrementally conducting, atrioventricular (Mahaim) fiber: diagnosis at electrophysiological study and radiofrequency catheter ablation guided by direct recording of a Mahaim potential. Pacing Clin Electrophysiol 1997;20:24862488.
- Yamabe H, Okumura K, Minoda K, Yasue H. Nodoventricular Mahaim fiber connecting to the left ventricle. Am Heart J 1991;122:232234.
- Han FT, Riles EM, Badhwar N, Scheinman MM. Clinical features and sites of ablation for patients with incessant supraventricular tachycardia from concealed nodofascicular and nodoventricular tachycardias. JACC Clin Electrophysiol 2017;3:15471556.
- Hamer A, Peter T, Platt M, Mandel WJ. Effects of verapamil on supraventricular tachycardia in patients with overt and concealed Wolff-Parkinson-White syndrome. Am Heart J 1981;101:600612.
- Huycke EC, Sung RJ, Dias VC, Milstein S, Hariman RJ, Platia EV. Intravenous diltiazem for termination of reentrant supraventricular tachycardia: a placebocontrolled, randomized, double-blind, multicenter study. J Am Coll Cardiol 1989;13:538544.
- Glatter KA, Dorostkar PC, Yang Y, Lee RJ, Van Hare GF, Keung E, Modin G, Scheinman MM. Electrophysiological effects of ibutilide in patients with accessory pathways. Circulation 2001;104:19331939.
- Sellers TD Jr, Campbell RW, Bashore TM, Gallagher JJ. Effects of procainamide and quinidine sulfate in the Wolff-Parkinson-White syndrome. Circulation 1977;55:1522.
- Wellens HJJ, Brugada P, Abdollah H. Effect of amiodarone in paroxysmal supraventricular tachycardia with or without Wolff-Parkinson-White syndrome. Am Heart J 1983;106:876880.
- Holt P, Crick JCP, Davies DW, Curry P. Intravenous amiodarone in the acute termination of supraventricular arrhythmias. Int J Cardiol 1985;8:6776.
- Levy S, Ricard P. Using the right drug: a treatment algorithm for regular supraventricular tachycardias. Eur Heart J 1997;18:2732.
- Fujimura O, Kuo C-S, Smith BA. Pre-excited RR intervals during atrial fibrillation in the Wolff-Parkinson-White syndrome: influence of the atrioventricular node refractory period. J Am Coll Cardiol 1991;18:17221726.
- Morady F, DiCarlo LA Jr, Baerman JM, De Buitleir M. Effect of propranolol on ventricular rate during atrial fibrillation in the Wolff-Parkinson-White syndrome. Pacing Clin Electrophysiol 1987;10:492496.
- Sellers TD Jr, Bashore TM, Gallagher JJ. Digitalis in the pre-excitation syndrome. Analysis during atrial fibrillation. Circulation 1977;56:260267.
- Ludmer PL, McGowan NE, Antman EM, Friedman PL. Efficacy of propafenone in Wolff-Parkinson-White syndrome: electrophysiologic findings and long-term follow-up. J Am Coll Cardiol 1987;9:13571363.
- Boahene KA, Klein GJ, Yee R, Sharma AD, Fujimura O. Termination of acute atrial fibrillation in the Wolff-Parkinson-White syndrome by procainamide and propafenone: importance of atrial fibrillatory cycle length. J Am Coll Cardiol 1990;16:14081414.
- Crijns HJGM, den Heijer P, van Wijk LM, Lie KI. Successful use of flecainide in atrial fibrillation with rapid ventricular rate in the Wolff-Parkinson-White syndrome. Am Heart J 1988;115:13171321.
- Boriani G, Biffi M, Frabetti L, Azzolini U, Sabbatani P, Bronzetti G, Capucci A, Magnani B. Ventricular fibrillation after intravenous amiodarone in WolffParkinson-White syndrome with atrial fibrillation. Am Heart J 1996;131:12141216.
- Schu ¨tzenberger W, Leisch F, Gmeiner R. Enhanced accessory pathway conduction following intravenous amiodarone in atrial fibrillation. A case report. Int J Cardiol 1987;16:9395.
- Tijunelis MA, Herbert ME. Myth: intravenous amiodarone is safe in patients with atrial fibrillation and Wolff-Parkinson-White syndrome in the emergency department. CJEM 2005;7:262265.
- Kappenberger LJ, Fromer MA, Steinbrunn W, Shenasa M. Efficacy of amiodarone in the Wolff-Parkinson-White syndrome with rapid ventricular response via accessory pathway during atrial fibrillation. Am J Cardiol 1984;54:330335.
- Simonian SM, Lotfipour S, Wall C, Langdorf MI. Challenging the superiority of amiodarone for rate control in Wolff-Parkinson-White and atrial fibrillation. Intern Emerg Med 2010;5:421426.
- Kim SS, Lal R, Ruffy R. Treatment of paroxysmal reentrant supraventricular tachycardia with flecainide acetate. Am J Cardiol 1986;58:8085.
- Bravo L, Atienza F, Eidelman G, Avila P, Pelliza M, Castellanos E, Loughlin G, Datino T, Torrecilla EG, Almendral J, Sanchez PL, Arenal A, Martınez-Alzamora N, Fernandez-Avile´s F. Safety and efficacy of cryoablation vs. radiofrequency ablation of septal accessory pathways: systematic review of the literature and meta-analyses. Europace 2017:20:13341342.
- Pappone C, Vicedomini G, Manguso F, Saviano M, Baldi M, Pappone A, Ciaccio C, Giannelli L, Ionescu B, Petretta A, Vitale R, Cuko A, Calovic Z, Fundaliotis A, Moscatiello M, Tavazzi L, Santinelli V. Wolff-Parkinson-White syndrome in the era of catheter ablation: insights from a registry study of 2169 patients. Circulation 2014;130:811819.
- Xue Y, Zhan X, Wu S, Wang H, Liu Y, Liao Z, Deng H, Duan X, Zeng S, Liang D, Elvan A, Fang X, Liao H, Ramdat Misier AR, Smit JJJ, Metzner A, Heeger C-H, Liu F, Wang F, Zhang Z, Kuck K-H, Yen Ho S, Ouyang F. Experimental, pathologic, and clinical findings of radiofrequency catheter ablation of para-Hisian region from the right ventricle in dogs and humans. Circ Arrhythm Electrophysiol 2017;10:e005207.
- Katritsis D, Giazitzoglou E, Korovesis S, Zambartas C. Comparison of the transseptal approach to the transaortic approach for ablation of left-sided accessory pathways in patients with Wolff-Parkinson-White syndrome. Am J Cardiol 2003;91:610613.
- Mauritson DR, Winniford MD, Walker W, Rude RE, Cary JR, Hillis L. Oral verapamil for paroxysmal supraventricular tachycardia: a long-term, double-blind randomized trial. Ann Intern Med 1982;96:409412.
- Sakurai M, Yasuda H, Kato N, Nomura A, Fujita M, Nishino T, Fujita K, Koike Y, Saito H. Acute and chronic effects of verapamil in patients with paroxysmal supraventricular tachycardia. Am Heart J 1983;105:619628.
- Vassiliadis I, Papoutsakis P, Kallikazaros I, Stefanadis C. Propafenone in the prevention of non-ventricular arrhythmias associated with the Wolff-ParkinsonWhite syndrome. Int J Cardiol 1990;27:6370.
- Cockrell JL, Scheinman MM, Titus C, Helmy I, Langberg JJ, Lee MA, Griffin JC. Safety and efficacy of oral flecainide therapy in patients with atrioventricular reentrant tachycardia. Ann Intern Med 1991;114:189194.
- Schu ¨tzenberger W, Leisch F, Gmeiner R. Enhanced accessory pathway conduction following intravenous amiodarone in atrial fibrillation. A case report. Int J Cardiol 1987;16:9395.
- Marazzato J, Fonte G, Marazzi R, Doni LA, Mitacchione G, Vilotta M, De Ponti R. Efficacy and safety of cryoablation of para-Hisian and mid-septal accessory pathways using a specific protocol: single-center experience in consecutive patients. J Interv Card Electrophysiol 2019;55:4754.
- Manolis AS, Wang PJ, Estes NA III. Radiofrequency ablation of left-sided accessory pathways: transaortic versus transseptal approach. Am Heart J 1994;128:896902.
- Obeyesekere MN, Leong-Sit P, Massel D, Manlucu J, Modi S, Krahn AD, Skanes AC, Yee R, Gula LJ, Klein GJ. Risk of arrhythmia and sudden death in patients with asymptomatic preexcitation. A meta-analysis. Circulation 2012;125:23082315.
- Santinelli V, Radinovic A, Manguso F, Vicedomini G, Gulletta S, Paglino G, Mazzone P, Ciconte G, Sacchi S, Sala S, Pappone C. The natural history of asymptomatic ventricular pre-excitation: a long-term prospective follow-up study of 184 asymptomatic children. J Am Coll Cardiol 2009;53:275280.
- Klein GJ, Bashore TM, Sellers TD, Pritchett ELC, Smith WM, Gallagher JJ. Ventricular fibrillation in the Wolff-Parkinson-White syndrome. N Engl J Med 1979;301:10801085.
- Kubu s P, V ıt P, Gebauer RA, Materna O, Janousek J. Electrophysiologic profile and results of invasive risk stratification in asymptomatic children and adolescents with the WolffParkinsonWhite electrocardiographic pattern. Circ Arrhythm Electrophysiol 2014;7:218223.
- Pappone C, Santinelli V, Manguso F, Augello G, Santinelli O, Vicedomini G, Gulletta S, Mazzone P, Tortoriello V, Pappone A, Dicandia C, Rosanio S. A randomized study of prophylactic catheter ablation in asymptomatic patients with the Wolff-Parkinson-White Syndrome. N Engl J Med 2003;349:18031811. 454. Santinelli V, Radinovic A, Manguso F, Vicedomini G, Ciconte G, Gulletta S, Paglino G, Sacchi S, Sala S, Ciaccio C, Pappone C. Asymptomatic ventricular preexcitation: a long-term prospective follow-up study of 293 adult patients. Circ Arrhythm Electrophysiol 2009;2:102107.
- Montoya PT, Brugada P, Smeets J, Talajic M, Della Bella P, Lezaun R, Dool AVD, Wellens HJJ, De Luna AB, Oter R, Breithardt G, Borggrefe M, Klein H, Kuck KH, Kunze K, Coumel P, Leclercq JF, Chouty F, Frank R, Fontanine G. Ventricular fibrillation in the Wolff-Parkinson-White syndrome. Eur Heart J 1991;12:144150.
- Pappone C, Vicedomini G, Manguso F, Baldi M, Pappone A, Petretta A, Vitale R, Saviano M, Ciaccio C, Giannelli L, Calovic Z, Tavazzi L, Santinelli V. Risk of malignant arrhythmias in initially symptomatic patients with Wolff-ParkinsonWhite syndrome: results of a prospective long-term electrophysiological follow-up study. Circulation 2012;125:661668.
- Leitch JW, Klein GJ, Yee R, Murdock C. Prognostic value of electrophysiology testing in asymptomatic patients with Wolff-Parkinson-White pattern. Circulation 1990;82:17181723.
- Rinne C, Klein GJ, Sharma AD, Yee R, Milstein S, Rattes MF. Relation between clinical presentation and induced arrhythmias in the Wolff-Parkinson-White syndrome. Am J Cardiol 1987;60:576579.
- Sharma AD, Yee R, Guiraudon G, Klein GJ. Sensitivity and specificity of invasive and noninvasive testing for risk of sudden death in Wolff-Parkinson-White syndrome. J Am Coll Cardiol 1987;10:373381.
- Moore JP, Kannankeril PJ, Fish FA. Isoproterenol administration during general anesthesia for the evaluation of children with ventricular preexcitation. Circ Arrhythm Electrophysiol 2011;4:7378.
- Daubert C, Ollitrault J, Descaves C, Mabo P, Ritter P, Gouffault J. Failure of the exercise test to predict the anterograde refractory period of the accessory pathway in Wolff Parkinson White syndrome. Pacing Clin Electrophysiol 1988;11:11301138.
- Wackel P, Irving C, Webber S, Beerman L, Arora G. Risk stratification in WolffParkinson-White syndrome: the correlation between noninvasive and invasive testing in pediatric patients. Pacing Clin Electrophysiol 2012;35:14511457.
- Gaita F, Giustetto C, Riccardi R, Mangiardi L, Brusca A. Stress and pharmacologic tests as methods to identify patients with Wolff-Parkinson-White syndrome at risk of sudden death. Am J Cardiol 1989;64:487490.
- PediatricCongenital Electrophysiology S, Heart Rhythm S, American College of Cardiology F, American Heart A, American Academy of P, Canadian Heart Rhythm SCohen MI, Triedman JK, Cannon BC, Davis AM, Drago F, Janousek J, Klein GJ, Law IH, Morady FJ, Paul T, Perry JC, Sanatani S, Tanel RE. PACES/HRS expert consensus statement on the management of the asymptomatic young patient with a Wolff-Parkinson-White (WPW, ventricular preexcitation) electrocardiographic pattern: developed in partnership between the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the governing bodies of PACES, HRS, the American College of Cardiology Foundation (ACCF), the American Heart Association (AHA), the American Academy of Pediatrics (AAP), and the Canadian Heart Rhythm Society (CHRS). Heart Rhythm 2012;9:10061024.
- Jastrzebski M, Kukla P, Pitak M, Rudzinski A, Baranchuk A, Czarnecka D. Intermittent preexcitation indicates “a low-risk” accessory pathway: time for a paradigm shift? Ann Noninvasive Electrocardiol 2017;22:e12464.
- Kiger ME, McCanta AC, Tong S, Schaffer M, Runciman M, Collins KK. Intermittent versus persistent Wolff-Parkinson-White syndrome in children: electrophysiologic properties and clinical outcomes. Pacing Clin Electrophysiol 2016;39:1420.
- Cohen M. Intermittent preexcitation: should we rethink the current guidelines? Pacing Clin Electrophysiol 2016;39:911.
- Mah DY, Sherwin ED, Alexander ME, Cecchin F, Abrams DJ, Walsh EP, Triedman JK. The electrophysiological characteristics of accessory pathways in pediatric patients with intermittent preexcitation. Pacing Clin Electrophysiol 2013;36:11171122.
- Spar DS, Silver ES, Hordof AJ, Liberman L. Relation of the utility of exercise testing for risk assessment in pediatric patients with ventricular preexcitation to pathway location. Am J Cardiol 2012;109:10111014.
- Beckman KJ, Gallastegui JL, Bauman JL, Hariman RJ. The predictive value of electrophysiologic studies in untreated patients with Wolff-Parkinson-White syndrome. J Am Coll Cardiol 1990;15:640647.
- Bunch TJ, May HT, Bair TL, Anderson JL, Crandall BG, Cutler MJ, Jacobs V, Mallender C, Muhlestein JB, Osborn JS, Weiss JP, Day JD. Long-term natural history of adult WolffParkinsonWhite syndrome patients treated with and without catheter ablation. Circ Arrhythm Electrophysiol 2015;8:14651471.
- Cain N, Irving C, Webber S, Beerman L, Arora G. Natural history of WolffParkinson-White syndrome diagnosed in childhood. Am J Cardiol 2013;112:961965.
- Brugada J, Puigfel M, Mont L, Garcia-Bolao I, Figueiredo M, Matas M, NavarroLopez F. Radiofrequency ablation of anteroseptal, para-Hisian, and mid-septal accessory pathways using a simplified femoral approach. Pacing Clin Electrophysiol 1998;21:735741.
- Calkins H, Yong P, Miller JM, Olshansky B, Carlson M, Saul JP, Huang SK, Liem LB, Klein LS, Moser SA, Bloch DA, Gillette P, Prystowsky E. Catheter ablation of accessory pathways, atrioventricular nodal reentrant tachycardia, and the atrioventricular junction: final results of a prospective, multicenter clinical trial. The Atakr Multicenter Investigators Group. Circulation 1999;99: 262270.
- Schaffer MS, Silka MJ, Ross BA, Kugler JD. Inadvertent atrioventricular block during radiofrequency catheter ablation. Results of the Pediatric Radiofrequency Ablation Registry. Pediatric Electrophysiology Society. Circulation 1996;94:32143220.
- Bravo L, Atienza F, Eidelman G, Avila P, Pelliza M, Castellanos E, Loughlin G, Datino T, Torrecilla EG, Almendral J, Sanchez PL, Arenal A, Martınez-Alzamora N, Fernandez-Avile´s F. Safety and efficacy of cryoablation vs. radiofrequency ablation of septal accessory pathways: systematic review of the literature and meta-analyses. Europace 2017;20:13341342.
- Al-Khatib SM, Arshad A, Balk EM, Das SR, Hsu JC, Joglar JA, Page RL. Risk stratification for arrhythmic events in patients with asymptomatic pre-excitation: a systematic review for the 2015 ACC/AHA/HRS guideline for the management of adult patients with supraventricular tachycardia: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol 2016;67:16241638.
- Dai C, Guo B, Li W, Xiao Y, Jin M, Han L, Dong J. The effect of ventricular preexcitation on ventricular wall motion and left ventricular systolic function. Europace 2018;20:11751181.
- Kohli U, Pumphrey KL, Ahmed A, Das S. Pre-excitation induced ventricular dysfunction and successful berlin heart explantation after accessory pathway ablation. J Electrocardiol 2018;51:10671070.
- Nagai T, Hamabe A, Arakawa J, Tabata H, Nishioka T. The impact of left ventricular deformation and dyssynchrony on improvement of left ventricular ejection fraction following radiofrequency catheter ablation in Wolff-ParkinsonWhite syndrome: a comprehensive study by speckle tracking echocardiography. Echocardiography 2017;34:16101616.
- Kwon EN, Carter KA, Kanter RJ. Radiofrequency catheter ablation for dyssynchrony-induced dilated cardiomyopathy in an infant. Congenit Heart Dis 2014;9:E179E184.
- Telishevska M, Hebe J, Paul T, Nurnberg JH, Krause U, Gebauer R, Gass M, Balmer C, Berger F, Molatta S, Emmel M, Lawrenz W, Kriebel T, Hessling G. Catheter ablation in ASymptomatic PEDiatric patients with ventricular preexcitation: results from the multicenter “CASPED” study. Clin Res Cardiol 2018;108:683690.
- Marelli AJ, Ionescu-Ittu R, Mackie AS, Guo L, Dendukuri N, Kaouache M. Lifetime prevalence of congenital heart disease in the general population from 2000 to 2010. Circulation 2014;130:749756.
- Hernandez-Madrid A, Paul T, Abrams D, Aziz PF, Blom NA, Chen J, Chessa M, Combes N, Dagres N, Diller G, Ernst S, Giamberti A, Hebe J, Janousek J, Kriebel T, Moltedo J, Moreno J, Peinado R, Pison L, Rosenthal E, Skinner JR, Zeppenfeld K; ESC Scientific Document Group. Arrhythmias in congenital heart disease: a position paper of the European Heart Rhythm Association (EHRA), Association for European Paediatric and Congenital Cardiology (AEPC), and the European Society of Cardiology (ESC) Working Group on Grown-up Congenital Heart Disease, endorsed by HRS, PACES, APHRS, and SOLAECE. Europace 2018;20:17191753.
- Moons P, Bovijn L, Budts W, Belmans A, Gewillig M. Temporal trends in survival to adulthood among patients born with congenital heart disease from 1970 to 1992 in Belgium. Circulation 2010;122:22642272.
- Avila P, Mercier LA, Dore A, Marcotte F, Mongeon FP, Ibrahim R, Asgar A, Miro J, Andelfinger G, Mondesert B, de Guise P, Poirier N, Khairy P. Adult congenital heart disease: a growing epidemic. Can J Cardiol 2014;30:S410S419.
- Janson CM, Shah MJ. Supraventricular tachycardia in adult congenital heart disease: mechanisms, diagnosis, and clinical aspects. Card Electrophysiol Clin 2017;9:189211.
- Verheugt CL, Uiterwaal CS, van der Velde ET, Meijboom FJ, Pieper PG, Sieswerda GT, Plokker HW, Grobbee DE, Mulder BJ. The emerging burden of hospital admissions of adults with congenital heart disease. Heart 2010;96:872878.
- Gallego P, Gonzalez AE, Sanchez-Recalde A, Peinado R, Polo L, Gomez-Rubin C, Lopez-Sendon JL, Oliver JM. Incidence and predictors of sudden cardiac arrest in adults with congenital heart defects repaired before adult life. Am J Cardiol 2012;110:109117.
- Koyak Z, Harris L, de Groot JR, Silversides CK, Oechslin EN, Bouma BJ, Budts W, Zwinderman AH, Van Gelder IC, Mulder BJ. Sudden cardiac death in adult congenital heart disease. Circulation 2012;126:19441954.
- Lin JH, Kean AC, Cordes TM. The risk of thromboembolic complications in Fontan patients with atrial flutter/fibrillation treated with electrical cardioversion. Pediatr Cardiol 2016;37:13511360.
- Ammash NM, Phillips SD, Hodge DO, Connolly HM, Grogan MA, Friedman PA, Warnes CA, Asirvatham SJ. Outcome of direct current cardioversion for atrial arrhythmias in adults with congenital heart disease. Int J Cardiol 2012;154:270274.
- Israel CW, Barold SS. Electrical storm in patients with an implanted defibrillator: a matter of definition. Ann Noninvasive Electrocardiol 2007;12:375382.
- Sherman L, Niemann J, Youngquist ST, Shah AP, Rosborough JP. Beta-blockade causes a reduction in the frequency spectrum of VF but improves resuscitation outcome: a potential limitation of quantitative waveform measures. Resuscitation 2012;83:511516.
- Khairy P, Clair M, Fernandes SM, Blume ED, Powell AJ, Newburger JW, Landzberg MJ, Mayer JE. Cardiovascular outcomes after the arterial switch operation for Dtransposition of the great arteries. Circulation 2013;127:331339.
- Coughtrie AL, Behr ER, Layton D, Marshall V, Camm AJ, Shakir SAW. Drugs and life-threatening ventricular arrhythmia risk: results from the DARE study cohort. BMJ Open 2017;7:e016627.
- Valentino MA, Panakos A, Ragupathi L, Williams J, Pavri BB. Flecainide toxicity: a case report and systematic review of its electrocardiographic patterns and management. Cardiovasc Toxicol 2017;17:260266.
- Thorne SA, Barnes I, Cullinan P, Somerville J. Amiodarone-associated thyroid dysfunction. Risk factors in adults with congenital heart disease. Circulation 1999;100:149154.
- Pujol C, Niesert A-C, Engelhardt A, Schoen P, Kusmenkov E, Pittrow D, Ewert P, Kaemmerer H. Usefulness of direct oral anticoagulants in adult congenital heart disease. Am J Cardiol 2016;117:450455.
- Wu J, Deisenhofer I, Ammar S, Fichtner S, Reents T, Zhu P, Jilek C, Kolb C, Hess J, Hessling G. Acute and long-term outcome after catheter ablation of supraventricular tachycardia in patients after the Mustard or Senning operation for D-transposition of the great arteries. Europace 2013;15:886891.
- Roten L, Lukac P, De Groot N, Cosedis Nielsen J, Szili-Torok T, Kjaerulf Jensen H, Zimmermann M, Delacre´taz E. Catheter ablation of arrhythmias in Ebstein’s anomaly: a multicenter study. J Cardiovasc Electrophysiol 2011;22:13911396.
- Deal BJ, Mavroudis C. Arrhythmia surgery for adults with congenital heart disease. Card Electrophysiol Clin 2017;9:329340.
- Shivapour JK, Sherwin ED, Alexander ME, Cecchin F, Mah DY, Triedman JK, Marx GR, del Nido PJ, Walsh EP. Utility of preoperative electrophysiologic studies in patients with Ebstein’s anomaly undergoing the Cone procedure. Heart Rhythm 2014;11:182186.
- Deal BJ, Mavroudis C, Backer CL, Buck SH, Johnsrude C. Comparison of anatomic isthmus block with the modified right atrial maze procedure for late atrial tachycardia in Fontan patients. Circulation 2002;106:575579.
- Koyak Z, Kroon B, de Groot JR, Wagenaar LJ, van Dijk AP, Mulder BA, Van Gelder IC, Post MC, Mulder BJM, Bouma BJ. Efficacy of antiarrhythmic drugs in adults with congenital heart disease and supraventricular tachycardias. Am J Cardiol 2013;112:14611467. 506. Combes N, Derval N, Hascoet S, Zhao A, Amet D, Le Bloa M, Maltret A, Heitz F, Thambo JB, Marijon E. Ablation of supraventricular arrhythmias in adult congenital heart disease: a contemporary review. Arch Cardiovasc Dis 2017;110:334345.
- Dallaglio PD, Anguera I, Jime´nez-Candil J, Peinado R, Garcıa-Seara J, Arcocha MF, Macıas R, Herreros B, Quesada A, Hernandez-Madrid A, Alvarez M, Di Marco A, Filgueiras D, Matıa R, Cequier A, Sabate´ X. Impact of previous cardiac surgery on long-term outcome of cavotricuspid isthmus-dependent atrial flutter ablation. Europace 2016;18:873880.
- Wasmer K, Ko¨be J, Dechering DG, Bittner A, Mo¨nnig G, Milberg P, Baumgartner H, Breithardt G, Eckardt L. Isthmus-dependent right atrial flutter as the leading cause of atrial tachycardias after surgical atrial septal defect repair. Int J Cardiol 2013;168:24472452.
- Nie J-G, Dong J-Z, Salim M, Li S-N, Wu X-Y, Chen Y-W, Bai R, Liu N, Du X, Ma C-S. Catheter ablation of atrial fibrillation in patients with atrial septal defect: long-term follow-up results. J Interv Card Electrophysiol 2015;42:4349.
- Chauvaud SM, Brancaccio G, Carpentier AF. Cardiac arrhythmia in patients undergoing surgical repair of Ebstein’s anomaly. Ann Thorac Surg 2001;71:15471552.
- Khairy P, Van Hare GF, Balaji S, Berul CI, Cecchin F, Cohen MI, Daniels CJ, Deal BJ, Dearani JA, Groot Nd, Dubin AM, Harris L, Janousek J, Kanter RJ, Karpawich PP, Perry JC, Seslar SP, Shah MJ, Silka MJ, Triedman JK, Walsh EP, Warnes CA. PACES/HRS Expert Consensus Statement on the Recognition and Management of Arrhythmias in Adult Congenital Heart Disease: Developed in partnership between the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the governing bodies of PACES, HRS, the American College of Cardiology (ACC), the American Heart Association (AHA), the European Heart Rhythm Association (EHRA), the Canadian Heart Rhythm Society (CHRS), and the International Society for Adult Congenital Heart Disease (ISACHD). Heart Rhythm 2014;11:e102e165.
- Khositseth A, Danielson GK, Dearani JA, Munger TM, Porter CJ. Supraventricular tachyarrhythmias in Ebstein anomaly: management and outcome. J Thorac Cardiovasc Surg 2004;128:826833.
- Shivapour JKL, Sherwin ED, Alexander ME, Cecchin F, Mah DY, Triedman JK, Marx GR, del Nido PJ, Walsh EP. Utility of preoperative electrophysiologic studies in patients with Ebstein’s anomaly undergoing the Cone procedure. Heart Rhythm 2014;11:182186.
- Correa R, Walsh EP, Alexander ME, Mah DY, Cecchin F, Abrams DJ, Triedman JK. Transbaffle mapping and ablation for atrial tachycardias after mustard, senning, or Fontan operations. J Am Heart Assoc 2013;2:e000325.
- Krause U, Backhoff D, Klehs S, Schneider HE, Paul T. Transbaffle catheter ablation of atrial re-entrant tachycardia within the pulmonary venous atrium in adult patients with congenital heart disease. Europace 2016;18:10551060.
- Houck CA, Teuwen CP, Bogers AJ, de Groot NM. Atrial tachyarrhythmias after atrial switch operation for transposition of the great arteries: treating old surgery with new catheters. Heart Rhythm 2016;13:17311738.
- Wu M-H, Lu C-W, Chen H-C, Chiu S-N, Kao F-Y, Huang S-K. Arrhythmic burdens in patients with tetralogy of Fallot: a national database study. Heart Rhythm 2015;12:604609.
- de Groot NMS, Lukac P, Schalij MJ, Makowski K, Szili-Torok T, Jordaens L, Nielsen JC, Jensen HK, Gerdes JC, Delacretaz E. Long-term outcome of ablative therapy of post-operative atrial tachyarrhythmias in patients with tetralogy of Fallot: a European multi-centre study. Europace 2012;14:522527.
- Weipert J, Noebauer C, Schreiber C, Kostolny M, Zrenner B, Wacker A, Hess J, Lange R. Occurrence and management of atrial arrhythmia after long-term Fontan circulation. J Thorac Cardiovasc Surg 2004;127:457464.
- Mavroudis C, Deal BJ. Fontan conversion: literature review and lessons learned over 20 years. World J Pediatr Congenit Heart Surg 2016;7:192198.
- Stewart RD, Pasquali SK, Jacobs JP, Benjamin DK, Jaggers J, Cheng J, Mavroudis C, Jacobs ML. Contemporary Fontan operation: association between early outcome and type of cavopulmonary connection. Ann Thorac Surg 2012;93:12541260; discussion 1261.
- Brugada J, Blom N, Sarquella-Brugada G, Blomstrom-Lundqvist C, Deanfield J, Janousek J, Abrams D, Bauersfeld U, Brugada R, Drago F, de Groot N, Happonen J-M, Hebe J, Yen Ho S, Marijon E, Paul T, Pfammatter J-P, Rosenthal E. Pharmacological and non-pharmacological therapy for arrhythmias in the pediatric population: EHRA and AEPC-Arrhythmia Working Group joint consensus statement. Europace 2013;15:13371382.
- Philip Saul J, Kanter RJ, Writing C, Abrams D, Asirvatham S, Bar-Cohen Y, Blaufox AD, Cannon B, Clark J, Dick M, Freter A, Kertesz NJ, Kirsh JA, Kugler J, LaPage M, McGowan FX, Miyake CY, Nathan A, Papagiannis J, Paul T, Pflaumer A, Skanes AC, Stevenson WG, Von Bergen N, Zimmerman F. PACES/HRS expert consensus statement on the use of catheter ablation in children and patients with congenital heart disease: developed in partnership with the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the governing bodies of PACES, HRS, the American Academy of Pediatrics (AAP), the American Heart Association (AHA), and the Association for European Pediatric and Congenital Cardiology (AEPC). Heart Rhythm 2016;13:e251e289.
- Perry JC, Garson A Jr. Supraventricular tachycardia due to Wolff-ParkinsonWhite syndrome in children: early disappearance and late recurrence. J Am Coll Cardiol 1990;16:12151220.
- Bensler JM, Frank CM, Razavi M, Rasekh A, Saeed M, Haas PC, Nazeri A, Massumi A. Tachycardia-mediated cardiomyopathy and the permanent form of junctional reciprocating tachycardia. Tex Heart Inst J 2010;37:695698.
- Ellis ER, Josephson ME. What about tachycardia-induced cardiomyopathy? Arrhythm Electrophysiol Rev 2013;2:8290. 527. Richardson C, Silver ES. Management of supraventricular tachycardia in infants. Paediatr Drugs 2017;19:539551.
- Lewis J, Arora G, Tudorascu DL, Hickey RW, Saladino RA, Manole MD. Acute management of refractory and unstable pediatric supraventricular tachycardia. J Pediatr 2017;181:177182.e2.
- Saul JP, Hulse JE, Papagiannis J, Van Praagh R, Walsh EP. Late enlargement of radiofrequency lesions in infant lambs. Implications for ablation procedures in small children. Circulation 1994;90:492499.
- Femenıa F, Sarquella-Brugada G, Brugada J. Single-catheter radiofrequency ablation of a permanent junctional reciprocating tachycardia in a premature neonate. Cardiol Young 2012;22:606609.
- Hinkle KA, Peyvandi S, Stiver C, Killen SAS, Weng HY, Etheridge SP, Puchalski MD. Postnatal outcomes of fetal supraventricular tachycardia: a multicenter study. Pediatr Cardiol 2017;38:13171323.
- Fouron J-C, Fournier A, Proulx F, Lamarche J, Bigras JL, Boutin C, Brassard M, Gamache S. Management of fetal tachyarrhythmia based on superior vena cava/ aorta Doppler flow recordings. Heart 2003;89:12111216.
- Jaeggi ET, Carvalho JS, De Groot E, Api O, Clur S-AB, Rammeloo L, McCrindle BW, Ryan G, Manlhiot C, Blom NA. Comparison of transplacental treatment of fetal supraventricular tachyarrhythmias with digoxin, flecainide, and sotalol: results of a nonrandomized multicenter study. Circulation 2011;124:17471754.
- Price JF, Kertesz NJ, Snyder CS, Friedman RA, Fenrich AL. Flecainide and sotalol: a new combination therapy for refractory supraventricular tachycardia in children <1 year of age. J Am Coll Cardiol 2002;39:51720.
- Vaidya VR, Arora S, Patel N, Badheka AO, Patel N, Agnihotri K, Billimoria Z, Turakhia MP, Friedman PA, Madhavan M, Kapa S, Noseworthy PA, Cha Y-M, Gersh B, Asirvatham SJ, Deshmukh AJ. Burden of arrhythmia in pregnancy. Circulation 2017;135:619621.
- Opotowsky AR, Siddiqi OK, D’Souza B, Webb GD, Fernandes SM, Landzberg MJ. Maternal cardiovascular events during childbirth among women with congenital heart disease. Heart 2012;98:145151.
- Silversides CK, Harris L, Haberer K, Sermer M, Colman JM, Siu SC. Recurrence rates of arrhythmias during pregnancy in women with previous tachyarrhythmia and impact on fetal and neonatal outcomes. Am J Cardiol 2006;97: 12061212.
- Lee SH, Chen SA, Wu TJ, Chiang CE, Cheng CC, Tai CT, Chiou CW, Ueng KC, Chang MS. Effects of pregnancy on first onset and symptoms of paroxysmal supraventricular tachycardia. Am J Cardiol 1995;76:675678.
- Moore JS, Teefey P, Rao K, Berlowitz MS, Chae SH, Yankowitz J. Maternal arrhythmia: a case report and review of the literature. Obstet Gynecol Surv 2012;67:298312.
- Wang YC, Chen CH, Su HY, Yu MH. The impact of maternal cardioversion on fetal haemodynamics. Eur J Obstet Gynecol Reprod Biol 2006;126:268269. 541. Elkayam U, Goodwin TM. Adenosine therapy for supraventricular tachycardia during pregnancy. Am J Cardiol 1995;75:521523.
- Ghosh N, Luk A, Derzko C, Dorian P, Chow CM. The acute treatment of maternal supraventricular tachycardias during pregnancy: a review of the literature. J Obstet Gynaecol Can 2011;33:1723.
- Halpern DG, Weinberg CR, Pinnelas R, Mehta-Lee S, Economy KE, Valente AM. Use of medication for cardiovascular disease during pregnancy: JACC State-of-the-Art Review. J Am Coll Cardiol 2019;73:457476.
- Kockova R, Kocka V, Kiernan T, Fahy GJ. Ibutilide-induced cardioversion of atrial fibrillation during pregnancy. J Cardiovasc Electrophysiol 2007;18:545547.
- Burkart TA, Kron J, Miles WM, Conti JB, Gonzalez MD. Successful termination of atrial flutter by ibutilide during pregnancy. Pacing Clin Electrophysiol 2007;30:283286.
- Liu YL, Nwosu UC, Rice PJ. Relaxation of isolated human myometrial muscle by beta2-adrenergic receptors but not beta1-adrenergic receptors. Am J Obstet Gynecol 1998;179:895898.
- Tanaka K, Tanaka H, Kamiya C, Katsuragi S, Sawada M, Tsuritani M, Yoshida M, Iwanaga N, Yoshimatsu J, Ikeda T. Beta-blockers and fetal growth restriction in pregnant women with cardiovascular disease. Circ J 2016;80:22212226.
- Bateman BT, Heide-Jorgensen U, Einarsdottir K, Engeland A, Furu K, Gissler M, Hernandez-Diaz S, Kieler H, Lahesmaa-Korpinen AM, Mogun H, Norgaard M, Reutfors J, Selmer R, Huybrechts KF, Zoega H. Beta-blocker use in pregnancy and the risk for congenital malformations: an international cohort study. Ann Intern Med 2018;169:665673.
- Jaeggi ET, Carvalho JS, De Groot E, Api O, Clur SA, Rammeloo L, McCrindle BW, Ryan G, Manlhiot C, Blom NA. Comparison of transplacental treatment of fetal supraventricular tachyarrhythmias with digoxin, flecainide, and sotalol: results of a nonrandomized multicenter study. Circulation 2011;124:17471754.
- Driver K, Chisholm CA, Darby AE, Malhotra R, Dimarco JP, Ferguson JD. Catheter ablation of arrhythmia during pregnancy. J Cardiovasc Electrophysiol 2015;26:698702.
- Chen G, Sun G, Xu R, Chen X, Yang L, Bai Y, Yang S, Guo P, Zhang Y, Zhao C, Wang DW, Wang Y. Zero-fluoroscopy catheter ablation of severe drug-resistant arrhythmia guided by Ensite NavX system during pregnancy: two case reports and literature review. Medicine (Baltimore) 2016;95:e4487.
- Szumowski L, Szufladowicz E, Orczykowski M, Bodalski R, Derejko P, Przybylski A, Urbanek P, Kusmierczyk M, Kozluk E, Sacher F, Sanders P, Dangel J, Haissaguerre M, Walczak F. Ablation of severe drug-resistant tachyarrhythmia during pregnancy. J Cardiovasc Electrophysiol 2010;21:877882.
- Duan L, Ng A, Chen W, Spencer HT, Nguyen J, Shen AY, Lee MS. Beta-blocker exposure in pregnancy and risk of fetal cardiac anomalies. JAMA Intern Med 2017;177:885887.
- Duan L, Ng A, Chen W, Spencer HT, Lee MS. Beta-blocker subtypes and risk of low birth weight in newborns. J Clin Hypertens (Greenwich) 2018;20:16031609.
- Bergman JEH, Lutke LR, Gans ROB, Addor MC, Barisic I, Cavero-Carbonell C, Garne E, Gatt M, Klungsoyr K, Lelong N, Lynch C, Mokoroa O, Nelen V, Neville AJ, Pierini A, Randrianaivo H, Rissmann A, Tucker D, Wiesel A, Dolk H, Loane M, Bakker MK. Beta-blocker use in pregnancy and risk of specific congenital anomalies: a European case-malformed control study. Drug Saf 2018;41:415427.
- Razminia M, Willoughby MC, Demo H, Keshmiri H, Wang T, D’Silva OJ, Zheutlin TA, Jibawi H, Okhumale P, Kehoe RF. Fluoroless catheter ablation of cardiac arrhythmias: a 5-year experience. Pacing Clin Electrophysiol 2017;40:425433.
- Lishmanov A, Chockalingam P, Senthilkumar A, Chockalingam A. Tachycardiainduced cardiomyopathy: evaluation and therapeutic options. Congest Heart Fail 2010;16:122126.
- Nerheim P, Birger-Botkin S, Piracha L, Olshansky B. Heart failure and sudden death in patients with tachycardia-induced cardiomyopathy and recurrent tachycardia. Circulation 2004;110:247252. 559. Shinbane JS, Wood MA, Jensen DN, Ellenbogen KA, Fitzpatrick AP, Scheinman MM. Tachycardia-induced cardiomyopathy: a review of animal models and clinical studies. J Am Coll Cardiol 1997;29:709715.
- Ellis ER, Josephson ME. Heart failure and tachycardia-induced cardiomyopathy. Curr Heart Fail Rep 2013;10:296306.
- Gopinathannair R, Etheridge SP, Marchlinski FE, Spinale FG, Lakkireddy D, Olshansky B. Arrhythmia-induced cardiomyopathies: mechanisms, recognition, and management. J Am Coll Cardiol 2015;66:17141728.
- Callans DJ. Premature ventricular contraction-induced cardiomyopathy. Arrhythm Electrophysiol Rev 2017;6:153155.
- Clementy N, Casset-Senon D, Giraudeau C, Cosnay P. Tachycardiomyopathy secondary to nonreentrant atrioventricular nodal tachycardia: recovery after slow pathway ablation. Pacing Clin Electrophysiol 2007;30:925928.
- Gopinathannair R, Sullivan RM, Olshansky B. Tachycardia-mediated cardiomyopathy: recognition and management. Curr Heart Fail Rep 2009;6:257264.
- Mueller KAL, Heinzmann D, Klingel K, Fallier-Becker P, Kandolf R, Kilias A, Walker-Allgaier B, Borst O, Kumbrink J, Kirchner T, Langer H, Geisler T, Schreieck J, Gramlich M, Gawaz M, Seizer P. Histopathological and immunological characteristics of tachycardia-induced cardiomyopathy. J Am Coll Cardiol 2017;69:21602172.
- Cha Y-M, Lee GK, Klarich KW, Grogan M. Premature ventricular contractioninduced cardiomyopathy. A treatable condition. Circ Arrhythm Electrophysiol 2012;5:229236.
- Kotecha D, Flather MD, Altman DG, Holmes J, Rosano G, Wikstrand J, Packer M, Coats AJS, Manzano L, Bo¨hm M, van Veldhuisen DJ, Andersson B, Wedel H, von Lueder TG, Rigby AS, Hjalmarson A ˚, Kjekshus J, Cleland JGF. Heart rate and rhythm and the benefit of beta-blockers in patients with heart failure. J Am Coll Cardiol 2017;69:28852896.
- Sadron Blaye-Felice M, Hamon D, Sacher F, Pascale P, Rollin A, Duparc A, Mondoly P, Derval N, Denis A, Cardin C, Hocini M, Jaı¨s P, Schlaepfer J, Bongard V, Carrie´ D, Galinier M, Pruvot E, Lellouche N, Haı¨ssaguerre M, Maury P. Premature ventricular contraction-induced cardiomyopathy: related clinical and electrophysiologic parameters. Heart Rhythm 2016;13:103110.
- Sohinki D, Ho J, Srinivasan N, Collins LJ, Obel OA. Outcomes after atrioventricular node ablation and biventricular pacing in patients with refractory atrial fibrillation and heart failure: a comparison between non-ischaemic and ischaemic cardiomyopathy. Europace 2014;16:880886.
- Stavrakis S, Garabelli P, Reynolds DW. Cardiac resynchronization therapy after atrioventricular junction ablation for symptomatic atrial fibrillation: a meta-analysis. Europace 2012;14:14901497.
- Brignole M, Botto G, Mont L, Iacopino S, De Marchi G, Oddone D, Luzi M, Tolosana JM, Navazio A, Menozzi C. Cardiac resynchronization therapy in patients undergoing atrioventricular junction ablation for permanent atrial fibrillation: a randomized trial. Eur Heart J 2011;32:24202429.
- Huang W, Su L, Wu S, Xu L, Xiao F, Zhou X, Ellenbogen KA. Benefits of permanent His bundle pacing combined with atrioventricular node ablation in atrial fibrillation patients with heart failure with both preserved and reduced left ventricular ejection fraction. J Am Heart Assoc 2017;6:e005309.
- Pelliccia A, Fagard R, Bjørnstad HH, Anastassakis A, Arbustini E, Assanelli D, Biffi A, Borjesson M, Carre` F, Corrado D, Delise P, Dorwarth U, Hirth A, Heidbuchel H, Hoffmann E, Mellwig KP, Panhuyzen-Goedkoop N, Pisani A, Solberg EE, van-Buuren F, Vanhees L, Blomstrom-Lundqvist C, Deligiannis A, Dugmore D, Glikson M, Hoff PI, Hoffmann A, Hoffmann E, Horstkotte D, Nordrehaug JE, Oudhof J, McKenna WJ, Penco M, Priori S, Reybrouck T, Senden J, Spataro A, Thiene G; Study Group of Sports Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology; Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Recommendations for competitive sports participation in athletes with cardiovascular disease: a consensus document from the Study Group of Sports Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Eur Heart J 2005;26:14221445.
- Heidbu¨chel H, Panhuyzen-Goedkoop N, Corrado D, Hoffmann E, Biffi A, Delise P, Blomstrom-Lundqvist C, Vanhees L, Hoff PI, Dorwarth U, Pelliccia A; Study Group on Sports Cardiology of the European Association for Cardiovascular Prevention and Rehabilitation. Recommendations for participation in leisure-time physical activity and competitive sports in patients with arrhythmias and potentially arrhythmogenic conditions Part I: supraventricular arrhythmias and pacemakers. Eur J Cardiovasc Prev Rehabil 2006;13:475484.
- Rao AL, Salerno JC, Asif IM, Drezner JA. Evaluation and management of WolffParkinson-White in athletes. Sports health: a multidisciplinary approach 2014;6:326332.
- Abdulla J, Nielsen JR. Is the risk of atrial fibrillation higher in athletes than in the general population? A systematic review and meta-analysis. Europace 2009;11:11561159.
- Heidbu¨chel H, Panhuyzen-Goedkoop N, Corrado D, Hoffmann E, Biffi A, Delise P, Blomstrom-Lundqvist C, Vanhees L, Ivarhoff P, Dorwarth U, Pelliccia A; Study Group on Sports Cardiology of the European Association for Cardiovascular Prevention and Rehabilitation. Recommendations for participation in leisure-time physical activity and competitive sports in patients with arrhythmias and potentially arrhythmogenic conditions Part I: supraventricular arrhythmias and pacemakers. Eur J Cardiovasc Prev Rehabil 2006;13:475484.
- Heidbu¨chel H, Corrado D, Biffi A, Hoffmann E, Panhuyzen-Goedkoop N, Hoogsteen J, Delise P, Hoff PI, Pelliccia A; Study Group on Sports Cardiology of the European Association for Cardiovascular Prevention and Rehabilitation. Recommendations for participation in leisure-time physical activity and competitive sports of patients with arrhythmias and potentially arrhythmogenic conditions. Part II: ventricular arrhythmias, channelopathies and implantable defibrillators. Eur J Cardiovasc Prev Rehabil 2006;13:676686.
- Katritsis D, Anderson A, Webb-Peploe MM. Regulations concerning individual risk and public safety. ESC Textbook of Cardiology 2018. 580. European Working Group on Driving and Cardiovascular Disease. New standards for driving and cardiovascular diseases. Report of the Expert Group on Driving and Cardiovascular Disease. https://ec.europa.eu/transport/road_safety/ sites/roadsafety/files/pdf/behavior/driving_and_cardiovascular_disease_final.pdf (date accessed May 2019).
- Nakagawa H, Natale A. Catheter ablation of complex tachyarrhythmias using remote magnetic catheter navigation system. J Cardiovasc Electrophysiol 2016;27:S3S4.
- Hilbert S, Sommer P, Gutberlet M, Gaspar T, Foldyna B, Piorkowski C, Weiss S, Lloyd T, Schnackenburg B, Krueger S, Fleiter C, Paetsch I, Jahnke C, Hindricks G, Grothoff M. Real-time magnetic resonance-guided ablation of typical right atrial flutter using a combination of active catheter tracking and passive catheter visualization in man: initial results from a consecutive patient series. Europace 2016;18:572577.
- Perlman O, Katz A, Amit G, Zigel Y. Supraventricular tachycardia classification in the 12-lead ECG using atrial waves detection and a clinically based tree scheme. IEEE J Biomed Health Inform 2016;20:15131520.
- Katritsis G, Luther V, Kanagaratnam P, Linton NW. Arrhythmia mechanisms revealed by ripple mapping. Arrhythm Electrophysiol Rev 2018;7:261264.
- Luther V, Cortez-Dias N, Carpinteiro L, de Sousa J, Balasubramaniam R, Agarwal S, Farwell D, Sopher M, Babu G, Till R, Jones N, Tan S, Chow A, Lowe M, Lane J, Pappachan N, Linton N, Kanagaratnam P. Ripple mapping: initial multicenter experience of an intuitive approach to overcoming the limitations of 3D activation mapping. J Cardiovasc Electrophysiol 2017;28:12851294.
- Latcu DG, Bun SS, Viera F, Delassi T, El Jamili M, Al Amoura A, Saoudi N. Selection of critical isthmus in scar-related atrial tachycardia using a new automated ultrahigh resolution mapping system. Circ Arrhythm Electrophysiol 2017;10:e004510.
- Walsh KA, Galvin J, Keaney J, Keelan E, Szeplaki G. First experience with zero-fluoroscopic ablation for supraventricular tachycardias using a novel impedance and magnetic-field-based mapping system. Clin Res Cardiol 2018;107:578585.
- Luther V, Linton NW, Koa-Wing M, Lim PB, Jamil-Copley S, Qureshi N, Ng FS, Hayat S, Whinnett Z, Davies DW, Peters NS, Kanagaratnam P. A prospective study of ripple mapping in atrial tachycardias: a novel approach to interpreting activation in low-voltage areas. Circ Arrhythm Electrophysiol 2016;9:e003582.
- Anter E, McElderry TH, Contreras-Valdes FM, Li J, Tung P, Leshem E, Haffajee CI, Nakagawa H, Josephson ME. Evaluation of a novel high-resolution mappin technology for ablation of recurrent scar-related atrial tachycardias. Heart Rhythm 2016;13:20482055.
- Gollob MH, Green MS, Tang AS-L, Gollob T, Karibe A, Hassan A-S, Ahmad F, Lozado R, Shah G, Fananapazir L, Bachinski LL, Tapscott T, Gonzales O, Begley D, Mohiddin S, Roberts R. Identification of a gene responsible for familial WolffParkinsonWhite syndrome. N Engl J Med 2001;344:18231831.
- Wolf CM, Arad M, Ahmad F, Sanbe A, Bernstein SA, Toka O, Konno T, Morley G, Robbins J, Seidman JG, Seidman CE, Berul CI. Reversibility of PRKAG2 glycogen-storage cardiomyopathy and electrophysiological manifestations. Circulation 2008;117:144154.
- Tan HL, van der Wal AC, Campian ME, Kruyswijk HH, ten Hove Jansen B, van Doorn D-J, Oskam HJ, Becker AE, Wilde AAM. Nodoventricular accessory pathways in PRKAG2-dependent familial preexcitation syndrome reveal a disorder in cardiac development. Circ Arrhythm Electrophysiol 2008;1:276281.
- Lalani SR, Thakuria JV, Cox GF, Wang X, Bi W, Bray MS, Shaw C, Cheung SW, Chinault AC, Boggs BA, Ou Z, Brundage EK, Lupski JR, Gentile J, Waisbren S, Pursley A, Ma L, Khajavi M, Zapata G, Friedman R, Kim JJ, Towbin JA, Stankiewicz P, Schnittger S, Hansmann I, Ai T, Sood S, Wehrens XH, Martin JF, Belmont JW, Potocki L. 20p12.3 microdeletion predisposes to WolffParkinsonWhite syndrome with variable neurocognitive deficits. J Med Genet 2009;46:168175.
- Sidhu JS, Rajawat YS, Rami TG, Gollob MH, Wang Z, Yuan R, Marian AJ, DeMayo FJ, Weilbacher D, Taffet GE, Davies JK, Carling D, Khoury DS, Roberts R. Transgenic mouse model of ventricular preexcitation and atrioventricular reentrant tachycardia induced by an AMP-activated protein kinase loss-offunction mutation responsible for Wolff-Parkinson-White syndrome. Circulation 2005;111:2129.
- Hasdemir C, Payzin S, Kocabas U, Sahin H, Yildirim N, Alp A, Aydin M, Pfeiffer R, Burashnikov E, Wu Y, Antzelevitch C. High prevalence of concealed Brugada syndrome in patients with atrioventricular nodal reentrant tachycardia. Heart Rhythm 2015;12:15841594.
- Weyhrauch DL, Ye D, Boczek NJ, Tester DJ, Gavrilova RH, Patterson MC, Wieben ED, Ackerman MJ. Whole exome sequencing and heterologous cellular electrophysiology studies elucidate a novel loss-of-function mutation in the CACNA1A-encoded neuronal P/Q-type calcium channel in a child with congenital hypotonia and developmental delay. Pediatr Neurol 2016;55: 4651.
- Baruscotti M, Bianco E, Bucchi A, DiFrancesco D. Current understanding of the pathophysiological mechanisms responsible for inappropriate sinus tachycardia: role of the If “funny” current. J Interv Card Electrophysiol 2016;46:1928.
- Josephson ME. Electrophysiology at a crossroads. Heart Rhythm 2007;4: 658661.








