Switching patients with uncontrolled hypertension on amlodipine 10mg to single-pill combinations of telmisartan and amlodipine: results of the TEAMSTA-10 study
TÓM TẮT
Steen Neldam, Colin Edwards, Russell Jones.
Current Medical Research & Opinion Vol. 27, No. 11, 2011, 2145–2153
Biên dịch: ThS. BS. Ngô Thị Kim Ánh
Bệnh viện Tim Tâm Đức
Mục tiêu
Đánh giá hiệu quả và an toàn khi điều trị thuốc viên phối hợp ức chế thụ thể angiotensin II telmisartan 40mg hoặc 80mg (T40 hoặc T80) và thuốc ức chế kênh canxi amlodipine 10mg (A10) so với đơn trị liệu A10 trong dân số bệnh nhân chưa kiểm soát được huyết áp với A10
Thiết kế và phương pháp nghiên cứu:
Nghiên cứu ngẫu nhiên, mù đôi, kéo dài 8 tuần, đánh giá hiệu quả và tính an toàn khi điều trị viên phối hợp T40/A10 hoặc T80/A10 so với nhóm chỉ dùng A10 trên 947 bệnh nhân chưa kiểm soát được huyết áp (huyết áp tâm trương (HATTr) ≥ 90 mmHg) sau 6 tuần điều trị với A10.
Các kết quả chính được đo lường
Tiêu chí chính là sự thay đổi huyết áp tâm trương đo tư thế ngồi tại phòng khám sau 8 tuần điều trị. Tiêu chí hiệu quả phụ bao gồm sự thay đổi huyết áp tâm thu đo tư thế ngồi tại phòng khám, tỷ lệ bênh nhân có đáp ứng HATT/HATTr (< 140/90 mmHg hoặc giảm ≥ 10/15 mmHg) và tỷ lệ bệnh nhân đạt huyết áp mục tiêu (< 140/90 mmHg) sau 8 tuần điều trị. Các tác dụng không mong muốn được ghi nhận trong suốt nghiên cứu.
Kết quả
Trong nhóm bệnh chưa đạt huyết áp mục tiêu với A10, khi dùng viên phối hợp T40/A10 và T80/A10 làm giảm HATT/HATTr rất có ý nghĩa so với nhóm dùng A10 đơn thuần (-3,7/-2,8 mmHg; -3,9/-2,8 mmHg) với P<0,0001, tỷ lệ đạt HATT/HATTr mục tiêu ở nhóm dùng viên phối hợp cao hơn hẳn nhóm dùng A10 (58,8/63,7% và 60,3/66,5% so với 50,2/51,1%). Tần suất đáp ứng HATT/HATTr tốt hơn trong nhóm điều trị viên phối hợp T40–80/A10 (64,7/66,0% và 65,8/68,7% so với 54,1/53,4%). T40–80/A10 dung nạp tốt. Tỷ lệ phù ngoại vi thấp (6,7–8,5%) và không khác biệt giữa 2 nhóm nghiên cứu. Tuy nhiên, bệnh nhân trong nghiên cứu này đã được tầm soát trước đó về khả năng dung nạp A10.
Kết luận
Đối với bệnh nhân chưa đạt huyết áp mục tiêu với A10, chuyển sang dùng T40/A10 hoặc T80/A10 làm giảm HATT/HATTr tốt hơn, tỷ lệ đáp ứng huyết áp và đạt huyết áp mục tiêu cao hơn.
GIỚI THIỆU
Tăng huyết áp (THA) đã được chứng minh là một yếu tố nguy cơ bệnh tim mạch và mạch máu não. Nhiều chứng cứ thuyết phục cho thấy điều trị THA làm giảm rõ rệt nguy cơ biến cố mạch máu. Hơn nữa, mối liên hệ giữa huyết áp và nguy cơ tim mạch vẫn tồn tại ngay cả khi huyết áp về mức bình thường. Trong một phân tích gộp của 61 nghiên cứu tiền cứu thực hiện trên khoảng 1 triệu bệnh nhân, cho thấy mối liên hệ chặt chẽ giữa huyết áp và tỷ lệ tử vong tim mạch cũng như tử vong chung ở mọi mức độ huyết áp <115/75 mmHg1. Phân tích này cũng đưa ra kết luận nếu giảm 20 mmHg HATT và 10 mmHg HATTr sẽ giảm 2 lần nguy cơ tử vong do đột qụy, bệnh cơ tim thiếu máu cục bộ và các nguyên nhân mạch máu khác. Do đó các hướng dẫn điều trị THA gần đây khuyến cáo giảm huyết áp xuống <140/90 mmHg2,3.
Hơn nữa, nhiều nghiên cứu cho thấy phần lớn bệnh nhân không kiểm soát được huyết áp với đơn trị liệu4,5 và cần phối hợp ít nhất 2 thuốc để đạt huyết áp mục tiêu2,3.
Một kết hợp thuốc được khuyến cáo hiện nay là phối hợp nhóm thuốc ức chế hệ thống rennin-angiotensin (renin–angiotensin system: RAS), như thuốc ức chế men chuyển (angiotensin-converting enzyme – ACE inhibitor) hoặc thuốc ức chế thụ thể angitensin II (angiotensin II receptor blocker – ARB) phối hợp với lợi tiểu hoặc ức chế kênh canxi (calcium channel blocker – CCB)6. Nhiều nghiên cứu đánh giá hiệu quả của điều trị phối hợp ARB và CCB amlodipine cho thấy điều trị phối hợp tốt hơn so với dùng đơn thuần 1 trong 2 thuốc7-14. Tác động trên tim mạch của điều trị phối hợp thuốc ức chế RAS và CCB đã được đánh giá trong 2 nghiên cứu lớn gần đây là nghiên cứu ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial)15 và ACCOMPLISH (Avoiding Cardiovascular events through Combination therapy in Patients Living with Systolic Hypertension)16,17. Các nghiên cứu này cho thấy rằng với cùng mức giảm huyết áp, nhóm phối hợp thuốc ức chế RAS và amlodipine làm giảm đáng kể tử vong tim mạch so với nhóm điều trị phối hợp ức chế RAS và thuốc chẹn bêta hoặc phối hợp ức chế RAS với lợi tiểu.
Thuốc ức chế thụ thể Telmisartan có đặc tính dược học độc đáo13,18-20 và được chứng minh có tác dụng hạ áp tốt hơn valsartan21 và losartan22. Trong 1 nghiên cứu được công bố gần đây thực hiện trên bệnh nhân tăng huyết áp vừa và nặng, telmisartan giảm HATT/HATTr đến -37,3/ -27,8 mmHg và chỉ số này là -22,4/-14,6 mmHg khi theo dõi huyết áp di động 24 giờ23,24. Hơn nữa, tỷ lệ đáp ứng huyết áp 24 giờ lên đến 98,1% và đạt huyết áp mục tiêu là 92,3%. Điều trị phối hợp telmisartan và amlodipine cho thấy an toàn và dung nạp tốt, tỷ lệ phù ngoại biên giảm đáng kể khi phối hợp telmisartan 40-80mg và amlodipine 5-10mg so với điều trị đơn thuần amlodipine 10mg (5,2% so với 17,8%; P<0,0001). Bên cạnh đó, tính an toàn và hiệu quả khi điều trị phối hợp telmisartan và amlodipine đã được chứng minh ở bệnh nhân châu Á, cũng như bệnh nhân đái tháo đường có tăng huyết áp và microalbumin niệu, khả năng giảm albumin niệu phụ thuộc vào liều dùng. Trong một nghiên cứu đánh giá biến cố tim mạch ở bệnh nhân có nguy cơ cao, telmisartan có hiệu quả tương đương ramipril nhưng dung nạp tốt hơn và tỷ lệ gắn kết điều trị cao hơn25, và tới hiện nay telmisartan là thuốc duy nhất trong nhóm ARB có chỉ định giảm tử vong tim mạch cho bệnh nhân có bệnh tim mạch do xơ vữa hoặc bệnh đái tháo đường có tổn thương cơ quan đích26.
Mục đích của nghiên cứu này là đánh giá hiệu quả và an toàn của phối hợp telmisartan 40 hoặc 80 mg phối hợp với amlodipine 10 mg so sánh với đơn trị liệu amlodipine 10 mg trên đối tượng bệnh nhân tăng huyết áp có huyết áp tâm trương chưa được kiểm soát sau 6 tuần điều trị bằng A10. Đây là nghiên cứu đầu tiên của dạng viên phối hợp telmisartan và amlodipine cho nhóm bệnh nhân này.
ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Thiết kế nghiên cứu
Đây là nghiên cứu ngẫu nhiên, mù đôi, có đối chứng, chia nhóm song song, đa quốc gia, đa trung tâm, kéo dài 8 tuần. Đánh giá hiệu quả và an toàn của viên phối hợp telmisartan và amlodipine (T/A) so sánh với đơn trị liệu amlodipine ở bệnh nhân tăng huyết áp chưa kiểm soát. Bệnh nhân được thu thập từ 97 trung tâm tại 14 quốc gia (Úc, Áo, Bulgari, Cộng hòa Séc, Ireland, Ý, New Zealand, Nga, Slovakia, Tây Ban Nha, Thụy Sĩ, Thổ Nhĩ Kỳ, Ukraine, và Mỹ). Thử nghiệm được tiến hành phù hợp với tuyên bố Helsinki (1996) và hướng dẫn hòa hợp 3 bên trong thực hành lâm sàng tốt (ICH Harmonized Tripartite Guideline for Good Clinical Practice), được sự chấp thuận của cơ quan y tế, hội đồng xét duyệt hoặc Ủy ban Đạo đức độc lập tại mỗi nước tham gia nghiên cứu.
Sau khi chọn lọc, bệnh nhân được khởi đầu điều trị nhãn mở với amlodipin 5 mg trong 2 tuần, chỉnh liều đến A10 trong 6 tuần, những bệnh nhân có huyết áp không kiểm soát được (HATTr ≥ 90 mmHg) được phân chia ngẫu nhiên (1:1:1) thành 3 nhóm điều trị: nhóm dùng viên phối hợp T40/A10, nhóm dùng viên T80/A10 và nhóm dùng A10 đơn thuần. Thuốc nghiên cứu được uống 1 lần vào buổi sáng từ 8h – 10h. Nếu quên 1 liều, bệnh nhân được hướng dẫn uống liều kế tiếp như kế hoạch.
Bệnh nhân
Bệnh nhân nam hoặc nữ ≥ 18 tuổi, tăng huyết áp vô căn (được xác định khi HATTr ≥ 95 mmHg đối với bệnh nhân đang điều trị thuốc hạ áp hoặc HATTr ≥ 100 mmHg ở bệnh nhân chưa điều trị) không kiểm soát được huyết áp sau 6 tuần điều trị A10 được chọn phân chia ngẫu nhiên. Tất cả bệnh nhân được ghi cam kết đồng ý tham gia nghiên cứu trước thử nghiệm.
Các tiêu chuẩn loại trừ bao gồm: nghi ngờ hoặc được chẩn đoán THA thứ phát, HATT trung bình khi ngồi ≥ 200 mmHg và/hoặc HATTr trung bình ≥ 120 mmHg tại thời điểm chọn bệnh hoặc bắt đầu giai đoạn chuẩn bị (run-in treatment), HATT trung bình tư thế ngồi ≥ 180 mmHg và/hoặc HATTr trung bình ≥ 120 mmHg ở cuối giai đoạn điều trị khởi động kèm triệu chứng suy tim (NYHA III hoặc IV), tổn thương gan nặng trên lâm sàng (ứ mật nặng, xơ gan), suy thận nặng (creatinine huyết thanh >3.0 mg/dL hoặc >265 mmol/L, độ thanh thải creatinine <30 mL/phút hoặc có dấu hiệu suy thận nặng trên lâm sàng), bệnh nhân có bất kỳ tình trạng nào làm ảnh hưởng đến tính an toàn khi tham gia nghiên cứu cũng được loại khỏi thử nghiệm. Phụ nữ có thai, cho con bú, tiền mãn kinh hoặc phụ nữ trong lứa tuổi sinh sản không áp dụng biện pháp tránh thai thích hợp cũng loại khỏi nghiên cứu. Những bệnh nhân đã từng có triệu chứng phù mạch khi sử dụng thuốc ức chế thụ thể hoặc thuốc đối kháng thụ thể angiotensin II, những người lạm dụng rượu và thuốc gây nghiện trong 6 tháng trước nghiên cứu, hoặc không tuân thủ điều trị trong giai đoạn run-in (được xác định khi độ tuân thủ <80% hoặc >120%) cũng loại khỏi nghiên cứu. Bệnh nhân không được phép dùng thuốc hạ áp khác hoặc các thuốc có ảnh hưởng huyết áp trong thời gian tham gia nghiên cứu.
Đánh giá
Huyết áp tư thế ngồi được đo tại phòng khám bằng máy đo huyết áp thủy ngân tiêu chuẩn hoặc dụng cụ thay thế thích hợp. Huyết áp đo tại thời điểm chọn bệnh, bắt đầu điều trị run-in nhãn mở, cuối giai đoạn điều trị run-in trước khi phân ngẫu nhiên, thời điểm 4 và 8 tuần sau khi điều trị mù đôi (khoảng 24 giờ sau liều cuối cùng). Trị số huyết áp được ghi nhận là số huyết áp trung bình của 3 lần đo liên tiếp cách nhau khoảng 2 phút. Mạch được đo trong khoảng thời gian 2 phút giữa lần đo huyết áp thứ 2 và thứ 3 ở mỗi lần thăm khám. Đánh giá hiệu quả dựa vào huyết áp sau 8 tuần điều trị hoặc trũng huyết áp cuối cùng ghi nhận được trong giai đoạn điều trị mù đôi.
Tiêu chí chính là sự thay đổi HATTr tư thế ngồi đo tại phòng khám sau 8 tuần điều trị. Tiêu chí phụ là sự thay đổi HATT, tỷ lệ bệnh nhân có đáp ứng HATTr (khi HATTr < 90 mmHg hoặc giảm ≥ 10 mmHg) và đáp ứng HATT (khi HATT <140 mmHg hoặc giảm ≥ 15 mmHg) sau 8 tuần điều trị, tỷ lệ bệnh nhân đạt HATT mục tiêu (HATT trung bình tư thế ngồi <140 mmHg), đạt HATTr mục tiêu (HATTr trung bình tư thế ngồi <90 mmHg), đạt huyết áp mục tiêu (HATT trung bình tư thế ngồi <140 mmHg và HATTr trung bình tư thế ngồi <90 mmHg) sau 8 tuần điều trị.
Tất cả các biến cố bất lợi, kể cả phù, xảy ra trong suốt nghiên cứu được ghi nhận lại. Các biến cố bất lợi được phân loại theo MedDRA (Medical Dictionary for Regulatory Activities) phiên bản 11.1. Khám lâm sàng và sinh hiệu được ghi nhận khi chọn bệnh (lúc bắt đầu nghiên cứu), chỉ số xét nghiệm thực hiện khi khởi động nghiên cứu (thời điểm phân ngẫu nhiên) và khi kết thúc nghiên cứu. ECG 12 chuyển đạo đo khi chọn bệnh và kết thúc nghiên cứu. Bác sĩ đánh giá tuân thủ điều trị bằng cách đếm viên thuốc nghiên cứu còn lại tại mỗi lần thăm khám.
Phân tích thống kê
Mức độ thay đổi huyết áp tư thế ngồi tại phòng khám tại thời điểm bắt đầu và kết thúc nghiên cứu được dùng để đánh giá hiệu quả của 2 phương pháp điều trị: viên phối hợp T/A và A10 đơn thuần. Sử dụng phân tích phương sai, điều chỉnh theo tiêu chí quốc gia và huyết áp nền.
Tỷ lệ bệnh nhân đáp ứng điều trị và đạt HA mục tiêu được đánh giá bằng phép kiểm Mantel Haenszel, biểu hiện bằng odds ratio (OR), sử dụng khoảng tin cậy 95%. Phép kiểm hơn được dùng để phân tích các hiệu quả chính giữa điều trị viên phối hợp T/A so với A 10 đơn trị. Các tiêu chí phụ được phân tích trước thử nghiệm.
Dựa vào kết quả các nghiên cứu gần đây khi sử dụng viên phối hợp telmisartan/hydrochlorothiazide28, với cỡ mẫu 240 bệnh nhân trong từng nhóm điều trị, 90% khả năng có thể phát hiện sự giảm 2,0 mmHg so với HATTr nền tư thế ngồi với hệ số ý nghĩa 0,05 trong phép kiểm 2 chiều. HA tâm trương được chọn làm tiêu chí chính trong nghiên cứu này nhằm đáp ứng yêu cầu của Cơ quan quản lý thuốc của Châu Âu (EMA) đối với việc đánh giá các thuốc điều trị THA29.
Phân tích tiêu chí chính và tiêu chí phụ được thực hiện đầy đủ cho tất cả bệnh nhân phân chia ngẫu nhiên có dùng ít nhất 1 liều thuốc nghiên cứu trong giai đoạn mù đôi, những bệnh nhân được đo trũng huyết áp nền và ít nhất 1 lần đo trũng huyết áp sau-liều (post-dose) trong giai đoạn điều trị mù đôi. Đánh giá tính an toàn cho tất cả bệnh nhân dùng ít nhất 1 liều thuốc nghiên cứu trong giai đoạn phân chia ngẫu nhiên.
KẾT QUẢ
Phân bố bệnh nhân và các đặc tính nền
Tổng cộng có 1531 bệnh nhân được tuyển chọn (đã được ký giấy chấp thuận tham gia nghiên cứu), sau đó 1356 bệnh nhân được điều trị khởi đầu với amlodipin 5 mg, trong số đó có 1305 bệnh nhân được chỉnh liều đến amlodipin 10mg, 949 bệnh nhân được phân ngẫu nhiên để điều trị mù đôi đến 8 tuần và 2 bệnh nhân không được điều trị mù đôi (hình 1). Đặc điểm lâm sàng và nhân chủng học của các nhóm điều trị được trình bày ở bảng 1. Phân tích tính hiệu quả được thực hiện trên 921 bệnh nhân và tính an toàn được đánh giá trên 947 bệnh nhân.
Trong 947 bệnh nhân được điều trị mù đôi, có 42 (4,4%) bệnh nhân ngưng sớm vì biến cố ngoại ý (n=23), vi phạm protocol (n=8), từ chối tiếp tục nghiên cứu (n=6), mất theo dõi (n=1), lý do khác (n=4) (hình 1). Tỷ lệ gắn kết điều trị cao, không khác biệt giữa các nhóm nghiên cứu. Tỷ lệ tuân thủ điều trị trung bình giai đoạn cuối nghiên cứu là 99% với 940 bệnh nhân tỷ lệ uống thuốc trong thử nghiệm từ ≥ 80% đến ≤ 120% trong 4 tuần trước đó.
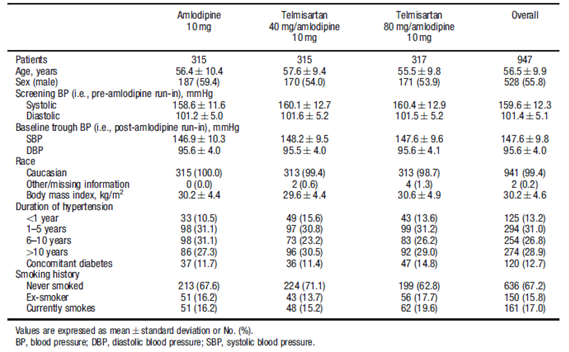
Bảng 1:Đặc điểm nền về lâm sàng và nhân chủng học của dân số phân bố ngẫu nhiên. (Chụp từ bản gốc Current Medical Research & Opinion Vol. 27, No. 11, 2011, 2145–2153)
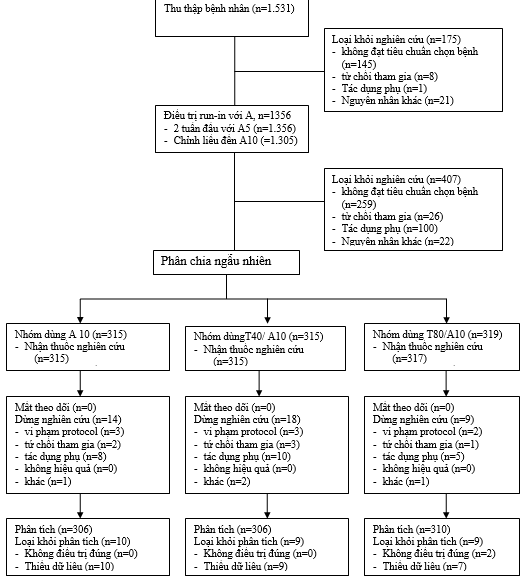
Hình 1:Phân bố bệnh nhân trong nghiên cứu
Hiệu quả
Giảm huyết áp
Cả hai dạng phối hợp T/A làm giảm HATT tư thế ngồi và HATTr nhiều hơn đáng kể so với A10 đơn trị (p<0,0001) (hình 2). Thay đổi trung bình HATT/HATTr là -11,3/-9,3mmHg (đến 136,2±0,7/86,2±0,5 mmHg) đối với bệnh nhân uống T80/A10 và -11,1/-9,2mmHg (đến 136,3±0,7/86,3±0,5 mmHg) đối với bệnh nhân uống T40/A10 so với-7,4/-6,5mmHg (đến 140,0±0,7/89,1±0,5 mmHg) ở bệnh nhân đơn trị A10. Sự khác biệt mức giảm HATT/HATTr (độ tin cậy 95%) trong nhóm T80/A10 so với nhóm A10 là-3,9mmHg (-5,3, -2,4; P<0,0001)/-2,8mmHg (-3,9,-1,8; P<0,0001). Nhóm T40/A10 có sự khác biệt trung bình mức giảm HATT/HATTr (với độ tin cậy 95%) so với nhóm A10 là -3,7mmHg (-5,2, -2,2; P<0,0001)/-2,8mmHg (-3,8, -1,8; P<0,0001) (hình 2).
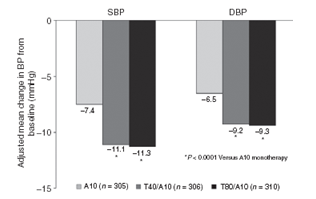
Hình 2:Mức độ thay đổi HATT hoặc HATTr sau 8 tuần điều trị với viên phối hợp telmisartan 40mg/amlodipine 10mg (T40/A10) hoặc telmisartan 80mg/amlodipine 10 mg (T80/A10) so với amlodipine 10mg (A10) đơn trị. (Chụp từ bản gốc Current Medical Research & Opinion Vol. 27, No. 11, 2011, 2145–2153)
Đáp ứng huyết áp
Cả 2 dạng phối hợp T/A có tỷ lệ bệnh nhân đáp ứng huyết áp (HATT<140mmHg hoặc HATT giảm ≥15 mmHg, HATTr < 90mmHg hoặc HATTr giảm ≥10 mmHg) cao hơn có ý nghĩa so với nhóm A10 (hình 3). Đối với nhóm T80/A10, OR với độ tin cậy 95% về khả năng đạt đáp ứng HATT/HATTr so với A10 là 1,68 (1,21;2,34; P=0.002) /1,92 (1,38;2,68;P<0,001), khi so sánh nhóm T40/A10 và A10, OR với độ tin cậy 95% là 1,58 (1,14;2,21; P=0,006)/1,67 (1,20;2,32;P=0,002)
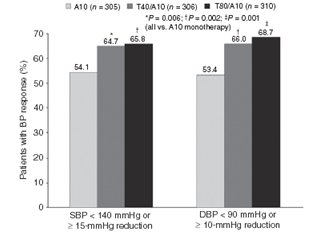
Hình 3:tỷ lệ bệnh nhân có đáp ứng huyết áp (HATT<140 mmHg hoặc giảm ≥ 15 mmHg, HATTr < 90 mmHg hoặc giảm ≥ 10 mmHg) sau 8 tuần điều trị với viên phối hợp T40/A10 hoặc T80/A10 so với A10 đơn trị. (Chụp từ bản gốc Current Medical Research & Opinion Vol. 27, No. 11, 2011, 2145–2153)
Tỷ lệ đạt HATT, HATTr và HA mục tiêu
Cả 2 dạng phối hợp T/A có tỷ lệ bệnh nhân đạt HATT hoặc HATTr mục tiêu (HATTr <90 mmHg hoặc HATT <140 mmHg) cao hơn nhiều so với nhóm A10 (hình 4). Đối với nhóm T80/A10, tỷ lệ đạt HATT và HATTr mục tiêu so với nhóm A10 có OR với độ tin cậy 95% là 1,55 (1,12;2,15; P=0,008) và 1,91 (1,37; 2,65; P<0,001). Nhóm T40/A10 so với nhóm A10 có OR với độ tin cậy 95% là 1,44 (1,04;2,00; P=0,027) và 1,67 (1,21; 2,32;P=0,002). Hai dạng phối hợp T/A cũng có tỷ lệ bệnh nhân đạt HA mục tiêu (HATT<140mmHg và HATTr<90 mmHg) cao hơn có ý nghĩa so với nhóm A10 (hình 4). So với nhóm A10, tỷ lệ đạt HA mục tiêu có OR với độ tin cậy 95% là 1,92 với T80/A10 (1,38; 2,67; P<0,001), và 1,57 với T40/A10 (1,13; 2,18; P=0,007)
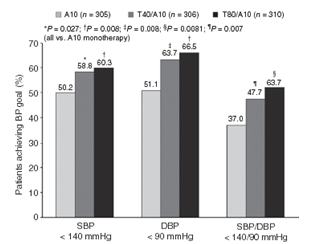
Hình 4:Tỷ lệ bệnh nhân với mục tiêu huyết áp khác nhau (HATT < 140 mmHg, HATTr < 90 mmHg, HA < 140/90 mmHg) sau 8 tuần điều trị với viên phối hợp T40/A10 hoặc T80/A10 so với A10 đơn trị (Chụp từ bản gốc Current Medical Research & Opinion Vol. 27, No. 11, 2011, 2145–2153)
Tính an toàn
Biến cố ngoại ý gặp nhiều nhất trong giai đoạn điều trị khởi đầu với amlodipin là phù ngoại biên với tỷ lệ 3.1% bệnh nhân (n=42) ở nhóm A5 và 16,6% (n=217) ở nhóm A10. Tỷ lệ bệnh nhân ngưng điều trị vì tác dụng phụ này ở 2 nhóm là 28,6% (n=12) và 36,9% (n=80).
Tổng cộng có 186 bệnh nhân (19,6%) được ghi nhận có ít nhất 1 biến cố ngoại ý trong 8 tuần điều trị mù đôi. Tỷ lệ biến cố ngoại ý mới hoặc diễn tiến xấu hơn trong giai đoạn phân ngẫu nhiên tương tự ở các nhóm điều trị: 17,5% (n=55) trong nhóm T40/A10;21,5% (n=68) trong nhóm T80/A10 và 20%(n=63) trong nhóm A10. Có 20 bệnh nhân phải ngưng điều trị do tác dụng phụ: 9 bệnh nhân nhóm T40/A10 (2,9%), 4 bệnh nhân nhóm T80/A10 (1,3%) và 7 bệnh nhân nhóm A10 (2,2%).
Số bệnh nhân có phù ngoại biên mới hoặc diễn tiến xấu trong giai đoạn phân ngẫu nhiên tương đối thấp và tương tự ở các nhóm điều trị (6,7% bệnh nhân nhóm T40/A10 [n=21]; 8.5% nhómT80/A10 [n=27] và 7,0%nhómA10 [n=22]). Phù ngoại biên mới hoặc diễn tiến xấu cũng là một biến cố ngoại ý thường gặp nhất dẫn đến ngừng nghiên cứu trong giai đoạn phân ngẫu nhiên. Ngưng điều trị gặp nhiều hơn ở nhóm A 10 (1,9% [n=6]) so với nhóm T40/A10 (1%[n=3]) và T80/A10 (0,6%[n=2]). Không biến cố ngoại ý nào khác dẫn đến ngưng điều trị được ghi nhận ở nhiều hơn 1 bệnh nhân.
83 bệnh nhân có các biến cố ngoại ý liên quan đến thuốc và tỷ lệ này có thể so sánh giữa các nhóm (T40/A10 là 7.9% [n=25]; T80/A10là 9.8% [n=31]; và A10 là 8.6% [n=27]). Biến cố ngoại ý nghiêm trọng ghi nhận ở 4 bệnh nhân (0,4%), không biến cố nào liên quan đến thuốc nghiên cứu. Không ghi nhận thay đổi ECG, mạch, xét nghiệm từ đầu đến kết thúc nghiên cứu.
BÀN LUẬN
Đây là nghiên cứu ngẫu nhiên, mù đôi, có đối chứng, kéo dài 8 tuần, cho thấy điều trị viên phối hợp T40/A10 hoặc T80/A10 làm giảm đáng kể HATT/HATTr (-11,1/-9,2 mmHg hoặc -11,3/-9,3 mmHg) so với A10 (-7,4/-6,5 mmHg) (P<0,0001), thực hiện trên bệnh nhân dung nạp nhưng không kiểm soát được amlodipin đơn trị liều cao. Bệnh nhân trong nhóm điều trị kết hợp T40-80/A10 có tỷ lệ đạt HATT và HATTr mục tiêu cao hơn nhóm A10 đơn trị. Hơn nữa, nhóm dùng viên phối hợp T40-80/A10 có tỷ lệ đạt HA mục tiêu (HATT/HATTr <140/90 mmHg) cao hơn nhóm A10 (47,7% và 52,3% so với 37,0%). Tần xuất đáp ứng HATT/HATTr ở nhóm T40-80/A10 cũng cao hơn đáng kể nhóm A10 và tỷ lệ này tương đương giữa 2 nhóm dùng viên phối hợp (T40/A10là65/66%; T80/A10là66/69%). Điều trị viên phối hợp T/A dung nạp tốt. Khả năng có biến cố ngoại ý mới hoặc diễn tiến xấu trong nhóm phối hợp T/A và nhóm A10 đơn trị tương đương, tỷ lệ ngưng điều trị ngẫu nhiên vì biến cố ngoại ý cũng tương tự. Tỷ lệ bệnh nhân phù ngoại biên mới hoặc diễn tiến xấu phải ngưng điều trị thấp hơn có ý nghĩa so với nhóm A10 đơn thuần.
Trong 1 nghiên cứu tổ hợp (factorial study) trước đây, bệnh nhân THAđược điều trị phối hợp ngay với telmisartan và amlodipine. Mức độ giảm huyết áp trong nhóm dùng T40 hoặc T80 kết hợp A10 cao hơn kết quả nghiên cứu của chúng tôi. Tuy nhiên, sự khác biệt này có thể giải thích theo giả thiết về khả năng đáp ứng bệnh nhân khác nhau do tình trạng đề kháng với thuốc hạ huyết áp khi dùng liều cao A10.
Nghiên cứu này chỉ nhận những bệnh nhân không đạt HATTr mục tiêu với A10 và dung nạp với thuốc. Trong khi đó, các bệnh nhân trong nghiên cứu tổ hợp không được tầm soát trước về khả năng đáp ứng và dung nạp thuốc, được điều trị ngay với telmisartan và amlodipine. Nghiên cứu tổ hợp cho thấy tỷ lệ phù giảm đáng kể khi phối hợp telmisartan và amlodipine. Trong nghiên cứu của chúng tôi, những bệnh nhân được đưa vào điều trị mù đôi đã được tầm soát kỹ về khả năng dung nạp trong giai đoạn run-in. Trong số 96 bệnh nhân (7,4% của số bệnh nhân được run-in với A10) phải ngưng thuốc do tác dụng ngoại ý trong giai đoạn run-in nhãn mở với A10, 80 trường hợp ghi nhận do phù ngoại biên. Điều này giải thích tỷ lệ phù thấp trong giai đoạn điều trị mù đôi của nhóm A10. Tỷ lệ phù này tương đương với các nghiên cứu có thiết kế tương tự có sử dụng ARB khác phối hợp với amlodipin.
Kết quả các nghiên cứu hiện nay đã chứng minh rằng, điều trị phối hợp telmisartan và amlodipine là một lựa chọn điều trị ban đầu hiệu quả, cũng như là bước điều trị thứ hai ở bệnh nhân chưa kiểm soát được với A10 đơn trị liệu.
Kiểm soát HA tốt đã được chứng minh làm giảm nguy cơ biến cố tim mạch. Kết quả nghiên cứu này cho thấy dạng viên phối hợp 2 thuốc có cơ chế tác dụng khác nhau như mộtARB và CCB có thể làm tăng hiệu quả điều trị hạ huyết áp. Hơn nữa cách dùng 1 viên đơn giản làm tăng khả năng tuân thủ điều trị, giúp cải thiện kết cục tim mạch.
Viên phối hợp T40/A10 và T80/A10 uống 1 viên mỗi ngày cho hiệu quả hạhuyếtáp vượt trội và giảm tử vong tim mạch dài hạn tốt hơn đơn trị liệu A10. Dạng viên phối hợp này thích hợp cho bệnh nhân tăng huyết áp cần điều trị phối hợp để đạt huyết ápmục tiêu.
KẾT LUẬN
Khi thay đổi điều trị từ A10 sang viên phối hợp T40/A10 hoặc T80/A10 cho những bệnh nhân chưa kiểm soát được huyết áp với amlodipin đơn trị liệu cho kết quả giảm HATT/HATTr và cải thiện đáng kể HATT/HATTr cũng như tỷ lệ bệnh nhân đạt HA mục tiêu. Trong nghiên cứu của chúng tôi, khoảng 2/3 bệnh nhân chưa kiểm soát được HA trước đó có đáp ứng với điều trị T40/A10 hoặc T80/A10, và tỷ lệ tương đương bệnh nhân đạt HATTr mục tiêu. Viên phối hợp T/A có mức dung nạp tốt.
TÀI LIỆU THAM KHẢO
1.Lewington S, Clarke R, Qizilbash N, et al. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002;360:1903-13
2. Mancia G, De Backer G, Dominiczak A, et al. 2007 ESH-ESC Practice Guidelines for the Management of Arterial Hypertension: ESH-ESC Task Force on the Management of Arterial Hypertension. J Hypertens 2007; 25:1751-62
3. Chobanian AV, Bakris GL, Black HR, et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. JAMA 2003;289:2560-72
4. Black H, Elliott J, Neaton J, et al. Baseline characteristics and early blood pressure control in the CONVINCE Trial. Hypertension 2001;37:12-18
5. Cushman W, Ford Ch, Cutler J, et al. Success and predictors of blood pressure control in diverse North American settings: the Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT). J Clin Hypertens 2002;4:393-404
6. Mancia G, Laurent S, Agabiti-Rosei E, et al. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document. J Hypertens 2009;27:2121-58
7. Allemann Y, Fraile B, Lambert M, et al. Efficacy of the combination of amlodipine and valsartan in patients with hypertension uncontrolled with previous monotherapy: the Exforge in Failure after Single Therapy (EX-FAST) study.
J Clin Hypertens 2008;10:185-94
8. Chrysant SG, Melino M, Karki S, et al. The combination of olmesartan medoxomil and amlodipine besylate in controlling high blood pressure: COACH, a randomized, double-blind, placebo-controlled, 8-week factorial efficacy and
safety study. Clin Ther 2008;30:587-604
9. Chrysant SG, Oparil S, Melino M, et al. Efficacy and safety of long-term treatment with the combination of amlodipine besylate and olmesartan medoxomil in patients with hypertension. J Clin Hypertens 2009;11:475-82
10. Barrios V, Brommer P, Haag U, et al. Olmesartan medoxomil plus amlodipine increases efficacy in patients with moderate-to-severe hypertension after monotherapy: a randomized, double-blind, parallel-group, multicenter study. Clin Drug Invest 2009;29:427-39
11. Poldermans D, Glazes R, Kargiannis S, et al. Tolerability and blood pressurelowering efficacy of the combination of amlodipine plus valsartan compared with lisinopril plus hydrochlorothiazide in adult patients with stage 2 hypertension.
Clin Ther 2007;29:279-89
12. Schunkert H, Glazer RD, Wernsing M, et al. Efficacy and tolerability of amlodipine/valsartan combination therapy in hypertensive patients not adequately controlled on amlodipine monotherapy. Curr Med Res Opin 2009;25:2655-62
13. Sharma A, Bagchi A, Kinagi SB, et al. Results of a comparative, phase III, 12-week, multicenter, prospective, randomized, double-blind assessment of the efficacy and tolerability of a fixed-dose combination of telmisartan and
amlodipine versus amlodipine monotherapy in Indian adults with stage II hypertension. Clin Ther 2007;29:2667-76
14. Volpe M, Brommer P, Haag U, et al. Efficacy and tolerability of olmesartan medoxomil combined with amlodipine in patients with moderate to severe hypertension after amlodipine monotherapy: a randomized, double-blind, parallel-group, multicentre study. Clin Drug Investig 2009;29:11-25
15. Dahlo¨ f B, Sever PS, Poulter NR, et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo- Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet 2005; 366:895-906
16. Jamerson K, Weber MA, Bakris GL, et al. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high-risk patients. N Engl J Med 2008;359:2417-28
17. Kjeldsen SE, Weber M, Oparil S, et al. Combining RAAS and calcium channel blockade: ACCOMPLISH in perspective. Blood Press 2008;7:260-9
18. Costa FV. Telmisartan standing out in a crowded contest? High Blood Press Cardiovasc Prev 2006;13:85-94
19. Burnier M. Telmisartan: a different angiotensin II receptor blocker protecting a different population? J Int Med Res 2009;37:1662-79
20. Kakuta H, Sudoh K, Sasamata M, et al. Telmisartan has the strongest binding affinity to angiotensin II type 1 receptor: comparison with other angiotensin II type 1 receptor blockers. Int J Clin Pharmacol Res 2005;25:41-6
21. Lacourcie` re Y, Krzesinski JM, White WB, et al. Sustained antihypertensive activity of telmisartan compared with valsartan. Blood Press Monit 2004; 9:203-10
22. Smith DH, Cramer MJ, Neutel JM, et al. Comparison of telmisartan versus losartan: meta-analysis of titration-to-response studies. Blood Press Monit 2003;8:111-17
23. Littlejohn III TW, Majul CR, Olvera R, et al. Results of treatment with telmisartan-amlodipine in hypertensive patients. J Clin Hypertens 2009;11:1-7
24. Littlejohn III TW, Majul CR, Olvera R, et al. Telmisartan plus amlodipine in patients with moderate or severe hypertension: results from a subgroup analysis of a randomized, placebo-controlled, parallel-group, 4_4 factorial
study. Postgrad Med 2009;121:5-14
25. Yusuf S, Teo KK, Pogue J, et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008;358:1547-59
26. European Medicines Agency. Micardis Summary of Product Characteristics. Available at:
http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_ Product_Information/human/000209/WC500027641.pdf [Last accessed 27 September 2011]
27. Dabl_ Educational Trust. Available at: www.dableducational.org [Last accessed 13 July 2007]
28. Neldam S, Edwards C. Results of increasing doses of hydrochlorothiazide in combination with an angiotensin receptor blocker in patients with uncontrolled hypertension. J Clin Hypertens 2008;10:612-18
29. European Medicines Agency. 2004 Committee for Medicinal Products for Human Use. Clinical investigation of medicinal products in the treatment of hypertension. (CPMP/EWP/238/95)
30. Moen MD. Telmisartan/amlodipine: single-pil








