 Hẹp thân chung mạch vành là tổn thương có tiên lượng xấu với điều trị nội khoa, mổ bắc cầu mạch vành trong trường này có ý nghĩa cải thiện tiên lượng và kết quả lâu dài cho bệnh nhân(1-3). Mặc dù, chụp mạch vành được xem là tiêu chuẩn
Hẹp thân chung mạch vành là tổn thương có tiên lượng xấu với điều trị nội khoa, mổ bắc cầu mạch vành trong trường này có ý nghĩa cải thiện tiên lượng và kết quả lâu dài cho bệnh nhân(1-3). Mặc dù, chụp mạch vành được xem là tiêu chuẩn
Toshiya Muramatsu**, Yoshiaki Ito**, Nguyễn Huỳnh Khương*, Vũ Năng Phúc*, Phạm Huy Hoàng*, Nguyễn Thị Tuyết Mai*,
Phạm Nguyễn Vinh***
*:Bác sĩ khoa tim mạch can thiệp BV Tim Tâm Đức.
**:Bác sĩ khoa tim mạch BV.Saiseikai Yokohama-city Eastern Hospital, Yokohama,JP.
***: Phó giáo sư, tiến sĩ, Giám đốc Y khoa BV Tim Tâm Đức.
Hẹp thân chung mạch vành là tổn thương có tiên lượng xấu với điều trị nội khoa, mổ bắc cầu mạch vành trong trường này có ý nghĩa cải thiện tiên lượng và kết quả lâu dài cho bệnh nhân(1-3). Mặc dù, chụp mạch vành được xem là tiêu chuẩn vàng để đánh giá tổn thương mạch vành, nhưng kỹ thuật này có một số giới hạn trong đánh giá hẹp thân chung mạch vành(4-8).
Siêu âm trong lòng mạch IVUS( Intravascular Ultrasound) là phương pháp chính xác để xác định kích thước mạch máu, thành mạch và nhạy hơn chụp mạch vành trong phát hiện sớm mãng xơ vữa(9-12).
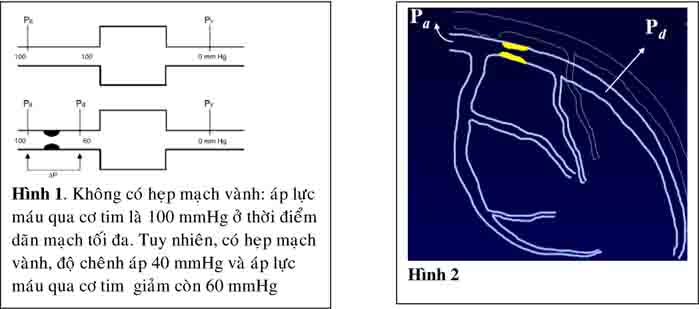
Đo phân xuất dự trữ luồng máu mạch vành FFR( Fractional flow reserve) là phương pháp xâm lấn đánh giá tổn thương mạch vành rất chính xác, đây là phương pháp đánh giá huyết động và chức năng mạch vành, chỉ số FFR được tính bằng tỉ số của áp lực sau chỗ hẹp (Pd) chia cho áp lực động mạch chủ(Pa) (Pd: áp lực sau chỗ hẹp đo bằng pressure wire đối với tổn thương thân chung: vị trí pressure wire nằm ở đoạn đầu của nhánh mũ(Cx) hoặc liên thất trước(LAD)), Pa: áp lực động mạch chủ đo bằng ống thông can thiệp( Guiding catheter) vị trí đầu ống thông trong động mạch chủ), cả hai áp lực đo đồng thời trong điều kiện tối ưu luồng máu mạch vành bằng tiêm adenosin trong mạch vành(13) (hình1-2) . Giá trị FFR <0.75 được xem là hẹp mạch vành có ý nghĩa và là ngưỡng xem xét tái tưới máu mạch vành(14-16).Mặc dù, đây là phương pháp có giá trị chính xác rất cao thường sử dụng trong các nghiên cứu, tuy nhiên không phổ biến như chụp mạch vành và siêu âm trong lòng mạch trong thực hành lâm sàng.
+ Hướng dẫn của Hiệp Hội tim mạch và Trường môn tim mạch Mỹ( ACC/AHA) đối với bệnh nhân đau ngực ổn định 2002: Class Ib (17).
+ Hướng dẫn của Hiệp Hội tim mạch và Trường môn tim mạch Mỹ( ACC/AHA) về phẫu thuật bắc cầu 2004 : Class IA ( 18).
+ Hướng dẫn của Hiệp Hội tim mạch và Trường môn tim mạch Mỹ( ACC/AHA) về điều trị bệnh nhân đau ngực không ổn định, nhồi máu cơ tim không ST chênh lên 2007: Class IA (19).
+ Hướng dẫn của ACCF/SCAI/STS/AATS/AHA/ASNC 2009 về tiêu chuẩn thích hợp cho tái tưới máu mạch vành(20): mổ bắc cầu mạch vành cho bệnh nhân hẹp thân chung có ý nghĩa: 9 điểm: điểm tối đa cho chỉ định mổ bắc cầu ( Appropriate).
Vì vậy, đánh giá chính xác hẹp thân chung hết sức quan trọng trong thực hành lâm sàng.
II. Những hạn chế của chụp mạch vành trong đánh giá tổn thương mạch vành
Chụp mạch vành không thực sự hoàn thiện đánh giá tổn thương mạch vành vì mô tả tổn thương trên hai bình diện (21,22), thậm chí bác sĩ can thiệp có kinh nghiệm đánh giá mức độ hẹp cũng khó khăn khi tổn thương trung bình (23,24,25).
Những nghiên cứu mô học đã chứng minh rằng những tổn thương hẹp động mạch thường không phát hiện trên hình ảnh chụp mạch vành cho đến khi diện tích mảng xơ vữa chiếm 40-50% của diện tích động mạch trên thiết diện ngang. Màng chun dãn ngoài (EEM: External Elastic Membrane) bao bên ngoài của thành động mạch có khả năng dãn ra để bù trừ lại sự hẹp lòng mạch do sự phát triển của mảng xơ vữa. Nhưng khi mảng xơ vữa vượt quá 40-50% diện tích cắt ngang của EEM thì bắt đầu làm hẹp lòng mạch. Lúc này trên hình ảnh chụp mạch vành mới có thể phát hiện hẹp.
Một số trường hợp, hình ảnh chụp mạch vành có thể phát hiện sớm tổn thương hẹp vì lớp EEM không dãn bù trừ gọi là hiện tượng tái cấu trúc động mạch âm tính (negative remodeling). Trong khi đó IVUS có thể phát hiện độ lớn mãng xơ vữa và diện tích EEM, do đó nhạy hơn so với chụp mạch vành.
III. Vai trò IVUS trong đánh giá tổn thương thân chung
Siêu âm trong lòng mạch (IVUS) sử dụng đầu dò siêu âm từ 20-50 MHz(28), đầu dò được đưa vào mạch vành qua ống thông can thiệp, đường kính của đầu dò IVUS 2.6-3.5 French có thể thực hiện với ống thông can thiệp 6 French, có hai loại: đầu dò điện tử và đầu dò cơ học, với đầu dò cơ học cần flush dung dịch nước kỹ vì bất kỳ một bóng khí nhỏ nào cũng làm giảm chất lượng hình ảnh. Vị trí đầu dò vào mạch vành ít nhất 10mm sau tổn thương kéo lui đầu dò bằng tay hoặc bằng motor (tốc độ 0.25-1mm/s)(27).
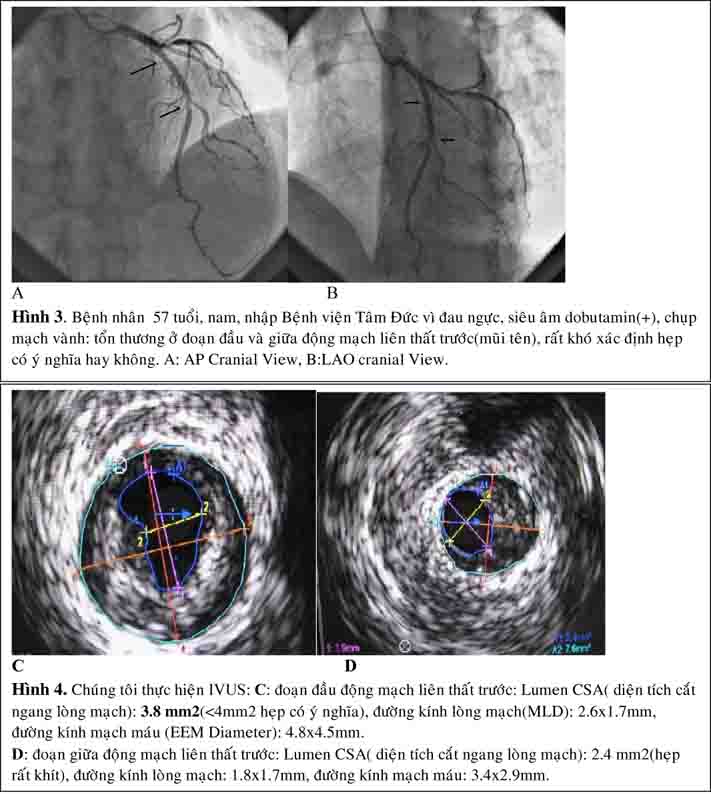
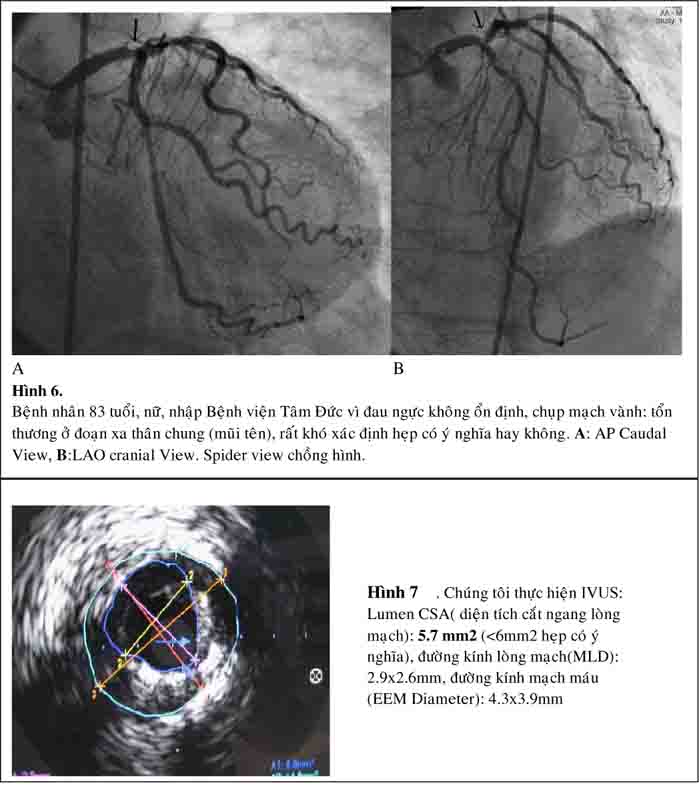
Siêu âm trong lòng mạch (IVUS) là phương pháp hữu ích trong đánh giá hẹp mạch vành khó xác định mức độ hẹp trên hình ảnh chụp mạch vành, hẹp ở lỗ
xuất phát, kèm tổn thương phình. Đặc biệt trong trường hợp cần thiết can thiệp thân chung, IVUS giúp đánh giá giải phẫu chi tiết thân chung: kích thước động mạch, xác định có tổn thương lỗ xuất phát của nhánh mũ và nhánh liên thất trước hay không và mức độ canxi hóa (27).
Phần lớn các nghiên cứu chứng minh rằng hẹp thân chung với diện tích lòng mạch tối thiểu trên hình ảnh IVUS(MLA: minimum lumen area) < 6.0 mm2 là có ý nghĩa và nên điều trị tái tưới máu vì có giá trị tiên đoán tốt kết quả lâm sàng sau tái tưới máu(29).
Nghiên cứu của Jasti và cộng sự(30) giá trị MLA<5.9 mm2 và đường kính tối thiểu (MLD: minimum lumen diameter) < 2.8mm có tương quan chặc chẽ với FFR < 0.75( độ nhạy 93%, độ đặc hiệu 98%; Độ nhạy 93%, độ đặc hiệu 94% theo thứ tự), hơn nữa, biến cố tim mạch bao gồm: tử vong, nhồi máu cơ tim, hoặc tái tưới máu do hẹp thân chung hay mạch vành khác cao hơn có ý nghĩa ở nhóm FFR < 0.75 so với > 0.75. và không có khác biệt giữa nhóm FFR > 0.75 và nhóm FFR < 0.75 có tái tưới máu ở thời điểm 38 tháng.
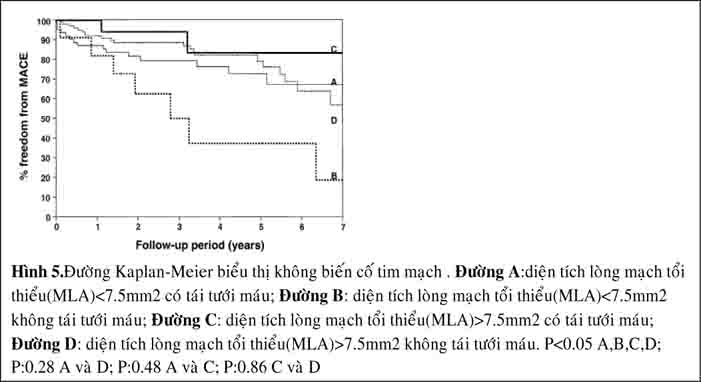
Nghiên cứu của Fassa và cộng sự(31) kết luận rằng giá trị MLA > 7.5mm2 của thân chung: không nên tái tưới máu, và MLA < 7.5mm2 nên tái tưới máu vì biến cố tim mạch bao gồm tử vong, nhồi máu cơ tim, hoặc tái tưới máu rất cao theo dõi 7 năm (hình 5).
IV. Kết luận
Cả hai đo phân xuất dự trữ luồng máu mạch vành(FFR) và Siêu âm trong lòng mạch (IVUS) là phương pháp bổ sung thông tin hình ảnh và chức năng mạch vành cho chụp mạch vành trong đánh giá tổn thương thân chung. Giúp xác định tổn thương trung bình thân chung cần thiết tái tưới máu và tránh những tái tưới máu không cần thiết. Tuy nhiên, IVUS là phương pháp được sử dụng rộng rãi hơn trong thực hành lâm sàng so với đo FFR.
1. Conley MJ, Ely RL, Kisslo J, Lee KL, McNeer JF, Rosati RA. The prognostic spectrum of left main stenosis. Circulation 1978;57:947-52.
2. Yusuf S, Zucker D, Peduzzi P, et al. Effect of coronary artery bypass graft surgery on survival: overview of 10 year results from randomized trial by the Coronary Artery Bypass Graft Surgery Trialists Collaboration. Lancet 1994;344:563-70.
3. Caracciolo EA, Davis KB, Sopko G, et al. Comparison of surgical and medical group survival in patients with left main coronary artery disease: long term CASS experience. Circulation 1995;91:2325-34.
5. Fisher LD, Judkins MP, lesperance J, et al. Reproducibility of coronary arteriographic reading in the Corornary Artery Surgery Study (CASS). Catheter Cardiovasc Diagn 1982; 8:565-75.
6. Cameron A, Kemp HG Jr, Fisher LD, et al. Left main coronary artery stenosis: angiographic determination. Circulation 1983; 68:484-9.
7. Topol EJ, Nissen SE. Our preoccupation with coronary luminology. The dissociation between clinical and angiographic findings in ischemic heart disease. Circulation 1995;92:2333-42.
8. Bergelson BA, Tommasso CL. Left main coronary artery disease: assessment, diagnosis, and therapy. Am Heart J 1995; 129: 350-9.
9. Nishimura RA, Edward WD, Warnes CA, et al. Intravascular ultrasound imaging: in vitro validation and pathologic correlation. J Am Coll cardiol 1990;16:145-54.
10. St Goar FG, Pinto FJ, Alderman EL, Fitzgerald PJ, Stadius ML, Popp RL. Intravascular ultrasound imaging of angiographically normal coronary arteries: an in vivo comparison with quantitative angiography. J Am Coll Cardiol 1991;18:952-8.
11. Nissen SE, Gurley JC, Grines CL, et al. Intravascular ultrasound assessment of lumen size and wall morphology in normal subjects and patients with coronary artery disease. Circulation 1991;84:1087-99.
12. Porter TR, Sears T, Xie F, et al. Intravascular ultrasound study of angiographically mildly diseased coronary arteries. J Am Coll Cardiol 1993; 22:1858-65.
13. Leesar MA, Abdul-Baki T, Akkus NI, Sharma A, Kanna T, Bolli R. Use of fractional reserve versus stress perfusion scintigraphy after unstable angina. Effect on duration of hospitalization, cost, procedural characteristics, and clinical outcome. J Am Coll cardiol 2003;41(7):1115-21.
14. Pijls NH, de Bruyne B, Pearls K, et al. Measurement of fractonal flow reserve to assess the functional severity of coronary artery stenoses. N Engl J Med 1996; 334: 1703-8.
15. Chamuleau SA, Mouwissen M, Koch KT, et al. Usefulness of fractional flow reserve for risk stratification of patients with multivessel coronary artery disease and intermediate stenosis. Am J Cardiol 2002;89:377-80.
16. Bech GJ, de Bruyne B, Bonnier HJ, et al. Long-term follow-up after deferral of percutaneous transluminal coronary angioplasty of intermediate stenosis on the basis of coronary pressure measurement. J Am Coll cardiol 1998;31:841-7.
17. Raymond J. Gibbons et al; ACC/AHA 2002 Guideline Update for the management of Patient with Chronic Stable Angina. Circulation; January, 2003.
18. Kim A Eagle; Robert A. Guyton et al; ACC/AHA 2004 Guideline Update for Coronary Artery Bypass Graft Surgery. Circulation; August 31, 2004.
19. Jeffrey L. Anderson et al; ACC/AHA 2007 Guideline for the management o
f Patient with Unstable Angina/Non ST-Elevation Myocardial Infarction Executive Summary. J. Am. Coll. Cardiol 2007; 50: 652-726.
20. ACCF/SCAI/STS/AATS/AHA/ASNC 2009 Appropriateness Criteria for Corornary Revascularization: A Report by the American College of Cardiology Foundation Appropriateness Criteria Task Force, Society for Cardiovascular Angiography and Intervention, Society of Thoracic Surgeons, American Association for Thoracic Surgery, American Heart Association, and the American Society of Nuclear Cardiology Endorsed by the American Society of Echocardiography, the Heart Failure Society of America, and the Society of Cadiovascular Computed Tomography, J.Am.Coll. Cardiol. 2009; 53;530-553.
21. Marcus ML, Skorton DJ, Johnson MR, Collins SM, Harrison DG, Kerber RE. Visual estimates of percent diameter coronary stenosis:”a battered gold standard”. J Am Coll Cardiol 1988;11(4):882-5.
22. Ricciardi MJ, Meyers S, Choi K, Pang JL, Goodreau L, Davidson CJ.Angiographically silent left main disease detected by intravascular ultrasound: a marker for future adverse cardiac events. Am Heart J 2003;146(3):507-12.
23. Linddstaedt M, Spiecker M, Perings C, Lawo T, Yazar A, Holland-Letz T, et al. How good are experienced interventional cardiologist at predicting the functional significance of intermediate or equivocal left main coronary artery stenoses? Int J cardiol 2007;120(2):254-61.
24. Isner JM, Kishel J, Kent KM, Ronan JA Jr, Ross AM, Roberts WC.Accuracy of angiographic determination of left main coronary arterial narrowing. Angiographic –histologic correlative analysis in 28 patients. Circulation 1981;639(5):1056-64.
25. Fisher LD, Judkins MP, Lesperance J, Cameron A, Swaye P, Ryan T, et al. reproducibility of coronary arteriographic reading in the coronary artery surgery study(Cass). Cathet Cardiovasc Diagn 1982(6):565-75.
26. Jonathan Tobis, Babak Azarbal, and Leo Slavin; Assessment of Intermediate Severity Coronary Lesions in the catheterization laboratory; J. Am. Coll. Cardiol, 2007;49:839-848.
27. American College of Cardiology clinical expert consensus document on standards for acquisition , measurement and reporting of intravascular ultrasound studies (IVUS) :A report of the american college of cardiology task force on clinical expert consensus documents developed in collaboration with the european society of cardiology endorsed by the society of cardiac angiography and interventions. Gary S.Mintz, Steven E.Nissen et al. J.Am. Coll. Cardiol 2001;37;1478-1492.
28. Mi Mario C, Gorge G, Peters R, Kearney P, Pinto F, Hausmann D, et al. Clinical application and image interpretation in intracoronary ultrasound. Study Group on Intracoronary Imaging of the Working Group of Coronary Circulation and of the Subgroup on Intravascular Ultrasound of the Working Group of Echocardiography of the European Society of Cardiology. Eur Heart J 1998; 19:207-29.
29. Venu Jasti et al, Correlation between Fractional Flow Reserve and Intravascular Ultrasound in patients With an Ambiguous Left Main Coronary Artery Stenosis, Circulation 2004; 110;2831-2836
30. Massoud A. Leesar, Intravascular Ultrasound for the Assessment of an Ambiguous Left main Coronary Artery Stenosis, J. Am. Coll. Cardiol. 2005;46;2145.
31. Amir-Ali Fassa et al; Intravascular ultrasound-guided treatment for angiographycally indeterminate left main coronary artery disease:A long-term follow-up study. J. Am. Coll. Cardiol. 2005;45:204-211.
32. Andrea S. Abizaid et al; One-year follow-up after intravascular ultrasound assessment of moderate left main coronary artery disease in patients with ambiguous angiograms; J. Am. Coll. Cardiol. 1999;34;707-715.
33. Massoud A. Leesar, Letters to the Editor; Intravascular Ultrasound for the Assessment of an Ambiguous Left main Coronary Artery Stenosis, J. Am. Coll. Cardiol. 2005;46;2145.