NGUYỄN TRƯỜNG DUY
Bộ môn Nội – Đại Học Y Dược TP. HCM
Trung tâm Tim Mạch – Bệnh viện Chợ Rẫy
Hội chứng tăng eosinophil là một nhóm bệnh lý do sự sản xuất quá mức và kéo dài của bạch cầu ái toan. Bạch cầu ái toan sẽ thâm nhiễm vào các cơ quan trong cơ thể, phóng thích ra các hóa chất trung gian gây tổn thương hàng loạt các cơ quan. Chúng tôi báo cáo một trường hợp bệnh nhân có bệnh cơ tim thâm nhiễm eosinophil với bệnh cảnh suy tim nặng và huyết khối trong buồng tim.
GIỚI THIỆU BỆNH ÁN
Bệnh nhân Võ Thị Ánh H. , sinh năm 1984 (36 tuổi). Nghề nghiệp: nội trợ.
Nhập viện ngày 30-06-2020. Số hồ sơ: 57240.
Lý do nhập viện: khó thở.
Khoảng 2 tháng trước nhập viện, bệnh nhân khó thở tăng dần: khó thở khi đi bộ khoảng 300 m, không còn làm được việc nặng, yếu 2 chi dưới tăng dần. Cách nhập viện 1 tuần: khó thở khi đi lại trong nhà, không còn làm được việc nội trợ, phải kê 2 gối khi ngủ. Đồng thời, bệnh nhân phù mềm 2 chân từ gối trở xuống tăng dần, ăn uống kém, sụt 4kg/2 tháng, tiêu tiểu bình thường. Bệnh nhân không sốt trong suốt quá trình bệnh. Bệnh nhân đến khám và nhập bệnh viện Chợ Rẫy.
Tiền căn:
PARA: 3003.
Bệnh nhân không có bệnh lý đáng chú ý, không sử dụng thuốc gì trong thời gian gần đây.
Khám lâm sàng:
– BN tỉnh, tiếp xúc tốt. Không đau ngực, còn khó thở phải nằm đầu cao 2 gối.
Mạch: 110 l/ph Huyết áp: 100/60 mmHg
Nhiệt độ: 370C Nhịp thở: 22 lần/phút
Cân nặng: 40kg BMI: 18.5 kg/m2
– Niêm hồng. Tĩnh mạch cảnh nổi/đầu cao 60o, CVP # + 15 cmH2O
– Tim:
+ Mỏm tim: khoang liên sườn V đường trung đòn trái.
+ Dấu nảy trước ngực (-), Harzer (-).
T1, T2 đều rõ, không âm thổi, không tiếng tim bất thường.
– Phổi: trong, không rale, hội chứng 3 giảm 2 đáy phổi.
– Không ghi nhận hồng ban ngoài da, không lở miệng. Hạch ngoại biên không sờ thấy.
– 2 chân: phù mềm dưới gối, ấn lõm, không nóng, không dấu hiệu viêm mô tế bào. Đầu chi hồng, cử động các ngón chân bình thường, không dị cảm.
– Các xét nghiệm căn bản:
Bảng 1. Công thức máu
| Thành phần | Kết quả | Đơn vị | Giá trị bình thường |
| RBC | 4,62 | T/L | 3,8 – 5,5 |
| HGB | 136 | g/L | 120 – 170 |
| HCT | 41 | % | 34 – 50 |
| MCV | 88,7 | fL | 78 – 100 |
| MCH | 29,4 | pg | 24 – 33 |
| MCHC | 331 | g/L | 315 – 355 |
| WBC | 22,44 | G/L | 4 – 11 |
| %NEU | 34,7 | % | 45 – 75 |
| NEU | 7,78 | G/L | 1,8 – 8,75 |
| %LYM | 16,3 | % | 20 – 40 |
| LYM | 3,65 | G/L | 0,8 – 4,4 |
| %EOS | 43,1 | % | 2 – 8 |
| EOS | 9,68 | G/L | 0,08 – 0,88 |
| PLT | 86 | G/L | 200 – 400 |
Ghi nhận: bạch cầu ái toan (eosinophil) tăng cao gấp 5 lần giới hạn trên của mức bình thường, giảm tiểu cầu.
Bảng 2. Xét nghiệm sinh hóa máu
| Glucose | BUN | Creatinine | ALT | AST | NT-Pro BNP | Troponin I | TPTNT |
| 96 mg/dL | 19 mg/dL | 0,72 mg/dL | 32 U/L | 65 U/L | 640,9 pmol/L | 0.56 ng/mL | Bình thường
Protein: (-) Blood (-) |
Ghi nhận: bệnh nhân có tăng AST + Troponin I + NT-proBNP, gợi ý có tổn thương cơ tim.
Các xét nghiệm sinh hóa máu khác như nồng độ beta-2 microglobulin, ion đồ, chức năng tuyến giáp (TSH, fT4) đều trong giới hạn bình thường.
Điện tâm đồ: có hình ảnh nhịp nhanh xoang, không ghi nhận hình ảnh lớn nhĩ – thất hoặc rối loạn nhịp.
X-quang ngực thẳng ghi nhận: sung huyết 2 phế trường, tràn dịch màng phổi 2 bên (P) > (T), không hình ảnh tổn thương nhu mô hoặc mô kẽ phổi, không hình ảnh gợi ý u trong lồng ngực.
Bệnh nhân được khảo sát siêu âm tim 2D, siêu âm tim Doppler mô (TDI) và Speckle Tracking:
Hình 1. Siêu âm tim
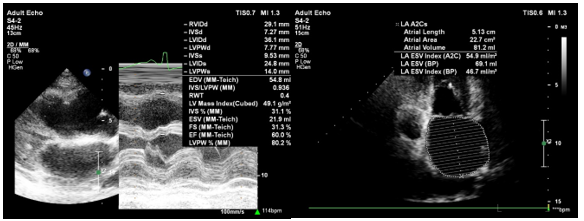
Trên siêu âm tim 2D và TM ghi nhận:
- Giãn lớn nhĩ trái và nhĩ phải
- Chức năng tâm thu thất trái bình thường EF = 60% (Teicholz), EF = 62% (Simpson)
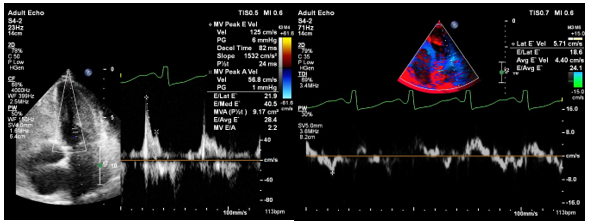
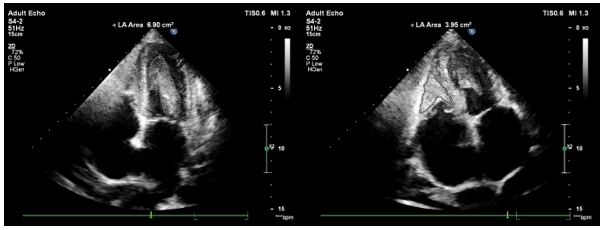
- Rối loạn chức năng tâm trương thất trái độ III (theo ASE 2016) với: E/A = 2,2; DT = 82 ms; Average E/E’ = 24,1; LA ESV Index (A4C) = 46,7 mL/m2.
- Chức năng co bóp thất (P) giảm: TAPSE = 7mm; RV S’ = 8,5 cm/s; RV FAC = 28%; RV MPI = 0,58.
Đồng thời, chúng tôi ghi nhận có hình ảnh huyết khối cả 2 buồng thất:
- Huyết khối thất trái: bám vào vùng mỏm, thành dưới và thành bên thất trái, chiếm ½ thể tích buồng thất trái.
- Huyết khối vùng mỏm và thành bên thất phải lan đến lá trước van 3 lá làm bất động lá van này, gây hở van 3 lá mức độ trung bình.
Hình 2. Huyết khối trong buồng tim
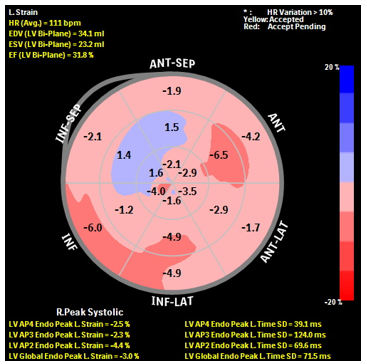
Siêu âm đánh dấu mô cơ tim ghi nhận: hình ảnh tổn thương cơ tim tập trung tại khu vực vùng mỏm, thành dưới và thành bên thất trái, có hiện tượng giảm tốc độ mở xoắn của mô cơ tim.
Hình 3. Siêu âm đánh dấu mô cơ tim (Speckle Tracking)
Bệnh nhân được chọc dò dịch màng phổi giải áp và xét nghiệm. Kết quả phân tích dịch màng phổi ghi nhận: dịch tiết (theo tiêu chuẩn Light), tế bào dịch 368/mm3 trong đó eosinophil chiếm 3%, lymphocyte ưu thế 86%.
Các xét nghiệm khác:
- Phết máu ngoại biên: tăng eosinophil, không hình ảnh blast.
- Tủy đồ: hình ảnh tăng sinh eosinophil, không hình ảnh blast.
- Huyết thanh chẩn đoán ký sinh trùng: Toxocara canis (-), Toxoplasma gondii (-), Cysticercus cellulosae (-), Strongyloides stercoralis (-), Gnathostoma spinigerum (-), Echinococcus granulosus (-), Schistosomiasis (-).
- Soi phân tìm ký sinh trùng đường ruột (-)
- AFB đàm 2 mẫu (-).
Tại thời điểm này, chúng tôi khảo sát hình ảnh viêm cơ tim bằng chụp cộng hưởng từ tim có gadolinium (MRI tim có cản từ) nhưng máy MRI tim của bệnh viện Chợ Rẫy đang được bảo trì nên bệnh nhân chưa được khảo sát MRI tim.
Chẩn đoán: Bệnh cơ tim hạn chế nghi do thâm nhiễm eosinophil – huyết khối 2 buồng thất – tràn dịch màng phổi 2 bên.
Điều trị:
- Bệnh nhân được điều trị giảm triệu chứng sung huyết bằng lợi tiểu: Furosemide 80mg/ngày phối hợp với Spironolactone 50mg/ngày.
- Điều trị chống huyết khối: Enoxaparin 40 mg x 2 (tiêm dưới da) phối hợp Acenocoumarol 1 mg/ngày. Đến ngày 4 và 5: INR = 2.5, ngưng Enoxaparin, duy trì Acenocoumarol 1 mg/ngày.
- Điều trị kháng viêm, chống tổn thương cơ tim: corticosteroid 1mg/kg/ngày. Điều trị hỗ trợ với ức chế bơm proton ngừa loét dạ dày và bổ sung canxi đường uống.
Kết quả: sau 3 ngày, bệnh nhân giảm khó thở còn 2/10, tiểu # 2.000 mL/ngày, ngủ tốt, giảm phù chân, khả năng gắng sức tăng.
Đến ngày 4 và 5: INR = 2.5, ngưng Enoxaparin, duy trì Acenocoumarol 1 mg/ngày.
Bệnh nhân được xét nghiệm công thức máu mỗi tuần . Kết quả:
Bảng 3. Công thức máu
| Thành phần | Ngày 30/6 | Ngày 8/7 | Ngày 15/7 |
| WBC (G/L) | 22,44 | 23,85 | 15,3 |
| %NEU | 34,7 | 86,4 | 62,1 |
| NEU (G/L) | 7,78 | 20,61 | 9.48 |
| %LYM | 16,3 | 7,4 | 1,8 |
| LYM (G/L) | 3,65 | 1,78 | 0,27 |
| %EOS | 43,1 | 0,1 | 0 |
| EOS (G/L) | 9,68 | 0,03 | 0,01 |
| PLT (G/L) | 86 | 221 | 256 |
Bệnh nhân được xuất viện sau 2 tuần điều trị với tình trạng lâm sàng ổn định, tiếp tục điều trị ngoại trú với corticosteroid giảm dần liều mỗi 2 tuần, duy trì kháng đông giữ INR = 2.0 – 3.0.
BÀN LUẬN
Eosinophil là một loại tế bào chứa nhiều hạt, có vai trò quan trọng trong đáp ứng miễn dịch với nhiễm trùng hoặc viêm. Trong điều kiện bình thường, eosinophil không hiện diện trong các cơ quan ngoại trừ tuyến ức, hạch lympho, lách, ống tiêu hóa và tử cung. (8) Số lượng eosinophil máu ngoại biên bình thường ≤ 350/mm3 với cả người lớn và trẻ em. Khi số lượng eosinophil tăng 500 – 1.500/mm3 được gọi là tăng nhẹ, 1.500 – 5.000/mm3 là tăng trung bình và > 5.000/mm3 gọi là tăng nặng.(7)
Hội chứng tăng eosinophil là một nhóm bệnh lý do sự tăng sản xuất quá mức và kéo dài của bạch cầu ái toan. Bạch cầu ái toan sẽ thâm nhiễm vào các cơ quan trong cơ thể, phóng thích ra các hóa chất trung gian gây tổn thương hàng loạt các cơ quan.(7)(8)
Hội nghị đồng thuận về tăng eosinophil máu năm 2012 tại Áo đã phân biệt 2 thuật ngữ mô tả tình trạng tăng eosinophil:(9)
- Tăng eosinophil (Hypereosinophilia – HE): eosinophil máu ngoại biên > 1,5 x 109/L hoặc > 1.500 eosinophil/µL qua 2 lần xét nghiệm cách nhau ít nhất 1 tháng hoặc có tăng eosinophil tại mô (trong tủy xương hoặc hiện diện các protein hạt eosinophil tại mô).
- Hội chứng tăng eosinophil (Hypereosinophilic syndrome – HES): khi có tăng eosinophil (theo tiêu chuẩn trên) VÀ tổn thương/rối loạn chức năng cơ quan do thâm nhiễm eosinophil sau khi đã loại trừ các nguyên nhân khác gây tổn thương cơ quan.
Hội chứng tăng eosinophil là một bệnh cảnh hiếm gặp. Theo nghiên cứu Surveillance, Epidemiology and End Results (SEER), suất độ của hội chứng HES vào khoảng 0,035/100.000 bệnh nhân. Độ tuổi trung bình khởi phát bệnh vào khoảng 52,5 tuổi với tỉ lệ nam:nữ là 1:1,47. Mặc dù đã bắt đầu được chú ý đến và có những tiến bộ trong điều trị, tiên lượng của bệnh nhân với hội chứng HES vẫn còn xấu: 20% bệnh nhân tử vong sau 5 năm và 60% tử vong sau 10 – 15 năm kể từ khi được chẩn đoán.(2)(8)
Eosinophil xuất nguồn từ các tiền tủy bào trong tủy xương dưới sự tác động của 3 cytokine kích thích tạo máu: granulocyte macrophage colony-stimulating factor (GM-CSF), interleukin-3 (IL-3) và interleukin-5 (IL-5). Trong đó, chỉ có IL-5 tác động chuyên biệt lên quá trình biệt hóa của eosinophil. Có 2 cơ chế gây ra sự sản xuất quá mức eosinophil vượt kiểm soát, gây ra hội chứng HES:(1)(7)
- Khiếm khuyết của các tế bào tạo máu đầu dòng và/hoặc bất thường dẫn truyền tín hiệu thụ thể trong quá trình sản sinh eosinophil.
- Sản xuất quá mức các cytokine kích thích tạo máu như IL-5.
Viêm cơ tim do thâm nhiễm eosinophil là bệnh cảnh lâm sàng chính và gây tử vong hàng đầu cho những bệnh nhân mắc hội chứng HES. Tổn thương tim đặc hiệu nhất trong HES là tình trạng xơ hóa nội mạc cơ tim, được Wilhelm Loeffler mô tả lần đầu tiên vào năm 1936 nên bệnh cảnh này còn được gọi là “viêm nội tâm mạc Loeffler (Loeffler endocarditis)”.(5)
Tiến trình tổn thương cơ tim do thâm nhiễm eosinophil trải qua 3 giai đoạn:(7)(8)
1/ Giai đoạn 1: hoại tử cấp tính.
Các eosinophil và lympho bào tẩm nhuận vào cơ tim, phóng thích các hạt trong eosinophil chức những phân tử protein độc cho tế bào cơ tim. Quá trình hoại tử cơ tim và tăng chết tế bào theo chương trình (apoptosis) khởi nguồn từ đây. Các vi huyết khối có thể tạo lập tại lớp nội tâm mạc. Trong giai đoạn này, thường bệnh nhân không có triệu chứng, một số có thể biểu hiện xuất huyết kết mạc hoặc xuất huyết dưới móng. Một số trường hợp rất hiếm tiến triển đến viêm cơ tim bạo phát (fulminant myocarditis) dẫn đến tử vong nhanh chóng trước khi bệnh được chẩn đoán và điều trị.
2/ Giai đoạn 2: tạo lập huyết khối.
Khi lớp nội tâm mạc bị tổn thương do độc chất từ eosinophil tạo ra, các thành phần của nội tâm mạc như yếu tố Von Willebrand và collagen sẽ được phơi bày, gắn kết với tiểu cầu và yếu tố mô, hình thành huyết khối tại vùng cơ tim bị tổn thương. Trong HES, huyết khối hình thành ở cả 2 buồng thất, tập trung chủ yếu tại vùng mỏm tim, thành dưới-bên thất trái và có thể lan đến bộ máy van tim và khu vực buồng tống trong những trường hợp bệnh nhân đến trễ.
3/ Giai đoạn 3: xơ hóa cơ tim.
Tổ chức xơ hình thành do sự kích hoạt các nguyên bào sợi tại lớp nội tâm mạc thứ phát sau quá trình viêm và tổn thương nội mạc kéo dài, hình thành nên các dải xơ thay thế cho lớp nội tâm mạc và cơ tim sát nội tâm mạc, dẫn đến sẹo hóa cơ tim, suy giảm khả năng thư giãn của cơ tim. Khi này, bệnh cơ tim hạn chế bắt đầu xuất hiện. Bệnh nhân có triệu chứng sung huyết rõ ở cả tim trái và tim phải. Huyết khối và tổ chức xơ có thể ảnh hưởng đến van nhĩ thất, gây ra hở van.
Nguyên nhân của HES được chia thành 3 nhóm:(5)(8)
- HES nguyên phát: do u tân sinh của các tế bào máu đầu dòng.
- HES thứ phát: do sản xuất quá nhiều cytokine kích thích tạo eosinophil trong tủy như nhiễm ký sinh trùng, lymphoma tế bào T.
- HES vô căn: khi không tìm được nguyên nhân.
Bệnh nhân của chúng tôi có số lượng eosinophil trong máu ngoại biên là 9,68 x 109/L kèm theo tăng eosinophil trong tủy xương (qua kết quả tủy đồ) và trong dịch màng phổi (phân tích dịch màng phổi). Song song đó, bệnh nhân có tổn thương cơ tim (tăng troponin I và NT-proBNP), rối loạn chức năng 2 thất nên bệnh nhân có bệnh cảnh điển hình của hội chứng HES. Về nguyên nhân của HES: do tủy đồ không ghi nhận hình ảnh tế bào ác tính trong tủy, các xét nghiệm miễn dịch tầm soát ký sinh trùng và soi phân tìm ký sinh trùng đều âm tính, lâm sàng và hình ảnh học không phát hiện hạch to, nồng độ beta-2 microglobulin không tăng nên chúng tôi loại trừ HES nguyên phát và thứ phát trên bệnh nhân này mà hướng đến HES vô căn.
Bệnh nhân có triệu chứng lâm sàng gợi ý suy tim trái (khó thở diễn tiến phù hợp với suy tim, tăng NT-proBNP). Kết quả xét nghiệm cho thấy troponin I và NT-proBNP đều tăng, gợi ý cơ tim đã có tổn thương. Kết quả siêu âm tim cho thấy có rối loạn chức năng tâm trương thất trái độ III (theo ASE 2016) với: E/A = 2,2; DT = 82 ms; Average E/E’ = 24,1; LA ESV Index (A4C) = 46,7 mL/m2 và chức năng tâm thu thất trái bình thường EF = 62% (Simpson) nên chúng tôi kết luận bệnh nhân có suy tim tâm trương thất trái. Khảo sát dòng chảy qua van 2 lá (mitral inflow) ghi nhận tỉ lệ E/A > 2 và thời gian giảm tốc DT < 150 ms chứng tỏ bệnh nhân đã ở giai đoạn rối loạn chức năng tâm trương nặng kiểu hạn chế và không khả năng hồi phục. Qua khảo sát Speckle Tracking, chúng tôi ghi nhận có tổn thương cơ tim tại khu vực vùng mỏm và vùng đáy-bên thất trái. Đây là các khu vực cơ tim dễ bị tổn thương nhất theo y văn ghi nhận.(7)(8). Vì vậy, chúng tôi nghĩ bệnh nhân đã có tổn thương cơ tim do HES gây rối loạn nặng chức năng tâm trương thất trái. Tuy nhiên, để chẩn đoán chính xác viêm cơ tim cần có bằng chứng mô học của cơ tim bị viêm theo hôi nghị đồng thuận ESC và ACC/AHA (qua sinh thiết cơ tim), hoặc hình ảnh phù nề, thiếu máu cục bộ, xơ hóa, bắt thuốc cản từ muộn trên MRI tim (tiêu chuẩn Lake Louis).(4)
Ngoài ra, chúng tôi ghi nhận có huyết khối trong buồng tim tại vùng mỏm và khu vực dưới-bên của thất trái (phù hợp với hình ảnh tổn thương khảo sát được trên Speckle Tracking), vùng mỏm thất phải. Hơn nữa, huyết khối tại thất phải lan đến van 3 lá gây rối loạn chức năng van (hở van 3 lá mức độ trung bình). Tỉ lệ huyết khối buồng tim trong HES dao động từ 4 – 29% tùy theo nghiên cứu thống kê và 10% bệnh nhân HES tử vong trong bệnh cảnh huyết khối thuyên tắc. Các tính chất về huyết khối trong buồng tim của bệnh nhân hoàn toàn phù hợp với huyết khối buồng tim của những trường hợp bệnh cơ tim thâm nhiễm eosinophil ghi nhận được trong y văn.(7)(8) Chính huyết khối chiếm ½ thể tích buồng thất trái và tổn thương cơ tim do tẩm nhuận eosinophil gây bệnh cơ tim hạn chế đã gây ra bệnh cảnh suy tim sung huyết trên bệnh nhân này. Chúng tôi đã lên kế hoạch khảo sát cơ tim của bệnh nhân bằng MRI nhưng rất tiếc do nguyên nhân khách quan nên MRI tim chưa thực hiện được.
Sinh thiết cơ tim là tiêu chuẩn vàng để chẩn đoán xác định bệnh cơ tim do thâm nhiễm eosinophil(5)(8). Tuy nhiên, tại bệnh viện Chợ Rẫy hiện chưa triển khai kỹ thuật sinh thiết cơ tim nên chúng tôi thiếu dữ liệu vàng để chẩn đoán xác định cho bệnh nhân này.
Về điều trị: hiện nay điều trị chủ yếu của nhóm bệnh cơ tim hạn chế là điều trị triệu chứng sung huyết bằng hạn chế muối trong khẩu phần ăn kết hợp với thuốc lợi tiểu và điều trị nguyên nhân nếu có thể. Chúng tôi đã áp dụng chế độ ăn giảm muối, sử dụng lợi tiểu để giảm triệu chứng phù và khó thở cho bệnh nhân này.
Điều trị chuyên biệt cho tình trạng tổn thương cơ tim trong HES là kháng viêm bằng corticosteroid. Corticoid ức chế sự sản sinh eosinophil, ức chế sự thâm nhập và phóng hạt của eosinophil trong mô cơ tim. Một nghiên cứu tiến hành trên 188 bệnh nhân HES được điều trị với corticoid cho thấy tỉ lệ thoái lui bệnh là 85% sau 1 tháng điều trị. Những trường hợp có đột biến gen FIP1L1-PDGFRA sẽ được điều trị phối hợp corticosteroid và imatinib (nhóm ức chế tyrosine kinase). Một nghiên cứu khác thực hiện trên 164 bệnh nhân HES không có đột biến gen FIP1L1-PDGFRA, 90% bệnh nhân đáp ứng với corticoid với tiêu chuẩn đáp ứng điều trị là số lượng eosinophil < 1.000/µL và hết triệu chứng lâm sàng.(6)
Bệnh nhân của chúng tôi tuy chưa đủ tiêu chuẩn vàng để kết luận bệnh cơ tim thâm nhiễm eosinophil (sinh thiết cơ tim) nhưng do bệnh cảnh lâm sàng phù hợp, đã có bằng chứng của tăng eosinophil máu và các xét nghiệm về hình ảnh học phù hợp với tổn thương cơ tim do thâm nhiễm eosinophil ghi nhận trong y văn nên chúng tôi quyết định điều trị cho bệnh nhân với corticosteroid liều ức chế miễn dịch 1 mg/kg/ngày, kết hợp với điều trị hỗ trợ nhằm hạn chế biến chứng của corticosteroid liều cao gây ra. Một số tác giả khuyến cao điều trị với corticosteroid liều cao ngay khi có tăng troponin và bằng chứng tổn thương tim trên siêu âm tim.(3)(5) Hiện tại Việt Nam chưa thực hiện giải trình tự gen để tìm đột biến gen FIP1L1-PDGFRA nên chúng tôi chưa khởi trị imatinib cho bệnh nhân này.
Bệnh nhân của chúng tôi đáp ứng tốt với điều trị: các triệu chứng sung huyết giảm hơn 80% sau 3 ngày điều trị, khả năng gắng sức tăng. Số lượng eosinophil máu giảm sau 1 tuần điều trị (9,68 G/L à 0,03 G/L). Số lượng bạch cầu và neutrophil tăng nhẹ sau 1 tuần điều trị do tác dụng làm tăng bạch cầu đa nhân trong giai đoạn tấn công bằng corticoid. Đến tuần thứ 2, số lượng bạch cầu giảm, eosinophil trong máu về mức bình thường (EOS = 0,01 G/L) song song với sự cải thiện về triệu chứng lâm sàng. Bên cạnh đó, số lượng tiểu cầu giảm (PLT = 86 G/L) vào ngày nhập viện có thể do tình trạng ức chế tủy vì eosinophil trong tủy tăng sinh. Điều này được minh chứng qua số lượng tiểu cầu về mức bình thường khi số lượng eosinophil máu đã giảm sau 1 tuần điều trị corticosteroid. Số lượng bạch cầu vẫn còn cao do tác dụng phụ của corticoid gây ra, lâm sàng không ghi nhận có dấu hiệu nhiễm trùng.
Bên cạnh đó, điều trị kháng đông phải được đặt ra khi bệnh nhân này đã có huyết khối buồng tim.(8) Một phân tích tổng hợp của nhóm tác giả Ogbogu và cộng sự cho thấy: hầu hết các trường hợp tổn thương cơ tim do HES và đã có huyết khối buồng tim đều được điều trị với kháng vitamin K, duy trì INR = 2.0 – 3.0.(6) Hiện tại chưa có bằng chứng cho thấy điều trị bằng nhóm kháng đông đường uống trực tiếp (DOAC) có lợi trong điều trị chống huyết khối của những trường hợp HES.
Chúng tôi khảo sát huyết khối buồng tim trước khi cho bệnh nhân xuất viện. Tuy bệnh nhân đã cải thiện nhiều về mặt triệu chứng lâm sàng và số lượng eosinophil đã về mức bình thường, INR đã đạt ngưỡng nhưng kích thước huyết khối và chức năng tâm trương thất trái vẫn không hề thay đổi. Có lẽ cần có thêm thời gian để huyết khối buồng thất giảm kích thước. Do tổn thương cơ tim do HES của bệnh nhân đã ở giai đoạn muộn, tiến triển đến bệnh cơ tim hạn chế không hồi phục (khảo sát trên siêu âm tim) nên các thông số siêu âm đánh giá chức năng tâm trương thất trái vẫn không thay đổi sau 1 tuần điều trị. Hiện nay trên thế giới chưa có nghiên cứu đánh giá về sự thay đổi kích thước huyết khối buồng thất trong bệnh của HES nên chúng tôi chưa thể đưa ra kết luận về việc bệnh nhân này sẽ thoái triển huyết khối trong tương lai hay không.
KẾT LUẬN
Hội chứng tăng eosinophil là bệnh cảnh không thường gặp, chẩn đoán dựa vào tăng nồng độ eosinophil máu > 1,5 x 109/L và tổn thương/rối loạn chức năng cơ quan do thâm nhiễm eosinophil. Tổn thương tim do tẩm nhuận eosinophil có thể tiến triển đến bệnh cơ tim hạn chế về sau có kèm hoặc không kèm huyết khối buồng thất. Do đó, nên nghĩ đến bệnh cơ tim thâm nhiễm eosinophil trên các trường hợp có triệu chứng cơ năng, thực thể về tim và tăng eosinophil máu kéo dài hơn 6 tháng mà không có nguyên nhân giải thích được. Điều trị chủ yếu là giảm triệu chứng, kháng đông nếu đã có huyết khối buồng tim và điều trị đặc hiệu bằng corticosteroid ± imatinib (nếu có đột biến gen FIP1L1-PDGFRA).
TÀI LIỆU THAM KHẢO
- Ackerman S.J., Bochner B.S. (2007). Mechanisms of eosinophilia in the pathogenesis of hypereosinophilic disorders. Immunol Allergy Clin North Am. 2007;27(3):357.
- Crane M., Chang C.M. (2010). Incidence of myeloproliferative hypereosinophilic syndrome in the United States and an estimate of all hypereosinophilic syndrome incidence. J Allergy Clin Immunol. 2010;126(1):179.
- Hans-Uwe S., Amy K. (2012). Therapeutic Approaches to Patients with Hypereosinophilic Syndromes. Semin Hematol. 2012 April ; 49(2): 160–170.
- Hazebroek MR., Everaerts K., Heymans S. (2014). Diagnostic approach of myocarditis: strike the golden mean. Neth Heart J. (2014) 22:80–84.
- Ogbogu et al (2007). Cardiovascular Manifestations of Hypereosinophilic Syndromes. Immunol Allergy Clin North Am. 2007 August ; 27(3): 457–475.
- Ogbogu P.U. et al. (2009). Hypereosinophilic syndrome: a multicenter, retrospective analysis of clinical characteristics and response to therapy. J Allergy Clin Immunol. 2009;124(6):1319.
- Pierre-Emmanuel S. et al (2015). Eosinophilic cardiac disease: Molecular, clinical and imaging aspects. Archives of Cardiovascular Disease (2015) 108, 258—268.
- Rekha M., Crystal B. (2015). Hypereosinophilic syndrome: cardiac diagnosis and management. Heart 2015;0:1–7.
- Valent P., Klion A.D. (2012). Contemporary consensus proposal on criteria and classification of eosinophilic disorders and related syndromes. J Allergy Clin Immunol. 2012;130(3):607.








