TS. PHẠM HỮU VĂN
Phần 10: ĐIỀU TRỊ UNG THƯ VÀ NGUY CƠ ĐỘT TỬ TIM
Tóm tắt
Bệnh nhân ung thư được điều trị bằng các liệu pháp Ung thư có thể đạt đến tỷ lệ sống sót 90%, và những phụ nữ có khối u ác tính ở Vú là ví dụ điển hình cho thành công này. Các liệu pháp điều trị Ung thư có thể ở dạng hóa trị liệu cổ điển như anthracyclines, các liệu pháp nhắm mục tiêu mới như chất ức chế VEGF, Xạ trị hoặc kết hợp các phương pháp điều trị.
Tất cả những loại thuốc này, bất chấp hiệu quả của chúng trong việc ngăn chặn và / hoặc làm tổn thương các mô Ung thư, chúng thể hiện sự ảnh hưởng nặng nề đối với Hệ tim mạch dẫn đến thúc đẩy các bệnh lý khác nhau đe dọa tính mạng. Thử thách mới này diễn ra trong thời kỳ hậu ung thư được gọi là nhiễm độc tim và dẫn đến sự ra đời của ngành khoa học mới được gọi là Tim mạch-Ung thư (Cardio-Oncology).
Một trong những loại thuốc gây độc cho tim mạnh nhất là sự phát triển của chứng đột tử do tim. Bệnh lý gây tử vong này có thể xảy ra ở bất kỳ mức độ nào của liệu pháp Ung thư và có thể khiến những bệnh nhân đang điều trị tử vong.
Sự tham gia của các Bác sĩ, hoặc bác sỹ tim mạch hoặc Bác sĩ Ung thư, cần biết rõ chi tiết về tác dụng phụ của các liệu pháp điều trị Ung thư để tránh dễ dàng mất đi các bệnh nhân của mình.
Theo hiểu biết hiện nay, không có nghiên cứu nào được thực hiện trước khi đề cập đến Tử vong do đột tử tim trong quá trình điều trị ung thư và chúng tôi hy vọng các nghiên cứu trong tương lai sẽ khám phá vấn đề quan trọng này. Chúng tôi sẽ cố gắng trình bày dữ liệu từ nguồn tài liệu còn ít về Tim mạch-Ung thư học, các tài liệu cụ thể và Hướng dẫn xử lý đột tử do tim.
Kết luận: Đột tử do tim có thể là một kết quả được mong đợi khi một số loại liệu pháp được áp dụng cho bệnh nhân Ung thư dưới hình thức Hóa trị, Xạ trị hoặc cả hai và có thể dẫn đến tăng tỷ lệ mắc bệnh và tử vong.
Từ khóa: SCD đột tử do tim, tim mạch ung thư, rối loạn nhịp tim, hóa trị, xạ trị, nhiễm độc tim, bệnh cơ tim.
Các chữ viết tắt.
SCD: Sudden Cardiac Death: Đột tử tim
TdP: Torsade de Pointes: Xoắn đỉnh
5FU: 5 Fluorouracil
TLS: Tumor Lysis Syndrome: Hội chứng ly giải u.
LAA: Left Atrial Appendage: Tiểu nhĩ trái.
DVT: Deep Vein Thrombosis: huyết khối tĩnh mạch sâu.
LMWH: Low Molecular Weight Heparin: Heparin trọng lượng phân tử thấp.
ATEs: Arterial Thrombotic events: Các biến cố huyết khối động mạch.
CAD: Coronary Artery Disease: Bệnh động mạch vành.
ACS: Acute Coronary Syndrome: Hội chứng mạch vành cấp.
MI: Myocardial Infarction: Nhồi máu cơ tim.
PE: Pulmonary Embolism: tắc phổi.
AF: Atrial Fibrillation: rung nhĩ.
Mở đầu
Bệnh nhân ung thư được điều trị bằng các liệu pháp Ung thư có thể đạt đến tỷ lệ sống sót là 90%, và những phụ nữ mắc bệnh ác tính ở Vú là ví dụ điển hình cho thành công này. Các liệu pháp điều trị ung thư có thể ở dạng hóa trị cổ điển như anthracyclines, các liệu pháp nhắm mục tiêu mới như chất ức chế VEGF, Xạ trị hoặc kết hợp các phương pháp điều trị.
Việc bác sĩ điều trị và kiểm soát ung thư thành công, bệnh nhân phản hồi tốt sẽ dẫn đến tỷ lệ sống lâu hơn. Nhưng thật không may, những bệnh nhân này đang phải đối mặt với mối đe dọa nghiêm trọng đến tính mạng của họ dưới dạng các bệnh tim mạch mới hình thành và cuối cùng xuất hiện với một số biến chứng, nguy hiểm nhất là đột tử do tim (Di Francia và các đồng nghiệp 2017) xem thêm (hình. 1).
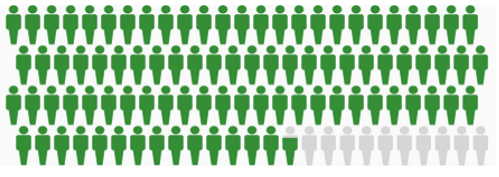
Dựa trên dữ liệu từ SEER 18 2006-2012. Hình màu xám đại diện cho những người đã chết vì ung thư vú ở nữ. Hình màu xanh lá cây đại diện cho những người đã sống sót từ 5 năm trở lên.
Hình 1. Phần trăm sống sót 5 năm từ ung thư vú = 89.7%.
Các số liệu thống kê về thời gian sống sót thường dựa trên việc nghiên cứu các nhóm lớn bệnh nhân và chúng không thể được sử dụng để dự đoán chính xác điều gì sẽ xảy ra với từng bệnh nhân. Chúng ta tin vào thực tế không có hai bệnh nhân nào hoàn toàn giống nhau ngay cả trong phản ứng điều trị. Vì những lý do này, một ngành khoa học mới đã phải được tạo ra trong lĩnh vực Tim mạch, được gọi là Khoa tim mạch – Ung thư hoặc Khoa học về tim mạch chuyên xử lý các bệnh nhân ung thư theo cách riêng trước khi bắt đầu điều trị, trong suốt thời gian điều trị bệnh nhân ung thư, và thậm chí cả thời gian dài. sau khi kết thúc các đợt điều trị cố gắng ngăn ngừa, giảm thiểu hoặc chữa khỏi các tác dụng gây độc cho tim ở những bệnh nhân yếu ớt này.
Hóa trị liệu được nghiên cứu nhiều nhất là nhóm anthracycline trong đó khoảng 2,2% bệnh nhân sử dụng các loại thuốc này phát triển các dấu hiệu và triệu chứng của suy tim (Von Hoff DD và cộng sự, năm 1979). Ngoài ra, 65% bệnh nhân có tiền sử bệnh ác tính ở trẻ em được điều trị bằng doxorubicin, là một anthracycline quan trọng và thường được sử dụng trong điều trị các bệnh Ung thư khác nhau, và có thể cho chúng ta thấy ít nhất một bức tranh siêu âm tim đầy đủ về rối loạn chức năng thất trái ở thời kỳ trưởng thành của các bệnh nhân này. (Grenier MA và Lipshultz SE 1998). Phân tích tổng hợp năm 2012 của Moja và các đồng nghiệp trên 10.000 bệnh nhân trong thử nghiệm này chỉ ra những bệnh nhân này có tỷ lệ nguy cơ (RR) đối với Suy tim sung huyết (là nguyên nhân gián tiếp gây đột tử do tim) là 5,11 [khoảng tin cậy 95% (CI) 3,00-8,72, p <0,0001] khi sử dụng trastuzumab (hóa trị liệu nhắm mục tiêu và gây độc type 2) như một phương pháp điều trị so với nhóm chứng (Moja L và cộng sự) (Ủy ban ý kiến số 606-2014).
Trong chương này, chúng tôi sẽ không đề cập đến toàn bộ chủ đề về Độc tính trên tim liên quan đến một loạt các phương pháp điều trị Ung thư và tạo ra một số lượng lớn các biến chứng, nhưng chúng tôi sẽ chỉ xem xét các liệu pháp Độc tim giúp tăng cường sự phát triển của Đột tử do tim. SCD là một biến cố khiến bệnh nhân tử vong đột ngột và ngay cả khi họ được hồi sức thành công, điều này sẽ khiến những bệnh nhân này có nguy cơ rất cao có thể tái phát đột ngột ngừng tim khi sử dụng các liệu pháp này trở lại.
Tỷ lệ mắc SCD trong số tất cả các trường hợp tử vong của bệnh nhân Ung thư là khoảng 4%, và 90% các trường hợp đột tử này là do Bệnh tim mạch vành (ESC CPG position paper 2016). Điều này cho chúng ta gợi ý các liệu pháp điều trị Ung thư đang đẩy lùi chứng thiếu máu cục bộ và xơ vữa động mạch bằng cách này hay cách khác ở một số bệnh nhân được điều trị Ung thư (tùy thuộc vào một số yếu tố).
Nói chung, khi chúng ta nói về Đột tử do tim, có nghĩa là tử vong do Rối loạn nhịp tim, trực tiếp và ngay lập tức có thể gây ra ngừng tim đột ngột, đặc biệt là khi Loạn nhịp thất được hình thành. Chúng ta sẽ đưa vào bài nói của mình những bệnh lý quan trọng “dẫn đến và kết thúc bằng” Rối loạn nhịp tim và Đột tử và do điều trị Ung thư trực tiếp hoặc gián tiếp gây ra và điều này sẽ bao gồm một loạt các bệnh lý mà chúng tôi sẽ cố gắng đề cập đến chúng nhiều nhất vì chương này cho phép và tập trung vào những điều quan trọng và thường thấy trong thực hành lâm sàng của chúng ta.
Định nghĩa về đột tử tim (SCD)
Ở đây chúng tôi sẽ đề cập đến (các) định nghĩa đã được Hội Tim mạch Châu Âu đồng ý và phê duyệt trong Hướng dẫn đã xuất bản về Rối loạn nhịp thất và đột tử do tim vào năm 2015 (Mazzanti A 2015).
Đột tử được định nghĩa là biến cố tử vong không do chấn thương và không mong muốn xảy ra trong vòng một giờ sau khi bắt đầu xuất hiện các triệu chứng ở những người khỏe mạnh. Nếu tử vong không được chứng kiến, định nghĩa áp dụng khi nạn nhân có sức khỏe tốt 24 giờ trước khi biến cố xảy ra (Mazzanti A 2015).
Thuật ngữ đột tử do tim được sử dụng khi:
- Tình trạng tim mạch mắc phải hoặc bẩm sinh, có khả năng gây tử vong đã được biết có trong suốt cuộc đời. HOẶC LÀ
- Khám nghiệm tử thi đã xác định được bất thường về Tim hoặc Mạch là nguyên nhân có thể gây ra biến cố. HOẶC LÀ
- Không có nguyên nhân rõ ràng nào khác về tim đã được xác định bằng khám nghiệm tử thi và do đó rối loạn nhịp tim có thể là nguyên nhân gây tử vong (Mazzanti A 2015).
Nguyên nhân SCD ở bệnh nhân ung thư (DI MAIO 1980) (INAGAKI 1974)
- Ung thư liên quan trực tiếp đến tim.
- Điều trị ung thư và sự phát triển của đột tử do tim.
- Các cơ chế khác không liên quan đến Ung thư.
Chúng ta sẽ đề cập cụ thể trong Chương này về SCD do điều trị Ung thư và chúng ta sẽ xem xét ngắn gọn về các nguyên nhân quan trọng khác.
Phân loại độc tính tim mạch gây SCD (DI MAIO 1980) (INAGAKI 1974) (KUFE DW)
Các phân loại khác nhau với các Nguyên tắc khác nhau, nhưng ở đây chúng tôi sẽ sử dụng các Nguyên tắc dễ dàng hơn từ tài liệu:
- Độc tính gây SCD Trực tiếp (tức là Loạn nhịp tim)
Ở đây, SCD xảy ra đột ngột trong quá trình điều trị Ung thư, nếu bệnh nhân không có triệu chứng, bác sĩ chăm sóc có thể chẩn đoán nguyên nhân tử vong do tim, trừ khi bệnh nhân được nhận thức đầy đủ về các tác dụng phụ của việc điều trị, có thể dự đoán độc tính và sẵn sàng quản lý chúng trong thời gian thích hợp. Thông thường nguyên nhân của loại này là Rối loạn nhịp thất.
- Độc tính kết thúc thành SCD (tức là CHD, Suy tim, v.v.)
Trong loại độc tính này, bệnh nhân sẽ vượt qua trước tiên do các bệnh lý khác nhau kết thúc bằng SCD, và ở đây chúng ta thường có thể mong đợi SCD và chúng ta có cơ hội thực hiện những nỗ lực cần thiết để tránh ngừng tim và chủ động chuẩn bị để xử trí khi nó xảy ra.
Hóa trị liệu và đột tử tim (SCD)
Hóa trị là phương pháp điều trị chính cho các loại Ung thư khác nhau và chúng gây ra sự phát triển của SCD bằng cách gây ra các tình trạng bệnh lý chính sau đây (bài báo trường hợp của ESC CPG 2016):
- Đau thắt ngực
Một dấu hiệu rất quan trọng cần được các bác sĩ chăm sóc lưu ý và như tiếng chuông cảnh báo để can thiệp cho bệnh nhân vì dấu hiệu này có thể cho thấy sự hiện diện của Bệnh tim thiếu máu cục bộ, xuất hiện ngay từ đầu hoặc do điều trị Ung thư gây ra. Dấu hiệu quan trọng này có thể cảnh báo chúng ta để đưa ra các biện pháp phòng ngừa SCD cần thiết vào thời điểm thích hợp.
- Cấp tính
Hội chứng mạch vành cấp (MI) Điều này có thể gây ra do hóa trị liệu khi bắt đầu điều trị Ung thư hoặc chậm trễ một thời gian dưới dạng xơ vữa động mạch vành tiến triển hoặc các cơ chế khác. Hướng dẫn đầy đủ quản lý Hội chứng mạch vành cấp nên được áp dụng. Đột tử do tim, như chúng ta đều biết, là một kết quả được dự kiến của Nhồi máu cơ tim.
- Suy tim ứu huyết
Đây là kết quả cuối cùng điển hình cho hầu hết các phương pháp điều trị Ung thư. Điều trị thích hợp cần được thực hiện theo Hướng dẫn Quản lý và Điều trị Suy tim Cấp tính và mãn tính (Hướng dẫn ESC 2012, 2016).
- Huyết khối và thuyên tắc phổi
Điều trị ung thư có thể làm suy giảm trạng thái đông máu đã có sẵn (do chính bệnh Ung thư gây ra) hoặc bắt đầu nó từ từ dẫn đến các trạng thái huyết khối khác nhau và có thể dẫn đến Thuyên tắc phổi và cuối cùng là đột tử do tim. Chẩn đoán và điều trị hiệu quả và kịp thời được khuyến cáo trong tình trạng này
- Loạn nhịp tim Khác nhau
Loạn nhịp tim Có thể được bắt đầu bằng một số liệu pháp điều trị Ung thư trực tiếp hoặc thông qua những thay đổi bệnh lý nhất định dẫn đến rối loạn nhịp tim. Đây là một trong những nguyên nhân nặng nề nhất dẫn đến tử vong đột ngột và nhanh chóng. Cần có nhận thức đúng đắn và cần đồi hỏi quản lý đúng. Nội dung chi tiết của các điều kiện trên sẽ được giải thích chi tiết hơn bên dưới.
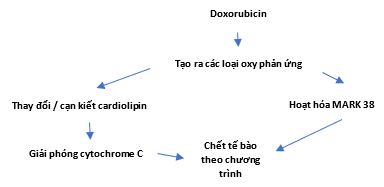
Hình 2. Cơ chế đáp ứng tế bào đối với chết theo chương trình được tăng lên ở tế bào tim do doxorubicin theo Curr. Cardiol. Rev. 2011 Nov; 7(4): 214-220.
Các thuốc chính được sử dụng để điều trị ung thư và gây ra đột tử tim
Anthracyclines
Anthracyclines: (bài báo trường hợp của ESC CPG 2016) (Cardinal D 2016) (Rabkin SW1987) (Yeh ET 2004) (Volkova M 2011).
Anthracycline là hóa trị liệu được sử dụng kinh điển, độc tính của chúng phụ thuộc vào liều lượng, và các ví dụ của nhóm này là doxorubicin, daunorubicin, idarubicin, Epirubicin. Độc tính của chúng được gọi là độc tính type I và thường không thể phục hồi. 1% bệnh nhân dùng Doxorubicin được báo cáo là bị đột tử do tim. Ngoài ra, 30% bệnh nhân dùng doxorubicin được báo cáo là phát triển các thay đổi Điện tâm đồ (ECG) và các bất thường về Nhịp.
Mitoxantrone và mitomycine là những ví dụ khác về nhóm thuốc quan trọng này. Tỷ lệ độc tính của nhóm thuốc này dao động từ 0,2% -30% tùy thuộc vào loại thuốc và chế độ sử dụng.
Đặc biệt, tim dễ bị tổn thương do anthracycline gây ra, một phần là do ái lực cao của anthracyclines đối với Cardiolipin (Hình 2). Cardiolipin là một phospholipid ty thể duy nhất tham gia vào các giai đoạn khác nhau của động lực học màng ty thể và quá trình chết có chương trình của ty thể. Trong giai đoạn đầu của quá trình chết có chương trình, dường như phối hợp với kích thích thụ thể chết và tạo ra các loại oxy phản ứng (reactive oxygen species: ROS), Cardiolipin có thể bị peroxy hóa. Quá trình peroxy hóa của Cardiolipin có thể cản trở sự định vị sắt heme của cytochrome C và gây ra sự giải phóng nó, cũng như giải phóng thêm các yếu tố gây chết từ ty thể. Mặc dù dường như quá trình peroxy hóa của Cardiolipin đóng một vai trò quan trọng trong việc giải phóng cytochrom C từ màng trong ty thể, bản thân cytochrom C có thể xúc tác quá trình peroxy hóa Cardiolipin. Vai trò tế bào của Cardiolipin có nhiều mặt và cần phải điều tra thêm về sự đóng góp của nó vào quá trình chết theo chương trình (Danielle Harake 2012).
Một trong những cơ chế của SCD khi điều trị bằng anthracyclines, là nó có thể gây ra rối loạn tâm thu thất trái nghiêm trọng (Hình 4) và suy tim có thể tiến triển và kết thúc là đột tử do tim. Rối loạn chức năng thất trái này có thể do cảm ứng của stress oxy hóa và giải phóng gốc tự do, gây ra tổn thương trực tiếp cho các tế bào cơ tim (Hình 3). Các gợi ý khác là xơ hóa khu trú, tăng căng thành và bong ra khỏi tế bào cơ tim kết thúc thành bệnh cơ tim giãn.
Anthracycline có hiệu quả để điều trị khối u rắn và khối u ác tính huyết học. Nếu tránh, chúng sẽ tác động tiêu cực đến tiên lượng của những bệnh nhân ung thư này. Chúng nên được tiếp tục, nhưng với sự theo dõi thích hợp bằng nỗ lực chung của Bác sĩ Tim mạch và Bác sĩ Ung thư và có thể cần sự hỗ trợ của Bác sĩ Huyết học và Bác sĩ Thận (ngày nay gọi là Phòng khám Tim mạch-Ung thư Lý tưởng) (Danielle Harake 2012).
Giai đoạn cấp tính của ngộ độc do anthracycline thường liên quan đến Loạn nhịp tim trên thất. Độc tính ở giai đoạn muộn sẽ đưa bệnh nhân vào Rối loạn thất trái và Suy tim và cả hai tình trạng (cấp tính và muộn) đều là nền cơ bản cho Đột tử do tim.
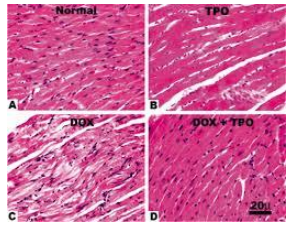
Hình 3. Anthracyclines làm thay đổi tổ chức bệnh học trong tim bị nhiễm độc.
- Cyclophosphamides (Bài báo trường hợp của ESC CPG 2016)
Độc tính trên tim của cyclophosphamide bắt đầu chủ yếu với liều cao của thuốc (> 140 mg / kg) với độc tính rõ ràng không tích lũy, hoặc khi truyền tĩnh mạch nhanh, và có thể gây ra Loạn nhịp thất, Bệnh cơ tim với Viêm cơ tim xuất huyết và Tràn dịch màng tim và kết thúc bằng đột tử tim. Tỷ lệ nhiễm độc tim dao động từ 7% -28%. Cơ chế chính xác của độc tính trên tim do cyclophosphamide vẫn chưa được biết rõ. Các giả định được gợi ý là các chất chuyển hóa Cyclophosphamide gây ra stress oxy hóa và tổn thương trực tiếp mao mạch nội mô dẫn đến sự thoát mạch của protein, hồng cầu và các chất chuyển hóa độc hại (Hình 5) (Sumandeep 2013). Sự phá vỡ các tế bào nội mô khi có các chất chuyển hóa độc hại gây tổn thương trực tiếp đến cơ tim và các mạch máu mao mạch, dẫn đến phù nề, xuất huyết kẽ và hình thành các vi huyết khối. Các tổn thương này biểu hiện lâm sàng như triệu chứng Suy tim cấp và Rối loạn nhịp tim. Hai bệnh lý sau là nguyên nhân đã được biết rõ của đột tử do tim.
Nhìn chung Độc tính trên tim là không phổ biến nhưng có thể xảy ra bất cứ lúc nào, đặc biệt là nếu bệnh nhân đã được điều trị bằng anthracyclines trước đó hoặc đã trải qua liệu pháp Xạ trị, và ở đây các tác dụng phụ nên được bác sĩ điều trị dự kiến trước và chuẩn bị xử trí đúng cách (Hình 5).
Bằng Siêu âm tim, chúng ta có thể nhận thấy các mức độ thay đổi khác nhau, nhưng ở dạng nặng, chúng ta có thể thấy cơ tim dày lên nghiêm trọng, tràn dịch màng ngoài tim đáng kể, và bằng chứng chèn ép với sự đè sụp tâm trương thất phải và sự thay đổi rõ rệt của dòng chảy thất phải trong quá trình hô hấp (Hình 5) (Sumandeep 2013).
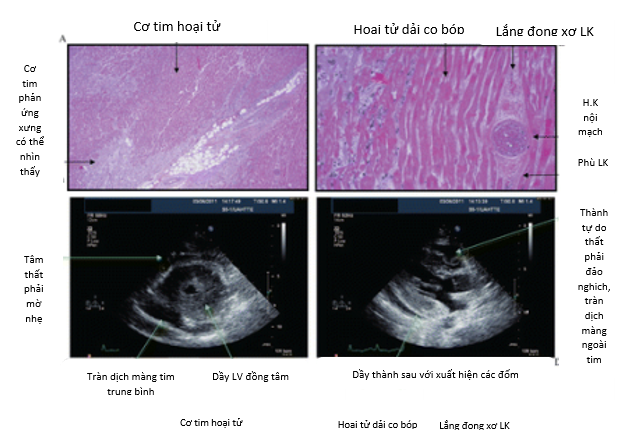
Hình 5. Các biểu hiện bệnh học và siêu âm tim của nhiễm độc tim do cyclophosphamide gây ra.
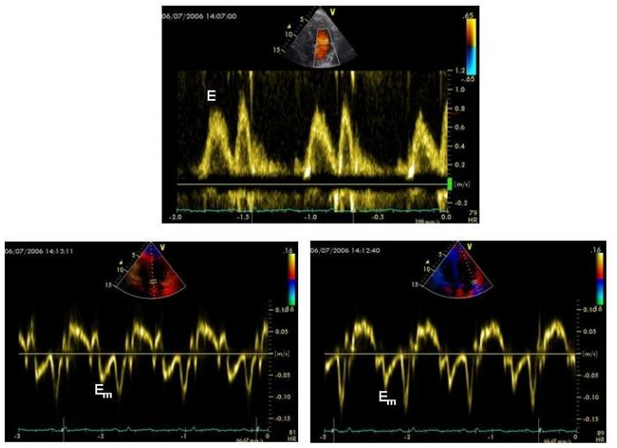
Hình 4. Các thay đổi Doppler và Doppler mô trong nhiễm độc anthracycline của tim.
Cyclophosphamide như một hóa trị liệu được sử dụng để điều trị ung thư hạch, đa u tủy, bệnh bạch cầu, ung thư buồng trứng, ung thư vú, ung thư phổi tế bào nhỏ, ung thư bàng quang, rối loạn tăng sinh tủy và sarcoma.
- Fluoropyrimidines
Các thuốc này được sử dụng phổ biến Antimetabolites trong điều trị ung thư. Ví dụ điển hình là 5 fluorouracil (5FU) và capecitabine dạng uống.
Độc tính trên tim thường xảy ra khi khởi đầu sớm (trong vòng 2-5 ngày kể từ khi bắt đầu điều trị) và với liều cao 600-1000 mg / m2 / ngày, nhưng bất kỳ liều nào cũng có thể gây ra độc tính này.
Những loại thuốc này thường được sử dụng trong điều trị các bệnh ung thư đường ruột (ung thư ruột kết tiến triển, ung thư hậu môn, ung thư tuyến tụy và ung thư gan-mật).
Chúng chủ yếu gây ra co thắt mạch máu của các mạch vành, ngay cả ở những bệnh nhân không thiếu máu cục bộ và kết thúc bằng đau thắt ngực, thiếu máu cục bộ, hội chứng mạch vành cấp, sốc tim và đột tử do tim (Shoemaker 2004).
Tần suất các biến cố tim mạch gồm cả Hội chứng mạch vành cấp là 7,6%, với tỷ lệ tử vong là 2,2% khi truyền 5FU liên tục. Tổng tỷ lệ nhiễm độc có thể lên đến 20%. Căn nguyên chưa được biết nhưng có thể do Tổn thương nội mô và co thắt mạch, các gợi ý khác là Huyết khối Động mạch vành hoặc Viêm động mạch thứ phát do tiếp xúc với thuốc. Thách thức chính ở những bệnh nhân này là khoảng 7% bị Thiếu máu cục bộ im lặng và Đột tử do tim có thể diễn ra khi không có bất kỳ dấu hiệu hoặc triệu chứng nào.
Thông thường có một cơn đau thắt ngực điển hình và thay đổi điện tâm đồ (68% bệnh nhân) khi nghỉ ngơi và ít hơn khi gắng sức (Shoemaker 2004).
Việc bệnh nhân tử vong khi họ đang điều trị bằng các thuốc này không phải là điều bất thường do thiếu máu cục bộ tạo ra, và không phải hiếm khi điều này được cho là do nhầm lẫn dẫn đến tử vong do ung thư, đặc biệt ở những bệnh nhân không có tiền sử Bệnh tim mạch vành. Nếu Bệnh nhân có tiền sử Bệnh mạch vành hoặc các yếu tố nguy cơ được ghi nhận đầy đủ, bệnh nhân nên được đánh giá và quản lý tốt trước khi điều trị bằng loại thuốc chống ung thư này
- Cytokines và Monoclonal Antibodies
Interleukin-2 và interferon-alpha là ví dụ về Cytokine và chất ức chế VSP là ví dụ về kháng thể đơn dòng. Chúng gây ra đột tử do tim bằng cách gây hạ huyết áp nghiêm trọng và rối loạn nhịp tim. Tăng nguy cơ biến cố huyết khối động mạch (ATEs) có liên quan đến việc sử dụng bevacizumab và ramucirumab (Abdel-Qadir 2017). Huyết khối tĩnh mạch (tất cả các mức độ: 8%; mức 3/4: 5% đến 7%) và Huyết khối động mạch (toàn bộ các mức độ: 6%; mức 3/4: 3%). Trong một phân tích gộp 1.745 bệnh nhân, trong đó 963 người được điều trị bằng bevacizumab (24% ung thư vú), tỷ lệ biến cố huyết khối tắc mạch là 4% ở những bệnh nhân được điều trị bằng bevacizumab cùng với hóa trị và 2% ở những người được điều trị bằng hóa trị liệu đơn thuần. Bệnh huyết khối động mạch do Ramucirumab (bao gồm Nhồi máu cơ tim, Ngưng tim, Tai biến mạch máu não và Thiếu máu não) được thấy ở 2% bệnh nhân ung thư (Abdel-Qadir 2017).
Về mặt bệnh lý, người ta nhận thấy chúng gây ra Rối loạn nội mô và Tổn thương. Huyết khối động mạch bao gồm cả các mạch vành là một loại cơ chế khiến những bệnh nhân này phát triển hội chứng mạch vành cấp tính và đột tử do tim (bài báo về trường hợp của ESC CPG 2016).
- Chất ức chế trùng hợp các vi cấu trúc hình ống.
Paclitaxel được sử dụng như một phương pháp hóa trị có thể liên quan đến Thiếu máu cơ tim và phát triển Nhồi máu cơ tim và Đột tử do Tim. Biểu hiện của Thiếu máu cơ tim này được báo cáo ở 5% bệnh nhân sử dụng thuốc này (Ý kiến của ủy ban số 606-2014). Bên cạnh việc khởi phát Thiếu máu cục bộ cơ tim, Paclitaxel có thể gây ra Loạn nhịp thất, Nhịp tim chậm và block A-V ở các mức độ khác nhau. Sự kết hợp giữa doxorubicin và Paclitaxel có thể dẫn đến kết quả rất cao về độc tính trên tim và nên tránh kết hợp càng nhiều càng tốt.
- Các liệu pháp điều trị ung thư mới
Các liệu pháp miễn dịch mới như Thuốc ức chế điểm kiểm tra miễn dịch như CTLA4, PD1, chất ức chế PD-L1 được sử dụng trong điều trị các khối u có khả năng kháng thuốc cao như u ác tính di căn và có thể gây ra Bệnh cơ tim giãn tự miễn dịch và phát triển đột tử do tim.
Ngoài ra, liệu pháp loại bỏ Androgen là một loại phương pháp điều trị Ung thư khác gây ra sự tăng tốc của xơ vữa động mạch, bắt đầu Kháng insulin, Béo phì, Hội chứng chuyển hóa, MI và Đột tử do tim. Những tác dụng phụ này là do sự ức chế Androgen
- Xạ trị và đột tử tim
Chiếu xạ vào tim với liều lượng đủ cao có thể làm hỏng bất kỳ thành phần nào của tim, bao gồm màng ngoài tim, cơ tim, van tim, động mạch vành, mao mạch và hệ thống dẫn truyền. Ví dụ, viêm màng ngoài tim cấp tính có thể diễn ra nhanh chóng trong quá trình Xạ trị vào ngực. Điều này có thể dẫn đến Tràn dịch màng ngoài tim, chèn ép và xơ hóa màng ngoài tim (được xem như những thay đổi trên Siêu âm tim) và dẫn đến tổn thương huyết động có thể gây ra đột tử do tim.
Ngoài ra Xạ trị trực tiếp đến tim có thể dẫn đến các bất thường dẫn truyền khác nhau, thay đổi sóng T và loạn nhịp tim (được xem như thay đổi điện tâm đồ).
Xạ trị có thể dẫn đến xơ cứng gia tăng với Viêm nội mạc động mạch vành, xơ hóa lớp trung gian, tăng sinh khởi đầu kết thúc bằng hội chứng mạch vành cấp và đột tử do tim. Xạ trị được áp dụng cho vùng tim trong quá trình điều trị ung thư có thể đẩy nhanh quá trình xơ vữa động mạch và gây biến chứng do vỡ mảng bám, huyết khối hoặc co thắt mạch vành. Các lỗ của các mạch vành chủ yếu bị ảnh hưởng và dẫn đến các biến chứng đe dọa tính mạng. Động mạch xuống trước trái là động mạch bị ảnh hưởng chủ yếu. Các trình tự của bức xạ tim có thể nhanh chóng và kết thúc trong Hội chứng mạch vành cấp tính và đột tử do tim, nhưng có thể tiến triển trong nhiều năm sau khi điều trị. Phụ nữ có khối u ác tính ở vú trái, liều bức xạ trung bình ước tính cho tim được áp dụng là 6,6 GY (đơn vi chiếu xạ được ký hiệu Gy, là đơn vị suy ra của liều bức xạ ion hóa trong Hệ đơn vị quốc tế (SI). Gy được định nghĩa là sự hấp thụ một jun năng lượng bức xạ trên một kg vật chất.), và khối u ở vú phải là 2,9 GY, và với mỗi lần tăng 1,0 GY của bức xạ, sẽ có sự gia tăng 7,4% số lần xuất hiện biến cố mạch vành lớn sau đó. Sự kiện lớn này tăng lên trong vòng 5 năm kể từ khi tiếp xúc với bức xạ và nguy cơ tiếp tục kéo dài đến 3 thập kỷ sau khi Xạ trị. Nguy cơ cao hơn vào 10 năm đầu sau khi chẩn đoán ung thư. Điều này có nghĩa là cần có một quy trình giám sát lâu dài để ngăn chặn giai đoạn cuối của những tác dụng phụ nguy hiểm này, có thể chấm dứt trong một cơn đột tử do tim và các biến chứng khác. Cần lưu ý ở đây không có ngưỡng nào dưới ngưỡng mà xạ trị an toàn đối với tim và hệ thống mạch máu liên quan, và chiếu xạ dưới 30 GY được coi là tương đối ít gây tổn hại cho các mô tim.
Các yếu tố nguy cơ ở những bệnh nhân này cần được đánh giá rất tốt và quản lý thích hợp để tránh mọi tình huống nghiêm trọng. Chúng ta có thể phải đối mặt với một số nguy cơ còn sót lại của các tác động thứ cấp do sự hiện diện của các mô bình thường trong trường chiếu xạ vẫn còn. Điều này không may có thể ảnh hưởng đến chất lượng cuộc sống của những người sống sót sau ung thư vú, những người ngày càng tăng lên. Do đó, cần có những nghiên cứu sâu hơn để cải thiện việc phát hiện sớm các ảnh hưởng đến tim muộn ở hầu hết bệnh nhân không có triệu chứng, đồng thời cũng để cải thiện khả năng dự đoán và phòng ngừa (Schultz-Hector 1998).
Dự án BACCARAT là một cách tiếp cận mới đa ngành để phát hiện sớm tình trạng nhiễm độc tim do bức xạ dựa trên một nghiên cứu lâm sàng giai đoạn sớm. Ý nghĩa lâu dài của những thay đổi quan sát được là một vấn đề quan trọng, vào cuối 2 năm theo dõi nghiên cứu, mỗi bệnh nhân được đề xuất tham gia vào một nghiên cứu đa trung tâm lớn về theo dõi lâu dài các biến cố tim với theo dõi lâm sàng, ít nhất là 10 năm (Schultz-Hector 1998) (Clarke2005).
Một số giả thuyết được nghiên cứu trong BACCARAT (Clarke 2005), lựa chọn chỉ số tổn thương tim cận lâm sàng, phân tích có giám sát các dấu ấn sinh học được nhắm mục tiêu, phương pháp và ứng dụng lâm sàng để đo liều lượng chính xác và các hạn chế về liều có thể được tăng cường trong quá trình Xạ trị, lựa chọn mô hình và có thể dự đoán nguy cơ độc tính trên tim bằng cách kết hợp các thông số sinh học, lâm sàng và liều lượng. Phân tích tổng hợp, cho phép xác định và tóm tắt thông tin quan trọng từ các thử nghiệm ngẫu nhiên, có đối chứng khác nhau (Heit 2002) đã phân tích tỷ lệ tử vong lâu dài do bệnh tim sau khi xạ trị ung thư vú giai đoạn đầu của khoảng 300 000 phụ nữ trong Đăng ký Ung thư, Khảo sát, Dịch tế học và kết thúc Kết quả ở Hoa Kỳ (Surveillance, Epidemiology and End Results: SEER). Người ta nhận thấy đối với những phụ nữ được chẩn đoán trong giai đoạn 1973-82 và được chiếu xạ, tỷ lệ tử vong do tim (khối u bên trái so với bên phải) là 1,20 (KTC 95% 1,04-1,38) ít hơn 10 năm sau đó là 1,42 (1,11-1,82) 10-14 năm sau, và 1,58 (1,29-1,95) sau 15 năm hoặc hơn (xu hướng: 2p = 0,03), tương ứng (Roden DM 2004) đối với phụ nữ được chẩn đoán trong giai đoạn 1983-92 và được chiếu xạ, tỷ lệ tử vong do tim là 1,04 (0,91-1,18) dưới 10 năm sau đó và 1,27 (0,99-1,63) 10 năm sau đó trở lên. Đối với những phụ nữ được chẩn đoán trong giai đoạn 1993-2001 và được chiếu xạ, tỷ lệ tử vong do tim là 0,96 (0,82-1,12). Theo giải thích của các kết quả, kể từ đầu những năm 1980, những cải tiến trong lập kế hoạch Xạ trị sẽ làm giảm tỷ lệ tử vong do bệnh tim ở phụ nữ được Xạ trị.
Bức xạ cơ thể toàn phần có thể gây ra Hội chứng ly giải khối u do khối u tan rã lớn và sự thay đổi lớn trong cơ thể học và tích tụ các chất chuyển hóa, cuối cùng dẫn đến đột tử do tim. Chúng tôi sẽ nói chi tiết hơn về chủ đề quan trọng này của Hội chứng ly giải khối u ở phần khác.
(Còn nữa)
Tài liệu tham khảo
- Abdel-Qadir, H., J.L. Ethier, D.S. Lee, P. Thavendiranathan, and E. Amir. 2017. “Cardiovascular toxicity of angiogenesis inhibitors in treatment of malignancy: a systematic review and meta-analysis.” Cancer Treat. Rev. 53:120-7.
- Bovelli, D., G. Plataniotis, and F. Roila. 2010. “Cardiotoxicity of chemotherapeutic agents and radiotherapy-related heart disease: ESMO Clinical Practice Guidelines.” Ann. Oncol. 21(suppl. 5): v277-82. Braunwald, E. 1997. “Cardiac tamponade.” In: Heart disease: A textbook of cardiovascular medicine, edited by E. Braunwald, 1446-96.
- Cardinale, D., A. Colombo, G. Bacchiani, I. Tedeschi, C.A. Meroni, M. Civelli, G. Lamantia, N. Colombo, C.M. Cipolla, F. Veglia, C. Fiorentini, and G. Curigliano. 2016. “Response to letters regarding article, early detection of anthracycline cardiotoxicity and improvement with heart failure therapy.” Circulation 133(4): e363 doi: 10.1161/CIRCULATIONAHA.115.018780.
- Clarke, M., R. Collins, S. Darby, C. Davies, P. Elphinstone, V. Evans, J. Godwin, R. Gray, C. Hicks, S. James, E. MacKinnon, P. McGale, T. McHugh, R. Peto, C. Taylor, and Y. Wang. 2005. “Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials.” Lancet 366(9503):2087-106.
- Davies, M.J. 1981. “Pathological view of sudden cardiac death.” Br. Heart J. 45(1):88- 96. Dhesi, S., M.P. Chu, G. Blevins, I. Paterson, L. Larratt, G.Y. Oudit, and D.H. Kim. 2013. “Cyclophosphamide-induced Cardiomyopathy: a case report, review and recommendation for management.” J. Investig. Med. High Impact Case Rep. 1(1):2324 709613480346. doi: 10.1177/2324709613480346.
- Di Francia, R., A. De Monaco, M. Saggese, G. Iaccarino, S. Crisci, F. Frigeri, R. De Fillippi, M. Berretta, and A. Pinto. 2017. “Pharmacological profile and pharmacogenomics of anti-cancer drugs used for targeted therapy.” Curr. Cancer Drug Targets doi: 10.2174/1568009617666170208162841.
- DiMaio, S.M., V.J. DiMaio, and J.B. Kirkpatrick. 1980. “Sudden, unexpected deaths due to primary intracranial neoplasms.” Am. J. Forensic Med. Pathol. 1(1):29-45.
- Gagnon, B., I. Mancini, J. Pereira, and E. Bruera. 1998. “Palliative management of bleeding events in advanced cancer patients.” J. Palliat. Care 14(4):50-4.
- Goldberger, A.L. 2006. Clinical electrocardiography. 7th edition. Philadelphia: C.V. Mosby Co. Grant, A.O. 2009. “Cardiac ion channels.” Circ. Arrhythm. Electrophysiol. 2(2):185-94.
- Grenier, M.A., and S.E. Lipshultz. 1998. “Epidemiology of anthracycline cardiotoxicity in children and adults.” Seminars in oncology 25(4 Suppl. 10):72-85.
- Harake, D., V.I. Franco, J.M. Henkel, T.L. Miller, and S.E. Lipshultz. 2012. “Cardiotoxicity in childhood cancer survivors: strategies for prevention and management.” Future Cardiol. 8(4):647-70.
- Heit, J.A., W.M. O’Fallon, T.M. Petterson, C.M. Lohse, M.D. Silverstein, D.N. Mohr, and L.J. Melton. 3rd . 2002. “Relative impact of risk factors for deep vein thrombosis and pulmonary embolism: a population-based study.” Arch. Intern. Med. 162(11):1245-8.
- Inagaki, J., V. Rodriguez, and G.P. Bodey. 1974. “Proceedings: causes of death in cancer patients.” Cancer 33(2):568-73.
- Kufe, D.W., R.E. Pollock, R.R. Weichselbaum et al. 2003. Cancer Medicine, 6th edition. Hamilton (ON): BC Decker. Mirrakhimov, Aibek E., Prakruthi Voore, Maliha Khan, and Alaa M. Ali. 2015. “Tumor lysis syndrome: a clinical review.” World J. Crit. Care Med. 4(2):130-8.
- Moja, L., L. Tagliabue, S. Balduzzi, E. Parmelli, V. Pistotti, V. Guameri, and R. D’Amico. 2012. “Trastuzumab containing regimens for early breast cancer.” Cochrane Database Syst. Rev. (4):CD006243. doi: 10.1002/14651858. CD006243.pub2.
- Priori, S.G., C. Blomström-Lundqvist, A. Mazzanti, N. Blom, M. Borggrefe, J. Camm, P.M. Elliott, D. Fitzsimons, R. Hatala, G. Hindricks, P. Kirchhof, K. Kjeldsen, K.H. Kuck, A. Hernandez-Madrid, N. Nikolaou, T.M. Norekvål, C. Spaulding, and D.J. Van Veldhuisen. 2015. “2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC).” Eur. Heart J. 36(41):2793-867.
- Rabkin, S.W., and P. Sunga. 1987. “The effect of doxorubicine (adriamycin) on cytoplasmic microtubule system in cardiac cells.” J. Mol. Cell. Cardiol. 19(11):1073- 83.
- Roden, D.M. 2004. “Drug-Induced Prolongation of the QT Interval.” N. Engl. J. Med. 350(10):1013-22.
- Schultz-Hector, S. 1992. “Radiation-induced heart disease: review of experimental data on dose response and pathogenesis.” Int. J. Radiat. Biol. 61(2):149-60.
- Shoemaker, Laura K., Umesh Arora, and C.M. Rocha Lima. 2004. “5 Fluorouracilinduced coronary vasospasm.” Cancer control 11(1):46-9. The American College of Obstetricians and Gynecologists. 2014. “Committee opinion no. 606: Options for prevention and management of heavy menstrual bleeding in adolescent patients undergoing cancer treatment.” Obstet. Gynecol. 124(2 Pt 1):397- 402.
- Volkova, M., and R. 3rd Russell. 2011. “Anthracycline cardiotoxicity: prevalence, pathogenesis and treatment.” Curr. Cardiol. Rev. 7(4): 214-20.
- Von Hoff, D.D., M.W. Layard, P. Basa, H.L. Jr Davis, A.L. Von Hoff, M. Rozencweig, and F.M. Muggia. 1979. “Risk factors for doxorubicin-induced congestive heart failure.” Ann. Intern. Med. 91(5):710-7.
- Yeh, E.T., A.T. Tong, D.J. Lenihan, S.W. Yusuf, J. Swafford, C. Champion, J.B. Durand, H. Gibbs, A.A. Zafarmand, and M.S. Ewer. 2004. “Cardiovascular complications of cancer therapy: diagnosis, pathogenesis, and management.” Circulation 109(25):3122-31.
- Zamorano, J.L., P. Lancellotti, D. Rodriguez Muñoz, V. Aboyans, R. Asteggiano, M. Galderisi, G. Habib, D.J. Lenihan, G.Y. Lip, A.R. Lyon, T. Lopez Fernandez, D. Mohty, M.F. Piepoli, J. Tamargo, A. Torbicki, and T.M. Suter. 2016. “2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC).” European Heart Journal 37(36):2768-801.








